氟硅酸钾容量法测定二氧化硅的探讨与应用
李方科 黄荣荣
(青岛即墨中联水泥有限公司,山东 青岛 266200)
在氟硅酸钾容量法系统分析中,保证样品能够分解完全是关键,一个样品是否容易被酸分解,主要取决于样品中碱性氧化物与酸性氧化物的比例,比例越高越容易被酸分解,样品用无水碳酸钠或氢氧化钠进行烧结或熔融,就是为了增加样品中碱性氧化物的比例,制备成能够完全被酸分解的试样溶液。本文从测定基本原理、操作过程中的要点以及注意事项进行了阐述。
1 测定基本原理
试样用碱熔法分解后,在有过量的F+、 K+存在的强酸溶液中,硅酸以K2SiF6沉淀。经过滤、洗涤、中和沉淀和滤纸上的残余酸以后,沉淀在沸水中水解,生成与硅酸的物质的量相当的HF,然后以酚酞为指示剂,用氢氧化钠标准溶液滴定,到化学计量点后,微过量的氢氧化钠使溶液由无色变为微红色。根据氢氧化钠标准滴定溶液的加入量和浓度,计算试样中二氧化硅的质量百分数。上述过程的反应如下:
(1)
(2)

(3)

(4)
2 操作要点及注意事项
2.1 根据样品的性质选择合适的熔融方法
在水泥生产中,石灰石、熟料、生料、矿渣、水泥,这些样品的碱性氧化物含量高,比较容易被酸分解,但是由于石灰石和熟料中有一定量的结晶硅和不溶物,不容易被酸分解,因此在氟硅酸钾系统分析中,需要用氢氧化钠进行熔样(单独称样测定二氧化硅需用氢氧化钾熔样),而砂岩、硅石、页岩、粉煤灰、煤矸石、炉渣、火山灰、铁矿石、铜渣等样品,碱性氧化物含量很低,酸性氧化物含量比较高,不容易被酸分解,必须用碱进行熔融,然后再酸化,常用的碱性熔剂是无水碳酸钠和氢氧化钠等。
2.2 样品熔融过程及试验条件的要求
采用银坩埚-氢氧化钠进行熔样,0.500 0g试样氢氧化钠加入量一般为6~7g,熔融温度为650~700℃,熔融时间为15~20min。石灰石、熟料、生料、矿渣、水泥等样品,氢氧化钠可以少加一些,熔融温度低一些,熔融时间短一些。而砂岩、硅石、页岩、粉煤灰、煤矸石、炉渣、火山灰、铁矿石、铜渣等样品,氢氧化钠可以多加一些,熔融温度高一些,熔融时间长一些。样品加入氢氧化钠后,银坩埚盖要留有一定缝隙,高温炉要从低温开始升起,从低温开始熔融,如果直接在650~700℃的高温炉中熔融,氢氧化钠急剧融化,反应剧烈,熔融物容易产生飞溅,也容易腐蚀高温炉炉膛,导致样品有所损失。也不利于后期的脱埚和银坩埚的洗涤。
2.3 样品熔融物的脱埚
样品在银坩埚内高温下熔融分解完全后,需要将银坩埚从高温炉中取出,待高温熔融物冷凝后,在烧杯中将银坩埚内的熔融物用沸水浸出,这个过程称为脱埚。
在脱埚过程中,由于浸出物呈强碱性,并且温度高,如果脱埚时间过长,易腐蚀玻璃,导致二氧化硅测定结果偏高,因此要求尽量缩短脱埚时间,让熔融物快速被沸水浸出。
对于水泥、熟料、石灰石、生料、矿粉等一些高钙样品,由于脱埚比较困难,如果按常规将高温熔融物自然冷却至室温,再用沸水脱埚速度会特别慢,往往需要将烧杯放在电炉上加热好长时间,才能将银坩埚内的冷凝熔融物彻底浸出,对烧杯的腐蚀程度极大。可在银坩埚及熔融物冷却到100℃左右用沸水进行脱埚,温度高些脱埚速度也比较快,但要防止溶液溅失。其它样品由于脱埚比较容易,可以冷却到接近室温再进行脱埚。
为了缩短冷凝熔融物在烧杯中的浸出时间,将银坩埚从高温炉取出后,在熔融物凝固前,可用不锈钢镊子夹住银坩埚上口的边缘,仔细摇动及倾斜旋转,使熔融物均匀地附在银坩埚的内壁凝固,以增大脱埚时冷凝熔融物与热水的接触面积,缩短浸出时间。
2.4 浸出物的酸化
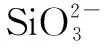
2.5 氟硅酸钾沉淀的生成与陈化
该过程的关键是保证溶液中的硅酸根离子全部生成大颗粒的氟硅酸钾沉淀。根据反应式(1)及(2),F-和H+前面的系数都是6,因此需要大量的氟离子和足够的酸度,因此在氟硅酸钾容量法测定二氧化硅时,150g/L氟化钾的加入量是10ml,浓硝酸的加入量是15ml。另外,在反应式(2)中,根据化学平衡移动及沉淀的溶度积原理,增加反应物中K+的浓度,有利于反应向右进行,使K2SiF6沉淀完全,因此在加入固体氯化钾时,要仔细搅拌,直到溶液完全饱和并有少量固体氯化钾析出。放置15~20min,一方面是为了K2SiF6沉淀完全,另一方面也是一个沉淀的陈化过程,使K2SiF6沉淀颗粒增大,便于过滤和洗涤,防止由于过滤和洗涤速度过慢而引起K2SiF6沉淀水解,同时又可以避免因为氟硅酸钾沉淀颗粒过细而产生的漏滤现象。但是氟硅酸钾沉淀的放置时间不能太长,否则有些铝含量较高的样品很容易生成氟铝酸盐沉淀,引起测定结果偏高。
固体氯化钾的加入量达到溶液饱和并有少量析出即可, 不能过量太多,否则将会给过滤和洗涤带来困难,引起正误差。另外,试样溶液加入浓硝酸后溶液温度会升高,热溶液氯化钾达到饱和后,在放置15~20min后溶液温度将会降低,会有很多的固体氯化钾析出,因此溶液加入硝酸后必须冷却到室温,再加固体氯化钾。
2.6 氟硅酸钾沉淀的过滤洗涤与中和对结果的影响
该过程的关键是将氟硅酸钾沉淀从酸性溶液中分离,便于将纯净的氟硅酸钾沉淀水解成氢氟酸,然后用氢氧化钠滴定。由于氟硅酸钾沉淀在低酸度和室温条件下很容易水解,因此要求过滤、洗涤与中和速度快,操作手法要得当,尽量减少操作过程中氟硅酸钾沉淀的水解损失,尽量减少滤纸中夹杂的残余酸。如果滤纸中夹杂的残余酸多,中和过程的时间较长,也容易引起氟硅酸钾沉淀水解。
过滤操作时,要使用标准的塑料漏斗,漏斗水柱要做好,不能有气泡,以加快过滤速度。为了加快过滤速度和改善过量部分固体氯化钾的洗涤效果,过滤时不能将溶液搅混,应将沉淀及过量的固体氯化钾留在塑料烧杯的底部。用50g/L的氯化钾水溶液洗涤的目的,是将过量部分的固体氯化钾溶解,另一个目的是尽量洗去沉淀和滤纸中夹杂的残余酸。根据同离子效应,用50g/L的氯化钾水溶液洗涤,可以抑制氟硅酸钾沉淀的水解。
过滤时慢慢将塑料烧杯中上部的清夜转移到塑料漏斗的滤纸内,速度要均匀,保持漏斗滤纸内的液面不超过1/2高度,这样操作滤纸的上部不会夹杂太多的酸,便于滤纸残余酸的洗涤。等到清夜全部转移后,用50g/L的氯化钾水溶液洗瓶,沿塑料杯壁洗涤一次,用量大约是10ml,然后将塑料杯倾斜,用塑料棒搅拌,使多余的固体氯化钾溶解,将溶液及沉淀全部转移于漏斗滤纸内,再用氯化钾水溶液沿是杯壁洗涤塑料杯一次,用量为5~10ml,搅拌,再次将溶液转移于漏斗滤纸内,待漏斗滤纸内的溶液全部滤完后,用氯化钾水溶液洗涤漏斗上的滤纸,用量为5~10ml,主要目的是洗涤滤纸内夹杂的残余酸,氯化钾水溶液三次洗涤的总量不超过25ml,否则易引起氟硅酸钾沉淀的水解。
整个过滤、洗涤操作过程中,塑料棒不允许放在塑料杯的尖嘴处,因为尖嘴处有酸溶液,沾在塑料棒上不好处理。
洗涤完后,将滤纸及沉淀取下,放在原塑料杯中,用塑料棒将滤纸展开,用50g/L的氯化钾乙醇溶液洗瓶沿杯壁洗涤一圈,用量大约为10ml,塑料棒也应稍微洗一下,加入酚酞指示剂后,开始用塑料棒压住滤纸中心沿杯底搅拌、挤压滤纸,使滤纸内夹杂的残余酸进入溶液,然后右手握住塑料杯,食指压住塑料棒的上部,下端压住滤纸,摇动塑料杯,用氢氧化钠溶液中和塑料杯内溶液的残余酸,待溶液变红后,停止滴加氢氧化钠溶液,继续搅拌、挤压滤纸,溶液红色消失后继续滴加氢氧化钠进行中和。中和过程中,氢氧化钠溶液不得滴加在杯壁及塑料棒上,否则容易引起中和过了,结果偏低。
在氟硅酸钾容量法测定二氧化硅中,过滤、洗涤和中和是三个很重要的过程。如果过滤手法不科学,过滤速度慢,洗涤时间长,则加大了氟硅酸钾沉淀的水解倾向。洗涤过程中如果50g/L的氯化钾水溶液用量大,氟硅酸钾沉淀则容易水解。如果50g/L的氯化钾水溶液用量少,则滤纸内夹杂的残余酸多,中和时间变长,氢氧化钠溶液用量多,中和介质中乙醇的浓度降低,同样也会引起氟硅酸钾沉淀的水解。氟硅酸钾沉淀在50g/L的氯化钾乙醇溶液溶解度最低,采用氯化钾-乙醇溶液为中和介质,就是为了降低中和过程中氟硅酸钾沉淀的水解(溶解)程度。因此,操作手法很重要,是保证结果准确度的关键。
2.7 氟硅酸钾沉淀的水解与滴定
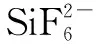

上面的两个反应都是吸热反应,因此水解时体积要大,温度要高,水解才能完全。因此要加刚煮沸并且中和过的水,并且体积在200ml以上。
另外,在反应式(3)中,加入热水后水解反应并不是立即完成,只有在加入氢氧化钠标准滴定溶液后,随着标准滴定溶液的加入和滴定反应(4)的进行,滴定溶液中水解产物HF的浓度降低,水解反应继续进行,直到滴定终点时水解反应才趋于完全,因此要求滴定终点温度不低于60℃,所以说滴定速度不能太慢,可以适当加快。
3 其它影响测定结果的因素
3.1 试剂空白对测定结果的影响
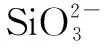
3.2 标准溶液对测定结果的影响
3.2.1 温度对标定氢氧化钠的影响
氢氧化钠标准滴定溶液浓度准确与否,直接影响到分析结果的准确度。温度越高,标定出的氢氧化钠浓度越高。
3.2.2 吸收空气中的二氧化碳对氢氧化钠浓度的影响
氢氧化钠固体试剂容易吸收空气中的二氧化碳,固体试剂的外表附有一定量的碳酸钠,配制标准滴定溶液的蒸馏水也溶有少量的二氧化碳,已经确定了准确浓度的氢氧化钠标准滴定溶液,如果保存不当也容易吸收空气中的二氧化碳,分析二氧化碳对标准滴定溶液以及二氧化硅测定结果的影响情况有重要意义。
(1)标准滴定溶液标定前含有二氧化碳:
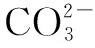
由于标准滴定溶液除了含有氢氧化钠外还含有少量碳酸钠,标定时采用酚酞指示剂,终点产物呈弱碱性,标定过程中的相关反应如下:
NaOH和KHP的反应:

(1)
Na2CO3和KHP的反应:

(2)
用NaOH滴定HF时用的是酚酞指示剂,终点产物呈弱碱性,相关的滴定反应如下:
NaOH和HF的反应:

(3)
Na2CO3和HF的反应:

(4)
根据(2)和(4)两个反应式,Na2CO3和KHP及HF的反应关系都是1∶1,表明用外表附有碳酸钠的氢氧化钠试剂和溶有二氧化碳的蒸馏水配制氢氧化钠标准滴定溶液,不影响二氧化硅的测定结果。
(2)标准滴定溶液使用后期吸收了二氧化碳:
假设氢氧化钠标准滴定溶液在后期的存放过程中吸收了空气中的二氧化碳,氢氧化钠吸收二氧化碳的反应式如下:

(5)
根据(3)、(4)、(5)三个反应式可以看出,2mol的NaOH吸收1mol的CO2生成了1mol的Na2CO3,1mol的Na2CO3只能和1mol的HF反应,相当于氢氧化钠标准滴定溶液的浓度降低,滴定HF时消耗标准滴定溶液的体积增加,从而使二氧化硅测定结果偏高。
因此,氢氧化钠标准滴定溶液应用塑料下口瓶盛装(用玻璃瓶盛装的话,氢氧化钠腐蚀玻璃,易引起溶液浓度发生变化),瓶口应安装钠石灰干燥管,防止空气中的二氧化碳进入瓶内,而且还要经常更换干燥管中的钠石灰,防止二氧化碳吸收效果变差。
4 结 论
本文重点讨论分析了采用氟硅酸钾容量法测定二氧化操作过程中出现的干扰因素及消除以及一些注意事项,从而确保测定结果更加准确,更好的应用于生产控制中。

