酰胺质子转移联合3D动脉自旋标记成像在高级别胶质瘤诊断中的应用
张攀,丁伟伟,王爱军,马艳,李健,徐梦莹,陈兵
宁夏医科大学总医院放射科,宁夏 银川 750004;*通信作者 陈兵 2269415835@qq.com
脑肿瘤是中枢神经系统较常见的疾病之一,2016年发病率居全身肿瘤第10位,死亡率居全身肿瘤第9位[1]。高级别胶质瘤、转移瘤、低级别胶质瘤及淋巴瘤作为较常见的颅内肿瘤,在治疗方法上存在巨大差异,术前采用影像学检查进行鉴别对于治疗决策尤为重要。
酰胺质子转移(amide proton transfer,APT)成像是近年较为成熟的分子影像成像方法,它基于化学交换饱和转移技术,通过施加特定的饱和脉冲使酰胺质子上氢质子饱和,并与水中的氢质子发生化学交换,通过测量交换前后氢质子信号强度的变化,无创性地探测内源性蛋白质及多肽浓度。研究表明,肿瘤细胞质内游离蛋白质及多肽含量与肿瘤良恶性相关,因此APT成像能够鉴别肿瘤良恶性,并有助于对恶性肿瘤进行分级[2-6]。3D动脉自旋标记(three-dimensional arterial spin labeling,3D ASL)通过提前激发患者动脉血中的水分子使其成为内源性示踪剂,探测组织及病变灌注水平。本研究拟使用APT及3D ASL成像分析高级别胶质瘤APT信号强度和相对脑血流量(relative cerebral blood flow,rCBF)在颅内常见肿瘤中的差异,旨在术前提高对高级别胶质瘤的诊断准确性。
1 资料与方法
1.1 研究对象 回顾性研究2020年7月30日—2021年6月22日在宁夏医科大学总医院经颅脑MR检查证实为颅内单发肿瘤的46例患者,均接受手术并获得病理结果,其中男21例,女25例;年龄10~77岁,平均(47.5±15.9)岁。纳入标准:①经手术证实为颅内肿瘤,患者术前行颅脑MR检查、3D ASL、APT序列扫描;②病灶内无钙化及出血,颅内无金属伪影;③APT和3D ASL图像质量良好。排除标准:①图像存在伪影影响观察及测量;②患幽闭恐惧症;③既往有恶性肿瘤病史。本研究经宁夏医科大学总医院伦理委员会批准(2019-426),所有患者均签署知情同意书。
46例患者中低级别胶质瘤14例,高级别胶质瘤23例,原发性中枢神经系统淋巴瘤4例(均为非霍奇金淋巴瘤),肺癌单发脑转移瘤5例。
1.2 仪器与方法 采用GE Signal Architect 3.0T超导MR扫描仪进行图像采集,使用48通道颅脑专用线圈,用泡沫固定颅脑,以避免运动伪影,所有患者扫描序列至少包含T1WI、T2WI、2D-APT、3D ASL及T1WI增强序列,在增强扫描前进行2D-APT、3D ASL图像数据采集。
常规序列扫描参数:T1WI及T1WI增强序列(TR 2 462 ms,TE 11 ms),T2WI(TR 4 600 ms,TE 103 ms),视野24 cm×24 cm,矩阵512×512,层厚6 mm,层间距1.5 mm,对比剂采用0.1 mmol/kg钆双胺。
APT扫描:采用平面回波成像序列在肿瘤最大层面进行APT图像数据采集,扫描参数:TR 3 000 ms,TE 25 ms,视野22 cm×22 cm,矩阵128×128,层厚8 mm,饱和时间500 ms×4,脉冲能量2.0 T。使用49个频率进行采集,频率表为0、±0.25、±0.5、±0.75、±1、±1.25、±1.5、±1.75、±2、±2.25、±2.5、±2.75、±3(2次)、±3.25(4次)、±3.5(8次)、±3.75(4次)、±4(2次)、±4.25、±4.5、±4.75、±5、±5.25、±5.5、±5.75、±6 ppm。
3D ASL扫描参数:TR 5 380 ms,TE 54 ms,视野24 cm×24 cm,层厚4 mm,矩阵512×512,激励次数3次,饱和时间2.0 s。
1.3 图像处理 将图像导入GE iquant 2.0工作站进行图像后处理及分析。APT图像信号高低由不对称磁化转移率(MTR)进行量化,因为在z普群中,酰胺质子共振峰位于水峰左侧3.5 ppm,故APT信号强度公式为:
1.3.1 APT图像处理 由2名具有5年以上工作经验的放射科主治医师参考T2WI、T1WI及T1WI增强序列,手动勾画感兴趣区(ROI),对于APT序列,在钆剂强化范围内沿肿瘤强化边缘勾画ROI;对于T1增强后无强化的病灶,观察T1WI、T2WI明确病灶范围,并在T1WI相沿病灶边缘勾画ROI,尽量避开坏死、出血、钙化及肿瘤血管,记录每个ROI对应的APT信号值。
1.3.2 3D ASL图像处理 参照T1增强及T2WI序列在CBF图像上放置3个面积为10~20 mm2的ROI测量病变CBF,然后取3个ROI的平均值作为病变的CBF。为消除个体差异将CBF标准化:病变区域CBF/对侧镜像脑组织CBF,所得比值为病灶区域的rCBF。
1.4 统计学方法 采用SPSS 22.0软件,计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD法;计数资料以例数表示;P<0.05表示差异有统计学意义。
2 结果
2.1 术后病理结果 14例低级别胶质瘤中,少突胶质细胞瘤7例,弥漫性星形细胞瘤(II级)6例,星形细胞瘤2级1例。23例高级别胶质瘤中,胶质母细胞瘤18例(图1),髓母细胞瘤1例,弥漫性星形细胞瘤(III级)2例,间变性星形细胞瘤(III级)2例。5例肺癌单发脑转移的病理结果:浸润性腺癌3例,小细胞肺癌1例,低分化鳞癌1例。4例非霍奇金淋巴瘤均为弥漫大B型。
2.2 高级别胶质瘤、低级别胶质瘤、肺癌脑转移瘤、非霍奇金淋巴瘤APT信号值和rCBF比较 高级别胶质瘤、低级别胶质瘤、肺癌脑转移瘤、非霍奇金淋巴瘤APT信号强度和rCBF比较,差异均有统计学意义(P均<0.05);两两比较显示,高级别胶质瘤APT信号强度高于低级别胶质瘤、低于肺癌单发脑转移灶(P均<0.05),与非霍奇金淋巴瘤APT信号强度差异无统计学意义(P>0.05)。高级别胶质瘤rCBF高于低级别胶质瘤及非霍奇金淋巴瘤(P均<0.05),与肺癌单发脑转移灶比较,差异无统计学意义(P>0.05),见表1。
表1 不同脑肿瘤APT信号强度与rCBF比较(±s)
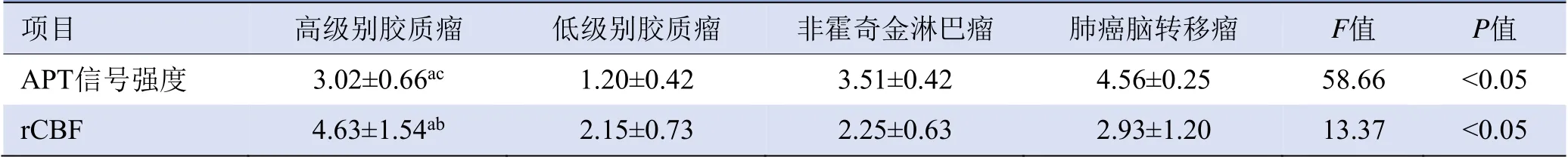
表1 不同脑肿瘤APT信号强度与rCBF比较(±s)
注:a与低级别胶质瘤比较,P<0.05;b与非霍奇金淋巴瘤比较,P<0.05;c与肺癌脑转移瘤比较,P<0.05
项目高级别胶质瘤低级别胶质瘤非霍奇金淋巴瘤 肺癌脑转移瘤F值P值APT信号强度 3.02±0.66ac 1.20±0.42 3.51±0.42 4.56±0.25 58.66 <0.05 rCBF 4.63±1.54ab 2.15±0.73 2.25±0.63 2.93±1.20 13.37<0.05
3 讨论
目前随着术前辅助放化疗及分子靶向药物的出现,恶性脑肿瘤的预后得到明显改善,但是由于不同性质脑肿瘤的治疗方法存在差异,术前明确脑肿瘤的性质和分级对于临床选择治疗方案十分重要。脑肿瘤的影像学检查主要依赖MRI,但是常规MRI序列仅能提供病变的形态学信息,对术前病变的诊断准确定性及分级存在不足。扩散加权成像、磁共振波谱、APT及灌注成像等作为能够反映肿瘤代谢信息及肿瘤血管的功能MRI检查,不仅能术前对肿瘤进行鉴别诊断,而且能在一定程度上反映肿瘤组织的分子学特征[7-9],对于术前明确诊断及制订针对性的治疗方案具有重要作用。
3.1 APT对脑肿瘤鉴别诊断的应用 APT成像是反映细胞质内蛋白质含量的影像学技术,其信号强度受细胞质蛋白质、多肽含量及pH值的影响。通常,APT信号强度与细胞质内蛋白质含量及细胞质pH值呈正相关[10-11],由于恶性肿瘤细胞密度明显增高、细胞质内游离蛋白质含量增加,所以恶性肿瘤APT信号通常明显高于良性肿瘤[12];此外,恶性肿瘤常因血供不足而进行无氧酵解,导致pH值减低,进而引起APT信号强度减低,但部分研究表明肿瘤以蛋白质及多肽合成导致APT信号增高为主[13]。本研究中,高级别胶质瘤的APT信号强度明显高于低级别胶质瘤,与Zhang等[14]的研究结果一致。高级别胶质瘤与非霍奇金淋巴瘤的APT信号强度无显著差异,与Jiang等[15]的结果一致。尽管非霍奇金淋巴瘤较高级别胶质瘤的核浆比高、细胞质含量较少,但前者质地常较均匀,这可能是两者APT信号差异较小的原因。本研究中,高级别胶质瘤的APT信号与肺癌脑转移瘤存在差异,Yu等[16]认为高级别胶质瘤与单发脑转移瘤肿瘤核心APT信号强度无显著差异,与本研究结果存在一定的差异,其原因可能是:①该研究纳入肺癌、乳腺癌、结肠癌及肝癌等单发脑转移45例,而本研究仅纳入5例肺癌单发脑转移瘤,可能会导致测量数据存在偏倚,影响统计分析的准确性;②该研究在增强后病变强化区域内放置5个大小一致的ROI计算均值获取病灶瘤核心平均APT信号值,而本研究采用勾画增强后病变强化轮廓获取病灶APT信号值,可能会对结果产生一定影响。俞璐[13]采用极值法及整体法测量头颈部肿瘤APT信号强度,结果发现两种方法获得的受试者工作特征曲线下面积无显著差异。然而对于颅内肿瘤,鲜有极值法与整体法勾画ROI测值差异的报道。
3.2 rCBF对脑肿瘤鉴别诊断的应用 临床工作中通常采用T1增强扫描观察脑肿瘤强化程度,通过肿瘤强化程度对肿瘤进行鉴别和定性,然而脑肿瘤的强化程度仅能反映病变对血-脑屏障的破坏程度,并不能真实地反映脑组织的灌注状态,而且临床上部分高级别胶质瘤T1增强后不会出现强化,因而可能会对病灶实际病理分级造成误判[17]。肿瘤血管生成在颅内肿瘤良恶性鉴别中具有重要作用,由于恶性脑肿瘤代谢旺盛,通常会比良性肿瘤生成更多的肿瘤血管,常规MR灌注成像和3D ASL成像均能反映肿瘤血管生成情况,但3D ASL无需注射造影剂,能够更真实地反映病变组织的灌注状态,临床应用广泛。本研究中,高级别胶质瘤的rCBF显著高于非霍奇金淋巴瘤及低级别胶质瘤,其原因为高级别胶质瘤细胞增殖活跃,常会导致肿瘤血管发育异常,引起病灶rCBF增加。而原发性中枢神经系统淋巴瘤和低级别胶质瘤很少形成肿瘤血管,因此病灶通常表现为灌注减低[18]。因此,3D ASL可以辅助鉴别诊断脑高级别胶质瘤与原发性中枢神经系统淋巴瘤、低级别胶质瘤。既往研究显示,高级别胶质瘤的rCBF明显高于脑转移灶,其原因为高级别胶质瘤内的毛细血管网密度明显大于脑转移瘤,因此与脑转移瘤相比,高级别胶质瘤通常表现为高灌注[19-20]。本研究中这一表现并不显著,与文献报道存在一定的差异,可能是由于本研究纳入的单发脑转移瘤较少,影响测量结果的准确性;或者是脑转移瘤原发灶的组织病理学特性不同,从而导致与文献报道结果存在差异。
3.3 本研究的局限性 ①本研究纳入肺癌单发脑转移瘤及中枢神经系统淋巴瘤较少,今后将纳入更多病例进行研究,提高统计分析的准确性;②本研究未使用APT及3D ASL序列相关测值对高级别胶质瘤相关分子分型及术后病例进行随访分析,后期需进一步扩大样本量进行研究。
总之,APT成像是一种安全、无创的反映细胞内源性蛋白质代谢水平的成像技术,APT联合3D ASL成像有助于鉴别诊断脑高级别胶质瘤与低级别胶质瘤、原发性中枢神经系统淋巴瘤、脑转移瘤。

