CU低共熔离子液体中锌沉积的电化学行为研究
丁佳琪,郝建军*,王薪惠,赵荣兴
(1.沈阳理工大学环境与化学工程学院,辽宁 沈阳 110159;2.中国石油辽河石化公司,辽宁 盘锦 124000)
Abbott等[1]21世纪初首次提出了低共熔离子液体,是指具有氢键受体(如季铵盐等)和氢键供体(如羧酸、酰胺和多元醇等)的物质按照一定的比例进行混合而形成的混合物。传统的离子溶液具有导电性好、电化学窗口宽、稳定性好等优点[2],而低共熔离子液体除了具有传统离子液体的特性外,还对空气与水的敏感性弱并且更加易得、环保,是良好新一代绿色溶剂[3],在溶解和分离[4-5]、催化[6]、制备材料[7]、电池[8]、超级电容器[9]和电沉积[10-11]方面都有应用。
低共熔离子液体作为一种新型介质,可以有效地避免电沉积过程中的析氢现象,减少了镀层的腐蚀[12-13],并且无废水排放[14],因此在电沉积领域也得到了广泛的关注。马军德等[15]在咪唑类离子液体中研究了锌电沉积生长过程,发现锌离子在钨电极上的三维瞬时形核。翟秀静等[16]证明了在TMAC(四甲基氯化铵)离子液体中,锌在铜电极上的生长过程是受扩散控制的非可逆过程。目前CU低共熔离子液体由于成本低、原料易得、合成方式简单、稳定性好、电化学窗口宽且氯化胆碱和尿素环保可降解等优点成为研究热点。本文以ZnCl2/CU低共熔离子液体作为电解液,研究了锌在铜电极上电沉积的电化学行为。
1 实验
实验中阴极使用纯铜片,规格为5 cm×2 cm×1 mm,阳极使用不溶性涂层钛电极,阴阳极面积比1∶1,试剂均为分析纯。
将氯化胆碱(ChCl)和尿素(Urea)分别放置在真空干燥箱中,在85℃条件下干燥24h。将摩尔比为1:2的ChCl与Urea在70℃下进行充分混合,直到形成无色透明状CU液体作为基础液,在基础液中加入0.5 mol/L的ZnCl2,继续在70℃条件下搅拌2 h,待ZnCl2充分溶解后制备得到ZnCl2/CU低共熔离子液体作为电解液。
电沉积处理流程为:纯铜试样打磨处理(分别经过400#、800#、1200#、2000#砂纸处理)→水洗→脱脂(10 g/L NaOH,2 g/L OP-10,25 g/L NaCO3,温 度70℃,6 min)→水洗→活化处理(5%HCL溶液,30 s)→水洗→电沉积锌(ZnCl2/CU低共熔离子液体作为电解液)→水洗→干燥。
电极循环伏安曲线测试和计时电流曲线测试采用CH1660e型号电化学工作站,ZnCl2/CU低共熔离子液体作为电解液,实验中采用三电极体系,辅助电极为铂电极,参比电极选用银电极,工作电极使用铜电极(有效面积1 cm2)。电化学测试温度均为70℃,循环伏安测试区间为-2 V~2V,计时电流取值在-0.8~1.0 V之间。
使用VEGA3XMU型号扫描电子显微镜(SEM)对锌镀层的微观形貌进行观察,使用6100型号X射线衍射仪(XRD)对锌镀层的结晶取向进行分析。
2 结果及讨论
2.1 循环伏安分析
图1是CU低共熔离子液体的循环伏安(CV)曲线,测试条件是温度70℃,扫描速率100mV·s-1,扫描区间-2~2 V,先负扫后正扫。由图1可以看出初始电位为2.0 V,负扫至-1.4 V时,电流开始急剧下降,在正向扫描至0.8 V时电流开始升高,表明在CU低共熔离子液体的中阳极极限电位为0.8 V,阴极极限电位为-1.4 V,电化学窗口为2.2 V。

图1 CU低共熔离子液体的循环伏安曲线Fig.1 Cyclic voltammetry curve of CU deep eutectic solvents
图2是含有0.5 mol/LZnCl2的ZnCl2/CU低共熔离子液体在不同扫描速率下的循环伏安曲线,测试条件是温度70℃,扫描区间-1.4 V~0.8 V,先负扫后正扫。对于可逆电极反应,还原峰电位Epc与扫描速率v无关,还原峰电流Jpc与氧化峰电流Jpa比值为1,而且氧化峰与还原峰面积相同,不可逆电极反应还原峰电位Epc与扫描速度v有关,氧化峰与还原峰面积不相同。由图2可看出,随扫描速率的增加,还原峰电位出现负移,且还原峰电流Jpc与氧化峰电流Jpa比值均不为1(见表1)。初步说明锌在ZnCl2/CU低共熔离子液体中的电沉积过程是不可逆过程。
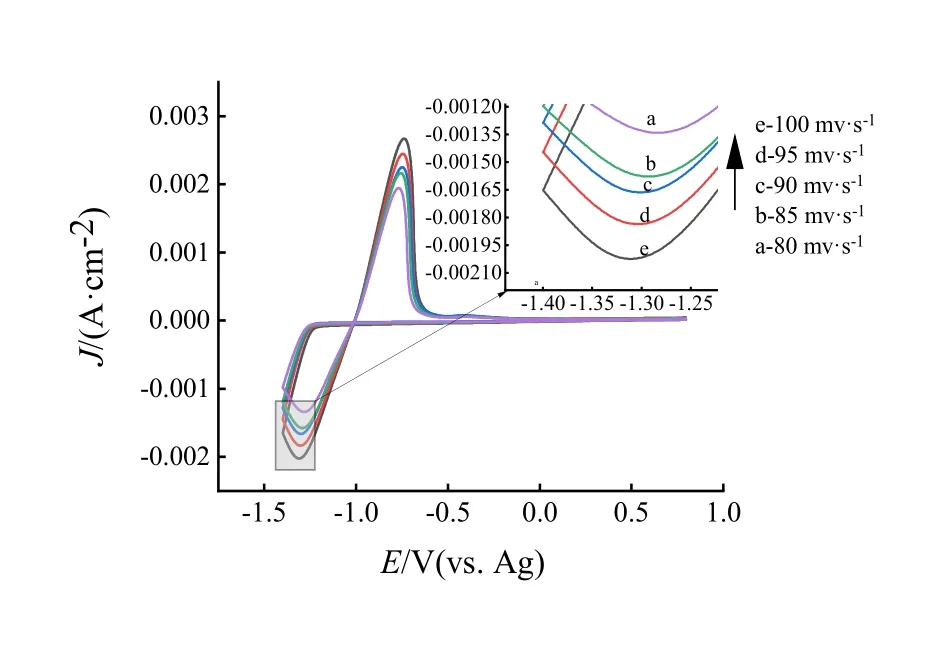
图2 不同扫描速率下的循环伏安曲线Fig.2 CV curves at different scan rates
表1为不同扫描速度下ZnCl2/CU低共熔离子液体循环伏安图的数据,从表中数据可看出,随扫描速率增加,还原峰电位逐渐负移(从-1.287 V到-1.313 V),电流密度逐渐升高(从-1.342mA·cm-2到-2.023 mA·cm-2)。氧化峰电位逐渐正移(从-0.765 V到-0.733 V),电流密度逐渐升高(从1.943 mA·cm-2到2.663 mA·cm-2),如图3还原电位E和lgv之间存在线性关系,与不可逆反应特性一致。

表1 不同扫描速率下的循环伏安图数据Tab.1 Cyclic voltammogram data at different scan rates
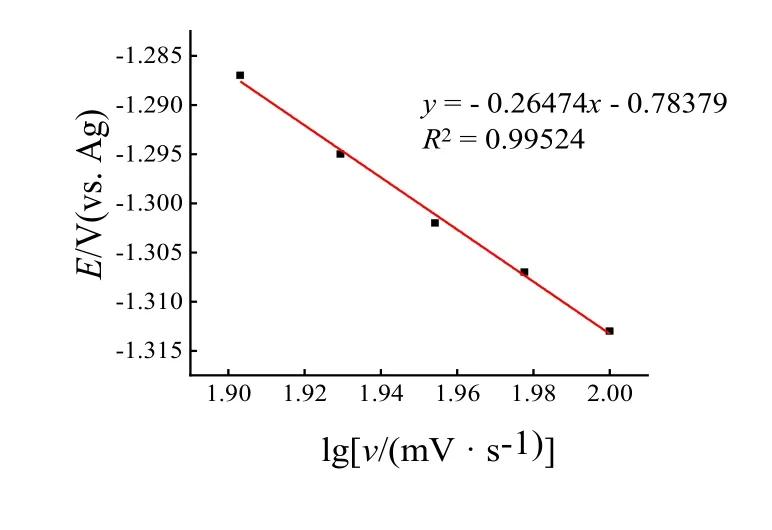
图3 还原电位与lgv的关系Fig.3 The relationship of E~lgv
电化学反应的控制步骤一般分为电极表面反应控制和扩散传质控制两部分,为进一步分析锌在ZnCl2/CU低共熔离子液体中还原的步骤,研究了峰值还原电流J与v1/2的关系(图4)。电流J与v1/2呈正比,说明反应过程受扩散控制。因此,锌在ZnCl2/CU低共熔离子液体中还原过程为扩散控制下的不可逆反应。

图4 还原电流与v1/2的关系Fig.4 The relationship of J~v1/2
2.2 计时电流分析
图5是在不同电位下锌在ZnCl2/CU低共熔离子液体中的计时电流曲线,从图5可以看出,随着施加电位逐渐变负,形核弛豫时间逐渐减小,峰值电流密度逐渐变大。说明成核时间逐渐变短,成核速率在逐渐变快,这是由于对体系中施加的电位变负时,使工作电极表面活位点数目变多,令双电层的充电时间缩短,促进了低共熔离子液体体系中的金属锌的电结晶成核。在异质基体上电沉积过程一般为三维形核模式[17]。通过实际电流的函数表达式可知,随时间变化,在二维成核生长过程中电流最终趋近于零,而三维成核生长则趋近于一个不为零的电流值[18],因图5最终电流不趋于零,可以判断出锌的成核生长方式为三维形核生长。

图5 不同电位的计时电流曲线Fig.5 Chronoamperometric curves at different potentials
为了进一步探究锌的成核方式为三维瞬时成核还是三维连续成核[19],对计时电流曲线进行无因次处理,三维瞬时成核和三维连续成核的无因此表达式为:

Jm和tm是曲线上的电流极大值及对应的时间。
图6为不同电压下的计时电流曲线经过无因次处理后的(J/Jm)2-t/tm曲线和式(1)、式(2)的模型曲线。经实验数据曲线与模型曲线的对比可以看出,无因次处理过的实验数据曲线更接近于三维瞬时成核模型曲线。因此,Zn在ZnCl2/CU低共熔离子液体中的电结晶过程属于三维瞬时成核。
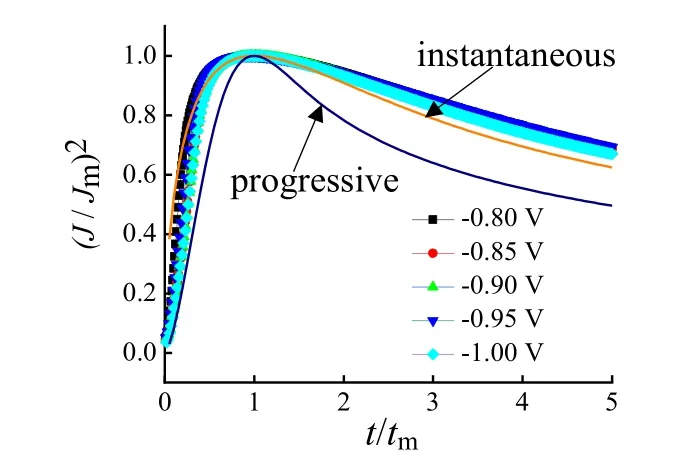
图6 电流-无量纲时间曲线与三维成核模型的比较Fig.6 Comparison of current-dimensionless time curves and 3D nucleation model
2.3 锌镀层的微观形貌及物相分析
图7是在不同电流密度下,电沉积20 min的锌镀层SEM图。由图7可以看出锌镀层中晶粒排列紧密,均匀平整。随着电流密度的上升,锌镀层的微观形貌是由不规则的片状结构向六边形片状结构转变。这是由于在相同的电沉积时间下,高的电流密度使其形核速度加快并且可以使锌镀层的晶粒规则、均匀。当电流密度过高时,锌镀层以不规则的多边形形貌为主。

图7 不同电流密度下锌镀层的SEM图Fig.7 SEM images of zinc coatings at different current densities
图8是不同电流密度下锌镀层的XRD谱图。可以看出在特征峰为38.98 °、43.22 °、54.33 °、70.63°处依次检测出Zn(100)、Zn(101)、Zn(102)、Zn(110)的存在,从图中可以看出随着电流密度的增大,锌的晶面的峰强度逐渐升高,晶相含量增高,锌镀层增厚,衍射峰高而尖,说明电流密度的增加提高了电沉积锌的结晶度[20],对锌的沉积有利。在50.67°、74.68°处有特征峰Cu(200)和Cu(220)的存在,这是由于X射线穿透镀层检测到基体而引起的。表2为不同电流密度下锌镀层的晶面指数和织构度[Tc(hkl)]。从表中可以看到,当电流密度为1.0 A·dm-2条件下择优于晶面(101)生长,当电流密度为1.2 A·dm-2条件下晶面(102)和(110)优先生长,而在电流密度为1.4 A·dm-2时晶面(100)优先生长。
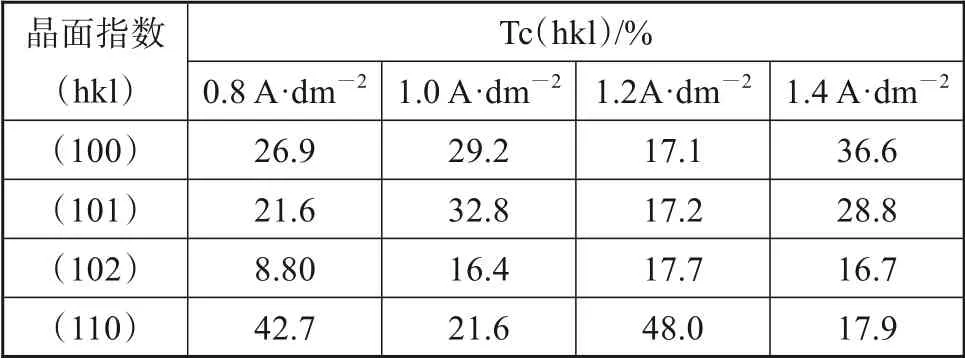
表2 不同电流密度下的锌镀层织构系数Tab.2 Texture coefficient of zinc coatings under different current densities

图8 不同电流密度下的XRD图Fig.8 XRD patterns at different current densities
3 结论
(1)CU低共熔离子液体的电化学窗口为2.2 V。锌在ZnCl2/CU低共熔离子液体中的电沉积过程是扩散控制下的不可逆过程,锌的形核过程遵循三维瞬时成核规律。
(2)在铜基体表面电沉积得到的锌镀层表面形貌随着电流密度的变化,由不规则多边形向规则的六边形转变,并且随着电流密度的升高,镀锌层的锌晶体结晶取向由(110)向(101)及(100)转变。

