海水小球藻-芽孢杆菌复合体系去除海水养殖中氮磷污染的研究❋
刘丽平,李 赟,潘鲁青,邱若怡,宋佳琦
(海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003)
长期以来,集约化水产养殖为中国渔业经济的发展做出了巨大贡献,但也造成过量氮、磷化合物流入水环境,对水体营养状态和水生动植物健康产生了不利影响[1]。海水养殖作为水产养殖的重要组成部分,近年来,其养殖面积总体保持稳定,水产品产量逐年上升[2]。相应地,海水养殖也面临着严峻的氮、磷污染问题。据报道,用于集约化海水养殖的饲料只有小部分能转化为水生动物的生物量,约75%的氮、磷残留在饲料和动物粪便中,并通过微生物分解释放入水体[3]。一方面,高浓度的溶解性无机营养物(尤其是氨和亚硝酸盐)会导致水质恶化、病原微生物增加,并对鱼、虾类养殖动物具有毒害作用,加剧了水产病害爆发的风险[4]。另一方面,富含氮、磷的养殖废水往往未经适当处理就排入邻近水域,迅速改变邻近水域水体营养水平,导致其富营养化[5]。因此,采用适当的技术处理海水养殖水和海水养殖废水以减少海水生态系统的氮、磷含量成为确保渔业可持续发展的必要环节。生物方法因其安全、高效、二次污染少、可生产附加产品等特点成为养殖系统水质清洁技术中极具潜力的选择[6]。
对微藻-细菌的研究表明,微藻与共生细菌之间存在营养交换、信号转导和基因转移等复杂的相互作用[7],它们中的某些类群可结合成天然的净水系统,为藻-菌协同实现高效氮、磷去除提供了生态基础[8]。当前已有大量关于细菌或微藻用于生物法处理工业废水和生活污水的报道,但其用于水产养殖环境安全、高效脱氮除磷的研究相对较少[6]。根据以往的研究,大部分脱氮菌并不兼具高效除磷能力,难以完成对养殖水体氮、磷的同步去除[9]。此外,养殖水体碳氮比通常低于5,碳源不足极大限制了细菌的氮去除能力[3]。在低碳氮比条件下微藻能够进行自养代谢合成高效去除废水中氮和磷[10]。然而,微藻单独处理废水时因藻类的过度生长而大量消耗二氧化碳(CO2),从而导致水体的pH上升,同时释放大量有机碳,致使出水水质恶化[11]。研究表明,藻-菌联合培养有望解决上述问题[11]。在藻-菌联合处理废水的研究中,营养交换被认为是微藻-细菌复合体系协同高效的主要内在机制:异养细菌消耗氧气(O2),释放CO2,并将有机物分解为无机物;微藻吸收无机氮、磷和CO2合成生物质,并释放O2[12-13]。由于细菌和微藻的代谢互补性,微藻-细菌构建的复合体系对复杂的污水环境具有更强的适应性,通常能够获得高于微藻或细菌单独处理的氮、磷去除效率[12]。一项研究采用小球藻(Chlorellavulgaris)C7与细菌的耦合系统处理高强度海水养殖废水,去除了68.8%的氨,并通过收获微藻最大限度地回收资源[14]。一项采用EM菌与小球藻联合处理水产养殖废水的研究获得了99.15%的磷去除率,且与细菌或微藻单独处理相比,联合处理的水体的溶解氧含量和pH更稳定[15]。当前采用微藻与功能菌群构建的高效复合体系已被用于废水处理,但废水多变的理化成分和生物组成加之菌群自身生物结构的复杂性,使得维持复合体系的稳定性仍面临挑战,也不利于深入探究微藻-细菌的相互作用关系[16]。据此,相关研究开始采用单一细菌和微藻构建复合体系,经过实验室条件下培养和优化后投入实际应用,以增加废水处理效益[8]。目前单藻-单菌复合体系多被用于处理氮、磷含量较高的淡水废水,应用其处理氮、磷含量相对较低且具有一定盐度的海水养殖水和海水养殖废水的研究仍有待扩充[11]。
本研究采用海水小球藻(Chlorellasp.)MACC/C95和分离自海水养殖池塘的一株具有脱氮功能的芽孢杆菌(Bacillussp.)SD148BN14构建了一种微藻-细菌复合体系。对该复合体系中小球藻和菌株SD148BN14的相互作用以及环境因素对藻-菌复合体系氮去除率的影响进行详细探究,并将该复合体系应用于实际海水养殖水和海水养殖废水处理。此研究为采用原位脱氮细菌与小球藻协同提高水体氮、磷去除效率,实现水产养殖环境氮、磷污染的资源化处理提供了重要参考。
1 材料与方法
1.1 微藻、细菌和培养基
海水小球藻MACC/C95由中国海洋大学微藻种质库提供,采用灭菌的f/2培养基[15],在光照强度4 000 lx、温度25 ℃、光暗比12 h∶12 h条件下培养。采用浓度分别为100 mg/L的氨苄青霉素、链霉素、卡那霉素、庆大霉素联合处理小球藻以去除其携带的细菌:将小球藻以10%的比例接种在含混合抗生素的f/2液体培养基中培养5 d后,转入无抗生素的f/2液体培养基中继续培养。重复2次后,在f/2琼脂平板上反复划线,获得纯化藻株并转入无抗生素的f/2液体培养基中继续培养,定期取培养物涂布于LB琼脂平板上,在28 ℃下黑暗培养7 d。LB平板上没有细菌生长,视为小球藻除菌成功。
芽孢杆菌SD148BN14(Genbank登录号:MN988752.1)由中国海洋大学水产动物环境生理学研究室从山东东营的凡纳滨对虾(Litopenaeusvannamei)养殖池塘中分离并置于25%甘油中-80 ℃保存[17]。菌株在使用前接种于LB液体培养基,在28 ℃,160 r/min下活化24 h。
合成废水培养基:葡萄糖0.25 g/L,NH4Cl 0.038 2 g/L,NaNO20.024 6 g/L,NaNO30.030 4 g/L,NaH2PO4·2H2O 0.010 1 g/L,MgSO4·7H2O 0.25 g/L。每1 000 mL上述溶液加入微量元素溶液1 mL,微量元素溶液为:FeCl3·6H2O 3.15 g/L,Na2EDTA 4.36 g/L,MnCl2·4H2O 0.18 g/L,ZnSO4·7H2O 0.022 g/L,CoCl2·6H2O 0.01 g/L,CuSO4·5H2O 0.009 8 g/L,Na2MoO4·2H2O 0.006 3 g/L。所有溶液采用过滤海水(盐度为30,pH为8.1,总氮浓度低于0.01 mg/L)配制,初始pH调整为7.5,灭菌后使用。
1.2 菌株SD148BN14的鉴定和生物安全性评价
使用通用引物27F/1492R进行聚合酶链式反应(PCR)扩增菌株SD148BN14的16S rRNA基因序列,扩增产物由生工生物技术有限公司(上海,中国)进行电泳和测序分析。获得的核苷酸序列通过BLAST在线比对(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)。使用MAGE 7.0软件采用邻接法构建系统发育树。菌株SD148BN14的形态、生理生化特性、溶血活性以及抗生素敏感性均按照现有的方法进行鉴定[18]。
1.3 藻-菌复合体系氮磷去除能力分析
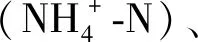
1.4 单一环境因素对藻-菌复合体系氮去除能力的影响
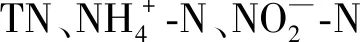
1.5 藻-菌复合体系去除实际海水养殖水和海水养殖废水中氮磷的能力分析
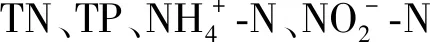
1.6 测定方法
生长指标按照如下方法测定。细菌生长:菌悬液的细菌密度由细菌浊度计(TA-2XJ,北京,中国)测定;活细菌数目用平板菌落计数法测定。微藻生长:微藻细胞密度在光学显微镜下用血球计数板计数测定。微藻光合活性:叶绿素a根据Wang等的研究[16]采用90%甲醇提取,并采用分光光度法定量,公式为:Chlorophylla(mg/L)=16.82×A665- 9.28×A652,式中A652、A665分别为叶绿素提取液在波长652 nm、665 nm下的吸光度;藻细胞最大光化学效率(Fv/Fm)由调制叶绿素荧光仪(Junior-PAM,Heinz Walz GmbH,Effeltrich,Germany)测定,并沿用现有的方法对待测样品进行预处理[19]。
生物量指标按照如下方法测定。生物量用细胞干质量表示,样品经孔径为0.22 μm的干燥过滤器过滤,在105 ℃下干燥至恒重,细胞干质量为含有样品的过滤器在干燥后的重量与过滤前的重量之差[8];蛋白质、碳水化合物和脂肪的提取方法参考Li等[11],采用Bradford法测定提取物的蛋白质含量(以牛血清白蛋白为标样),采用苯酚-浓硫酸比色法测定碳水化合物含量(以葡萄糖为标样),采用甲醇-氯仿法测定脂质含量。
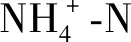
1.7 数据处理及统计分析
本实验以非接种组作为对照组,每个实验进行3个重复,实验结果以平均值±标准差(Mean ± SD)表示。采用SPSS 24.0软件进行单因素方差分析和Duncan检验,比较组间差异,p<0.05表示差异具有统计学意义。
2 结果
2.1 菌株SD148BN14的鉴定和生物安全性评价
菌株SD148BN14的16S rRNA基因序列比对结果表明,菌株SD148BN14与芽孢杆菌属的Bacillusniabensisstrain X16(Genbank登录号:JQ946065.1)相似性最高,为97.16%。系统发育树显示了菌株SD148BN14与其他系统发育相关菌株的同源性(见图1)。由此,菌株SD148BN14初步鉴定为芽孢杆菌属,命名为Bacillussp.SD148BN14。菌株SD148BN14在LB琼脂平板上形成的菌落呈圆形、淡黄色、半透明、表面光滑、边缘清晰。对菌株SD148BN14进行生理生化鉴定,鉴定结果显示,其革兰氏染色、明胶液化、过氧化氢酶、脲酶、淀粉酶、硝酸还原酶试验表现阳性,V-P、甲基红、吲哚、产氨试验表现阴性,葡萄糖氧化发酵试验表现为发酵型。
在血平板上培养菌株SD148BN14过程中,未观察到溶血圈,说明该菌株不具有溶血活性(见图2)。菌株SD148BN14的抗生素敏感性如表1所示,链霉素、杆菌肽和磺胺异噁唑的抑菌圈直径为0 mm,说明该菌株对上述抗生素具有耐药性。菌株对氨苄青霉素、诺氟沙星、四环素的敏感性较低,抑菌圈直径小于15 mm。除此之外,该菌株对其他抗生素具有较高的敏感性。
2.2 藻-菌复合体系的氮磷去除表现


表1 菌株SD148BN14对不同抗生素的敏感性Table 1 Antibiotic susceptibility of Bacillus sp.SD148BN14 to different antibiotics

续表1
2.2.2 溶解氧和pH 藻-菌复合体系和芽孢杆菌纯培养系统中,DO浓度在2 d内迅速下降(见图3e)。随着小球藻的光合作用,藻-菌复合体系的DO浓度从2.35 mg/L增加到5.92 mg/L,藻-菌复合体系的DO浓度始终介于菌纯培养和藻纯培养之间。芽孢杆菌纯培养的DO浓度最终加到3.95 mg/L。小球藻纯培养的DO浓度始终高于初始值,实验后期,DO浓度超过8 mg/L。在培养过程中,3种培养系统的pH较初始值均有所增加(见图3f)。芽孢杆菌纯培养的pH变化范围较小,从7.5增加至8.12。小球藻纯培养的pH继续上升,达到9.51。藻-菌复合体系的pH介于芽孢杆菌纯培养和小球藻纯培养之间,最终增加至8.64,细菌的添加改变了小球藻纯培养中普遍存在水体pH过高的现象。
2.3 藻-菌复合体系的生长和生物量生产表现
2.3.1 微藻、细菌细胞生长性能 藻细胞叶绿素a含量和Fv/Fm如图4(a)和4(b)所示,培养8 d后,藻-菌复合体系中叶绿素a浓度达到3.31 mg/L,是小球藻纯培养的1.27倍。培养10 d后,藻-菌复合体系中小球藻的Fv/Fm由0.66上升至0.72,随后下降至0.68。小球藻纯培养过程中,Fv/Fm从0.66增长至0.70。芽孢杆菌纯培养过程中活菌数量迅速增加,在2 d时达到峰值9.35×108CFU/mL,随后迅速降至5×107CFU/mL(见图4(c))。藻-菌复合体系中活细菌数目较芽孢杆菌纯培养增加缓慢,4 d时出现最大活菌数(6.05×108CFU/mL),此后藻-菌复合体系中活菌数高于芽孢杆菌纯培养。上述结果表明,藻-菌共培养有利于在培养前期促进小球藻细胞的生长和光合活性,并在培养后期维持高于芽孢杆菌纯培养的活菌数。
2.3.2 生物量产量和营养成分分析 各培养系统生产的生物量以细胞干质量表示,培养8 d时,藻-菌复合体系细胞干质量达到0.41 g/L,高于小球藻纯培养(0.26 g/L)和芽孢杆菌纯培养(0.08 g/L)的总和,培养结束时藻-菌复合体系干质量达到0.44 g/L(见图3a)。在小球藻纯培养系统中细胞干质量继续增加,最终达到0.35 g/L。在芽孢杆菌纯培养系统中细胞干质量在2 d达到峰值0.10 g/L后逐渐下降。在合成废水中培养14 d后,各培养系统生产的生物量中主要营养成分的含量如图5所示。藻-菌复合体系中蛋白质、碳水化合物、脂质产量分别达到123.19、73.45、138.94 mg/L,分别占细胞干质量的28.25%、16.84%、31.87%,其中蛋白质和脂质的占比显著高于小球藻纯培养(p<0.05),碳水化合物占比在不同处理组之间无显著差异(p>0.05)。
2.4 单一环境因素对藻-菌复合体系脱氮能力的影响

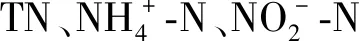


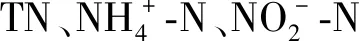

综上,在温度为20~35 ℃、盐度为10~40、光照强度为4 000~16 000 lx、pH为6~9、C/N为1~10、N/P为4~10、氮浓度为1~20 mg/L的条件下,藻-菌复合体系呈现出良好的氮去除能力。
2.5 藻-菌复合体系对实际海水养殖水和海水养殖废水中氮磷的去除性能
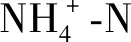
3 讨论
3.1 藻-菌复合体系的构建和氮磷去除性能
本研究构建了一种海水小球藻(MACC/C95)-芽孢杆菌(SD148BN14)复合体系,在有氧条件下,该复合体系能够有效地同步去除水体中的氮和磷,并累积生物量。芽孢杆菌SD148BN14分离自海水养殖池塘,对于水体中的无机氮具有去除能力。细菌产生的溶血素能够造成膜损伤、细胞溶解和细胞凋亡,是细菌致病性的代表特征之一[6]。菌株SD148BN14在血平板上无溶血反应,表明其不产生溶血素,致病风险较低。当前我国水产养殖应用的抗生素至少包括8类20种,其中喹诺酮类、磺胺类、大环内酯类、四环素类药物在养殖环境中含量最丰富[20]。本研究中,菌株SD148BN14对磺胺异噁唑(磺胺类)表现出耐药性,对其余3类药物均表现出不同程度的敏感性。此外,研究证明芽孢杆菌向水生生物(尤其是条件致病菌)转移和扩散抗生素抗性基因的风险较小[21],对人类和养殖动物相对安全。上述研究初步验证了菌株SD148BN14的生物安全性,有助于其在海水养殖环境中的应用。
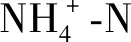
水体DO浓度和pH对养殖动物的健康至关重要,同时也影响着氮、磷等离子的存在形式。本研究中,经藻-菌复合体系处理,合成废水的DO浓度维持在5.90 mg/L左右,介于芽孢杆菌纯培养和小球藻纯培养,这意味着藻-菌共培养过程中小球藻通过光合作用释放的氧气可能持续被芽孢杆菌用于细胞代谢,改善了采用芽孢杆菌纯培养处理废水过程中的低溶解氧水平。据报道,海水养殖系统的pH在7~9之间,由于CO2大量被消耗,小球藻纯培养后期pH高达9.51,而藻-菌复合体系中水体pH增加缓慢并最终维持在8.6左右,研究普遍认为这得益于细菌代谢释放CO2溶于水体[11,23]。

3.2 氮磷去除过程中藻-菌的相互关系
藻-菌复合体系中小球藻和菌株SD148BN14的相互关系与复合体系的氮、磷去除效率密切相关。在10 d内,藻-菌复合体系内小球藻的叶绿素a含量和Fv/Fm高于小球藻纯培养,表明与菌株SD148BN14共培养可有效提高小球藻的光合活性,对藻细胞代谢和生长起到协同作用。另外,复合体系中更高的Fv/Fm也表明藻细胞受到更低的环境胁迫[24]。4 d内复合体系中活菌数增长速率和峰值均低于芽孢杆菌纯培养,4~8 d复合体系内活菌数维持在相对稳定且高于芽孢杆菌纯培养的水平。根据现有的研究,藻-菌共培养初期小球藻可能通过营养竞争抑制菌株SD148BN14生长,经过短暂适应,这种竞争关系将转变为协同关系[11]。实验后期,合成废水中营养耗尽,复合体系中活菌数仍明显高于芽孢杆菌纯培养,这可能由于小球藻新陈代谢释放营养物质(如溶解性有机碳),使更多的细菌得以生存[25-26]。上述现象意味着共培养的菌株SD148BN14和小球藻并非独立生存,而是存在某些相互作用。相关研究表明,CO2/O2依赖关系是微藻-细菌在废水处理过程中的基本相互作用之一[16]。本研究中,藻-菌复合体系和芽孢杆菌纯培养、小球藻纯培养系统DO浓度的差异暗示了小球藻光合作用释放的O2提供给菌株SD148BN14进行细胞代谢。相应地,菌株SD148BN14将通过呼吸释放CO2,为小球藻提供无机碳并促进其光合活性。综上所述,小球藻与菌株SD148BN14在细胞生长、光合活性和物质交换方面以协同为主的相互作用,为藻-菌复合体系的生长和高效氮、磷去除提供支持。
3.3 藻-菌复合体系的生物量生产性能
藻-菌复合体系通过回收废水中氮、磷营养元素,积累生物量,实现了废水的资源化处理。经过8 d培养,藻-菌复合体系细胞干质量达到0.41 g/L,超过芽孢杆菌纯培养(0.08 g/L)和小球藻纯培养(0.23 g/L)的总和,其中小球藻是复合体系中主要的生物量提供者,菌株SD148BN14通过促进小球藻光合作用和生长提高其生物量可能是藻-菌复合体系收获细胞干质量远高于小球藻纯培养的主要原因。小球藻纯培养系统中,小球藻蛋白质、碳水化合物和脂质含量符合文献[27-29]报道的小球藻营养成分含量。与小球藻纯培养相比,藻-菌复合体系中蛋白质与脂质占比均有提高,碳水化合物比例得到维持。值得注意的是,复合体系中脂质含量(占细胞干质量的31.87%)在当前报道的小球藻以及其他用于废水处理的微藻的脂质含量中仍处于较高水平[11,27-29]。研究报道,微量元素缺乏条件下,绿藻更容易累积脂质[28]。此外,一些小球藻属的微藻在氮饥饿的条件下培养,其生物量中脂质占比较氮充足时有显著提升[29]。这为小球藻和菌株SD148BN14共培养时脂质的有效积累提供了一种可能的解释。近年来,藻-菌技术在养殖水质调节以及养殖废水处理方面极具前景,从中收获的藻-菌絮凝体可用作水产动物饲料或用于生产其它增值产品,成本效益突出[30]。本研究为应用藻-菌技术进行可持续的海水养殖提供了具有竞争力的生物材料。
3.4 藻-菌复合体系的环境适应性评价
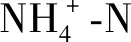
3.5 藻-菌复合体系应用于实际海水养殖水和海水养殖废水处理
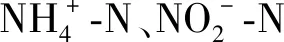
4 结语
本研究将小球藻(MACC/C95)与芽孢杆菌(SD148BN14)结合,构建了一种能够有效去除水体中氮、磷并生产生物量的藻-菌复合体系。该藻-菌复合体系对环境变化具有良好的适应能力,能够高效去除海水养殖水和海水养殖废水中氮、磷。培养过程中,小球藻与菌株SD148BN14在氮、磷去除和细胞生长方面的相互作用主要表现为协同促进。此外,实验证明菌株SD148BN14用于海水养殖环境具有较高的生物安全性。本研究为海水养殖环境修复和养殖废水的稳定、高效、资源化处理提供了可靠的微藻-细菌复合体系,丰富了水产养殖环境脱氮除磷的工艺研究。

