组胺通过Hippo-YAP信号通路影响鼻咽癌细胞增殖与侵袭的机制研究①
冼德生 曾银萍 周小柳 李智群 王丽萍 羊俊维
(海南医学院第一附属医院耳鼻咽喉头颈外科,海口 570102)
鼻咽癌是常见的头颈部恶性肿瘤之一[1]。目前主要以放化疗来帮助患者缓解临床不适,但肿瘤的远处转移及局部复发严重影响患者的预后,因此深入揭示疾病的分子发展机制,寻找有效的抗肿瘤药物对改善鼻咽癌患者的生命质量具有重大意义[2-3]。组胺是一种由肥大细胞、血小板及T淋巴细胞等多种细胞分泌的具有多种生物活性的物质。研究显示,组胺参与细胞增殖、学习记忆、胃肠循环、炎症应激、变态反应及免疫调节等多种生理病理过程[4]。NICOUD等[5]研究报道,外源性补充组胺可明显降低乳腺癌细胞的线粒体膜电位,诱导肿瘤细胞凋亡。但有关组胺在鼻咽癌中的应用报道较少。果蝇中的蛋白激酶Hippo-Yes协同蛋白(YAP)信号通路是细胞内高度保守的转导通路,该通路主要通过大肿瘤抑制基因1(large tumor suppressor gene 1,LATS1)的甲基化及YAP的磷酸化发挥生物学效用。研究显示,该通路参与调控肺癌、结肠癌、肝癌及食管癌等多种恶性肿瘤细胞的分化、增殖、侵袭与恶性转移、化疗耐药等生物学过程[6]。孙海力等[7]通过对GEO数据库中鼻咽癌组织数据进行GO和KEGG分析发现,Hippo-YAP信号在鼻咽癌组织中表达异常,参与鼻咽癌的病情进展。本研究通过对人鼻咽癌细胞株CNE1的研究,从Hippo-YAP信号入手,观察外源性组胺对肿瘤细胞的作用机制,以期为临床鼻咽癌的治疗提供新的数据支撑。
1 材料与方法
1.1 材料
1.1.1 实验细胞人鼻咽癌细胞株CNE1购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。
1.1.2 实验动物40只SPF级雄性SD大鼠裸鼠,6~8周龄,体质量130~180 g,购自中国医学科学院实验动物研究所,动物使用许可证号:SYXK(京)2020-0006。
1.1.3 主要试剂组胺(>97%,5 g/瓶,美国Sigma公司);鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(美国Jackson公司);CCK-8试剂盒、Western blot试剂盒(美国Invitrogen公司);Transwell小室(美国Sigma-Aldrich公司)。
1.1.4 主要仪器苏净Airtech超净工作台Multiskan Sky全波长酶标仪(美国Thermo Fisher公司);BD-56集成式恒温恒湿细胞培养箱(德国BINDER公司);IXplore Standard倒置显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞复苏及分组处理将人鼻咽癌细胞株CNE1复苏后,接种于含10%胎牛血清的DMEM培养基,置于恒温恒湿生化培养箱中培养,设定条件:37℃、5%CO2,取对数生长期的组胺进行后续实验,本研究细胞实验分为4组:正常组、组胺低、中、高剂量组;其中,正常组不添加任何药物常规培养;组胺低、中、高剂量组依次添加100、200、400μmol/L的组胺[8]。
1.2.2 二脒基-2-苯基吲哚(DAPI)染色观察各组细胞形态调整细胞浓度,以2×105个/孔接种于12孔培养板,分组处理同1.2.1,轻轻混匀后,置于恒温恒湿生化培养箱中37℃、5%CO2条件下培养24 h,多聚甲醛固定,室温下添加DAPI(15μg/ml)500μl,避光染色,干燥后上镜观察。
1.2.3 CCK-8法检测各组CNE1细胞增殖以1×105个/孔将CNE1细胞接种于96孔板,细胞分组同1.2.1,每组设8个复孔,置于恒温恒湿生化培养箱中37℃、5%CO2条件下培养24 h,每孔加入20μl CCK-8溶液,室温下孵育5 h,Multiskan Sky全波长酶标仪检测A450。细胞增殖率(%)=(A实验孔-A空白组孔)/A实验孔×100%[9]。
1.2.4 Transwell小室检测各组细胞侵袭在Transwell小室上室加入200μl预先稀释的不含血清的Matrigel胶,无菌干燥箱中过夜。调整各组细胞浓度至2×105个/孔接种于上室,下室中加入700μl含血清的常规培养基,每组设8个孔,置于恒温恒湿生化培养箱中37℃、5%CO2条件下继续培养24 h,PBS轻柔洗涤1次,4%多聚甲醛固定10 min,结晶紫染色10 min,显微镜下拍照、计数,采用图像处理软件Image-Pro Plus6.0进行统计分析。
1.2.5 四氯四乙基苯并咪唑羰花青(JC-1)染色检测各组细胞的线粒体膜电位调整细胞浓度,以1×106个/孔接种于6孔板,分组处理同1.2.1,每组设8个复孔,置于恒温恒湿生化培养箱中37℃、5%CO2条件下继续培养24 h,PBS冲洗3次,分别收集各组细胞,制成单细胞悬液,300μl JC-1进行染色,室温避光孵育30 min,观察各组细胞中红色(JC-1单体)和绿色荧光(JC-1复合物)变化,以红色荧光和绿色荧光的比值评价各组细胞线粒体膜电位变化[10]。
1.2.6 建立皮下移植瘤裸鼠模型调整细胞浓度,以1×105个/孔接种于96孔培养板,分组处理同1.2.1,轻轻混匀后,置于恒温恒湿生化培养箱中37℃、5%CO2条件下继续培养24 h,待生长密度达到1×106个/ml时消化细胞,分别制成单细胞悬液待用。按随机数字法将裸鼠分为正常组、组胺低、中、高剂量组,将上述各组细胞悬液接种于裸鼠左前腋皮下,构建鼻咽癌皮下移植瘤裸鼠模型,标准饲料、自由饮水喂养裸鼠,在第5天后可观察到原位肿瘤[11],在接种14 d后处死裸鼠,剥离瘤组织,称量瘤组织质量。
1.2.7 特异性PCR检测各组细胞中LATS1甲基化水平胰酶消化细胞,离心稀释成细胞悬液,分组处理同上,以1×105个/孔接种至6孔板;置于恒温恒湿生化培养箱中37℃、5%CO2条件下培养24 h,提取各组细胞总DNA,进行经亚硫酸盐处理纯化,采用甲基化特异性PCR扩增,实验操作严格按照试剂盒说明书进行,扩增的产物经凝胶电泳分析目的基因的甲基化水平。甲基化引物序列如下[12]:正向引物5'-CACACTGAACCCCCTCATCT-3',反向引物5'-ATTTTGTTGCATCCCCTCAG-3';非甲基化引物序列如下:正向引物5'-ACCAGCAAGGGCAATCATAC-3',反向引物5'-CATGATCAGTAGCGGGAGGT-3';扩增条件:95℃预变性10 min,单次循环;94℃变性30 s;甲基化/非甲基化:53℃/57℃;72℃退火45 s,60℃延伸60 s,采集荧光信号40个循环。
1.2.8 Western blot检测各组细胞中YAP1、p-YAP1、LATS1的表达胰酶消化细胞,离心稀释成细胞悬液,分组处理同上,以1×105个/孔接种至6孔板;置于恒温恒湿生化培养箱中37℃、5%CO2条件下培养24 h,加入蛋白裂解液,常规提取总蛋白,测定浓度,置于沸水中变性,进行电泳分离,转膜,清洗后,在封闭液中孵育30 min,加入一抗(1∶500),孵育过夜,加入二抗(1∶1 000),二氨基联苯胺(diaminobenzidine,DAB)显色[13]。以GAPDH为内参,Image J图像分析软件统计分析各条带灰度值。
1.3 统计学分析数据统计采用SPSS19.0软件,作图工具采用Graphpad5.01,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2 结果
2.1 组胺对CNE1细胞形态的影响DAPI染色结果显示,对照组细胞染色后呈现出均匀浅蓝色光,核质界限清晰,核膜完整,核质均匀,低、中、高剂量组细胞的细胞核凋亡状态改变,且随着组胺浓度升高,组胺低、中、高剂量组细胞核膜破裂数量及染色质固缩程度明显加剧,见图1。

图1 DAPI染色结果(×200)Fig.1 Result of DAPI staining(×200)
2.2 组胺对CNE1细胞增殖的影响CCK-8结果显示,与正常组相比,组胺低、中、高剂量组细胞增殖率明显下降(分别为P=0.001、P=0.000、P=0.000),且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图2。
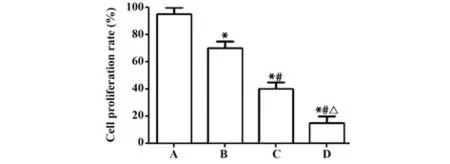
图2 细胞增殖实验结果Fig.2 Result of cell proliferation
2.3 组胺对CNE1细胞的侵袭的影响Transwell小室侵袭结果显示,与正常组相比,细胞低、中、高剂量组细胞穿过Matrigel胶的细胞数量明显减少(分别为P=0.000、P=0.000、P=0.000),且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图3。
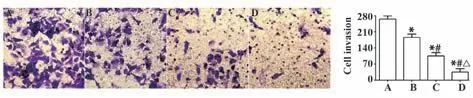
图3 细胞侵袭实验结果(×200)Fig.3 Result of cell invasion(×200)
2.4 组胺对CNE1细胞线粒体膜电位的影响JC-1染色结果显示,正常组细胞呈现出强烈的红色荧光,细胞低、中、高剂量组红色荧光逐渐减弱,绿色荧光逐渐增强;与正常组相比,细胞低、中、高剂量组细胞红色荧光与绿色荧光比值明显降低(分别为P=0.000、P=0.000、P=0.000),线粒体膜电位随之下降,且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图4。

图4 JC-1染色结果(×200)Fig.4 Result of JC-1 staining(×200)
2.5 组胺对裸鼠皮下移植瘤成瘤的影响皮下移植瘤结果显示,与正常组相比,组胺低、中、高剂量组细胞皮下成瘤组织质量明显降低(分别为P=0.002、P=0.001、P=0.000),且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图5。

图5 各组裸鼠皮下移植瘤质量比较Fig.5 Comparison of weight of subcutaneously transplanted tumor in each group of nude mice
2.6 组胺对CNE1细胞中LATS1甲基化的影响特异性PCR结果显示,与正常组相比,组胺低、中、高剂量组细胞中LATS1基因的甲基化比例明显降低(分别为P=0.001、P=0.001、P=0.001),且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图6。

图6 各组LATS1基因的甲基化水平Fig.6 Methylation level of LATS1 gene in each group of cell
2.7 组胺对CNE1细胞中YAP1、p-YAP1、LATS1表达的影响Western blot结果显示,与正常组相比,组胺低、中、高剂量组细胞中YAP1、p-YAP1表达明显减少(分别为P=0.000、P=0.000、P=0.000),且具有明显的剂量依赖性(分别为P=0.000、P=0.000、P=0.000),细胞中LATS1表达明显增多(分别为P=0.000、P=0.000、P=0.000),且具有明显剂量依赖性(分别为P=0.000、P=0.000、P=0.000),见图7。

图7 各组细胞中YAP1、p-YAP1、LATS1的表达Fig.7 Expressions of YAP1,p-YAP1 and LATS1 in each group of cell
3 讨论
常见于我国华南地区及东南亚的鼻咽癌是一种恶性程度较高的头颈部肿瘤。该病尚无根治性措施使患者免受疾病困扰,尽管现有的早期干预和辅助治疗手段有了较为明显的进步,但处于该病晚期的患者预后仍不令人满意,五年生存率较低[14]。肿瘤细胞的无限增殖及远处恶性转移是导致患者治疗失败、失去生命的主要原因。因此深入揭示疾病的分子机制,寻找或开发新的治疗药物,更加精准地指导临床上鼻咽癌的治疗,提高患者的生命质量,都具有重大意义。
由组胺酸脱羧酶(histidine decarboxylase,HDC)将组胺酸脱羧基而成的组胺是机体内免疫反应中重要的调控元件[15]。研究显示内源性组胺的功能影响造血过程、胚胎发育、伤口愈合、细胞增殖与分化、免疫调节及各种炎症性应激等生理机能[16]。但近来组胺与恶性肿瘤的关系引起众多研究者的重视。LEE等[17]研究报道内源性的组胺水平能够评估胃癌、肺癌、前列腺癌、神经胶质瘤等恶性实体肿瘤的病情进展;GRAUERS等[18]研究报道外源性组胺可靶向抑制乳腺癌细胞中的PD-1/PD-L1位点,抑制肿瘤细胞增殖,促使其凋亡,发挥良好的抗肿瘤效用。LIM等[19]研究表明外源性组胺不仅能够增强化疗药物如甲氨蝶呤、吉西他滨对肾细胞癌组织的渗透作用,还可减弱肿瘤细胞对肝脏、直肠等靶器官的转移。MASSARI等[20]报道外源性组胺能促使Treg/Th17趋于平衡,明显改善肝癌荷瘤小鼠的免疫功能,促进IL-10等抗肿瘤因子的释放。SHI等[21]研究证实在炎症性相关结肠癌动物模型中,补充外源性组胺能够促使肿瘤细胞线粒体膜电位下降,促使肿瘤细胞能量代谢失衡,抑制肿瘤组织生长。本研究结果显示,与正常组鼻咽癌细胞相比,组胺低、中、高剂量组细胞增殖明显减少,细胞侵袭能力明显减弱,线粒体膜电位明显降低,肿瘤体内生长能力明显受限,这些结果均提示组胺具有良好的抗肿瘤作用,但其是否能够改善鼻咽癌患者的免疫能力是下一步实验的研究重点。
深入了解药物的作用靶点有助于揭示疾病发生、发展的分子机制。Hippo-YAP信号是新近发现的与肿瘤的发生、发展关系密切的通路[22]。该通路进行信号转导的核心是激酶的级联磷酸化。DEY等[23]研究显示,在结肠癌、肾癌中,位于Hippo信号上游的LATS1基因发生甲基化可导致通路内一系列激酶发生级联磷酸化,最终导致下游YAP蛋白的磷酸化,促进肿瘤细胞异常增殖。TANG等[24]研究报道抑制Hippo通路中YAP蛋白的激活,能明显抑制胃癌细胞的线粒体功能,阻断肿瘤细胞发生上皮间质转化所需的能量代谢过程,降低肿瘤细胞的侵袭和迁移能力。CHEN等[25]研究证实诱导胰腺癌细胞的LATS1基因发生去甲基化能够阻止YAP信号入核,下调肿瘤生长与侵袭相关基因的转录和翻译水平,抑制肿瘤的生长、侵袭和转移。本研究结果显示,与正常组相比,组胺低、中、高剂量组细胞LATS1基因甲基化比例及YAP1、p-YAP1表达均明显下降,LATS1表达明显升高。说明组胺对鼻咽癌细胞的作用是通过调控Hippo-YAP信号实现的。
综合上述,组胺能抑制鼻咽癌CNE1细胞的体外增殖与侵袭能力,降低其线粒体膜电位,使肿瘤细胞体内生长明显受限,这可能是通过调控Hippo-YAP信号实现的。组胺如何通过改善鼻咽癌患者免疫功能发挥综合抗瘤功效将是下一步的研究重点。

