基于桔梅奇酵母冻干粉制备可湿性粉剂及其在柑橘上的应用
陈力维,张鸿雁,曾凯芳,
·农产品加工工程·
基于桔梅奇酵母冻干粉制备可湿性粉剂及其在柑橘上的应用
陈力维1,张鸿雁1,曾凯芳1,2,3※
(1. 西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715;3. 国家柑桔工程技术研究中心,重庆 400712)
确保生防制剂的贮藏稳定性是保证微生物种群数量和生物防治效果不受影响的关键因素。为开发货架期较长且防治效果稳定的拮抗酵母生物制剂,该研究通过助剂的单因素筛选试验和混料试验研制出一种基于桔梅奇酵母冻干粉制备得到可湿性粉剂,经过升温加速贮藏试验预测制剂的贮藏稳定性,同时评价了制剂在离体和活体条件下对柑橘采后主要病害的控制效果。试验结果表明:试验筛选得到制剂优化配方的质量分数分别为皂角粉5.69%、亚甲基二萘磺酸钠8.74%、母粉85.57%。冻干制剂中酵母活菌数可达到4.72×108CFU/g,贮藏稳定性试验表明,冻干制剂的贮藏稳定性较好,预测在4℃贮藏后制剂中酵母活菌数约为4.6×108CFU/g。适当降低贮藏温度可延长冻干制剂贮藏期。离体试验发现,与新鲜酵母相比,液体制剂对柑橘采后病原菌的抑制作用无显著变化,抑菌圈可达到9 mm以上。在柑橘果实上能够有效控制柑橘果实采后青霉病、绿霉病、酸腐病和炭疽病,可将发病率降低约40%~70%。综上,对桔梅奇酵母进行制剂化能够延长其货架期并维持其对柑橘果实采后病害防治效果。
农产品;采后病害;桔梅奇酵母;冻干制剂;采后;柑橘果实;生防作用
0 引 言
柑橘果实采后极易受到病原真菌的侵染而腐烂变质,造成大量采后损失[1]。采后病害主要包括由指状青霉()引起的绿霉病,意大利青霉()引起的青霉病,白地霉()引起的酸腐病等[2]。利用拮抗微生物对采后病害进行生物防治已成为一种前景广阔的可替代化学杀菌剂的有效手段。拮抗酵母作为环境友好型生物防治剂,对人体相对安全,已被证明对采后病害具有一定的生防效力。本课题组筛选分离出的新种酵母—桔梅奇酵母(),前期研究结果表明可通过营养与空间竞争、产生生物被膜、产生栗色色素竞争环境中的铁元素等方式抑制柑橘采后病害的发生。
在生物防治产品开发过程中最困难的阶段是商业化,该过程决定了产品的质量,如何长期保持生防制剂中微生物的活力和有效性是开发生物防治产品的一大挑战[3]。确保生防制剂的贮藏稳定性是保证微生物种群数量和生物防治效果不受影响的关键因素[4]。
固体制剂是指有效成分经过真空冷冻干燥、流化床干燥、喷雾干燥等方式进行干燥后制得的粉末状固体。在食品领域中,常采用真空冷冻干燥技术生产微生物固体制剂,包括发酵剂[5-6]、生防制剂[7]、益生菌剂[8]等。可湿性粉剂是目前微生物农药的主要剂型之一,主要成分包括微生物菌体、载体及其他助剂。Cheng等[9]对蜡样芽孢杆菌()可湿性粉剂进行筛选后得到最佳配方质量分数分别为冻干菌粉60%、硅藻土28.9%、木质素磺酸钠4%、烷基磺酸钠6%、K2HPO41%、-环状糊精1%。张致军等[10]筛选得到解淀粉芽孢杆菌()可湿性粉剂的最佳配方为轻质碳酸钙83%、十二烷基硫酸钠9%、聚乙烯醇8%。载体和助剂的加入除考虑对制剂理化性质的影响外,还需考虑载体和助剂与微生物菌体的生物相容性。刘盼西等[11]在对比了5种助剂后发现,十二烷基硫酸钠和木质素磺酸钠对海洋芽孢杆菌()的生物相容性最好,两者作为助剂加入制剂时可显著提高悬浮率,缩短润湿时间。田媛媛[12]将原药分别涂布于含有高岭土、硅藻土和膨润土的固体培养基上以测定载体与机器及营养型芽孢杆菌()的生物相容性发现,高岭土与的生物相容性最佳,芽孢存活率为78.25%。姚晓东[13]对比了白炭黑、蛭石粉、硅藻土等8种载体对抑菌活性的影响后发现,白炭黑和蛭石粉对的抑菌活性最小。目前的微生物农药主要针对细菌和霉菌等进行研究和开发,并应用于采前病害防治,但大部分采后生物防治都是由酵母作为主要有效成分[14],目前还没有将酵母作为有效成分开发为可湿性粉剂并应用于果蔬采后贮藏的相关研究报道。前期研究表明生防酵母液体剂型能够成功应用于柑橘采后病害防治,但仍存在贮藏时间较短、受环境因素影响较大等问题,而改变产品的应用方式是拮抗微生物发挥其生防作用的有效途径。
综上所述,本文旨在筛选得到桔梅奇酵母冻干制剂的最佳配方,探究冻干制剂的贮藏稳定性,并评价冻干制剂对柑橘果实采后主要病害的控制效果,从而为制备酵母生防制剂提供一定理论依据。
1 材料与方法
1.1 菌种与试剂
供试酵母菌:桔梅奇酵母()由本实验室筛选和保存的桔梅奇酵母FL01株系,并保藏于中国工业微生物菌种保藏管理中心,保藏号为CICC NO.33213。
病原菌:青霉菌、绿霉菌、白地霉为本实验室保藏菌种。上述病原菌分别在PDA培养基上、4℃条件下保藏,每两个月活化一次。
试验用果实为商业成熟期的锦橙果实447#[(L.) osbeck. cv. Jincheng 447#],采摘自从重庆市北碚区鸡公山果园(106.45°E,29.81°N)。采摘后的果实立即运输到实验室,从中挑选表面无机械伤,无病害,大小形状较为均匀的果实作为试验材料。
酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD)配方:酵母浸粉10 g,葡萄糖20 g,蛋白胨20 g,琼脂粉10 g,蒸馏水1 L。
马铃薯葡萄糖琼脂培养基(Potato Dextrose Medium,PDA)配方:马铃薯200 g,葡萄糖20 g,琼脂20 g,1 L蒸馏水,121℃灭菌15 min。
谷氨酸钠、脱脂奶粉(均为分析纯),购自国药集团化学试剂有限公司;海藻糖、乳糖、十二烷基硫酸钠、十二烷基苯磺酸钠(均为分析纯),购自成都市科龙化工试剂厂;抗坏血酸钠、硅藻土、羧甲基纤维素钠、多聚磷酸钠、聚乙二醇(均为分析纯),购自上海阿拉丁生化科技股份有限公司;白炭黑、高岭土(均为分析纯),购自西亚化学科技(山东)有限公司;皂角粉(工业级),购自新沂市飞皇化工有限公司;木质素磺酸钠、亚甲基二萘磺酸钠(均为分析纯),购自上海麦克林生化科技有限公司。
1.2 仪器与设备
BPC-500F生化培养箱,上海一恒科学仪器公司;SW-CJ-2F(D)超净工作台,苏净集团安泰有限公司; Avanti J-30I高速冷冻离心机,美国Beckman公司;BXM-30R立式高压灭菌锅,上海博迅医疗生物仪器股份有限公司;SPH-200F恒温震荡培养摇床,上海世平试验设备有限公司;BX43光学显微镜,日本OLYMPUS公司;VORTEX-5旋涡混匀仪,海门市其林贝尔仪器制造有限公司;Scan1200全自动菌落计数仪,法国INTERSCIENCE公司;LGJ-10真空冷冻干燥机,北京松原华兴科技有限公司。
1.3 方法
1.3.1 冻干保护剂筛选
参考Niu等[15]的方法,将保护剂悬浮液与酵母菌悬液(2×109CFU/mL)等体积混合后,在涡旋混合仪上震荡混匀1 min,室温下孵化1 h,在−20 ℃条件下预冷12 h,之后在冷阱温度为−50 ℃、真空度为1~10 Pa条件下冻干。3种冻干保护剂配方如下:
A:蔗糖6.06%、谷氨酸钠3.4%和脱脂奶粉5.43%[15];
B:脱脂奶粉10%、抗坏血酸1%和海藻糖10%[16];
C:脱脂奶粉28%、乳糖24%和抗坏血酸钠4.8%[17]。
冻干前,将稀释至适宜浓度的酵母悬浮液涂布在YPD平板上,测定初始活菌数0。冻干后,经无菌水溶解,稀释至适宜浓度,涂布在YPD平板上,将上述平板置于28 ℃条件下培养48 h后,计算冻干后的活菌数N。试验重复3次,通过以下公式计算存活率。
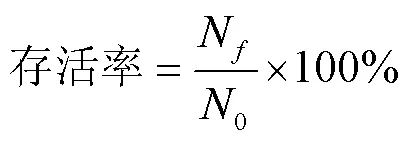
1.3.2 冻干母粉的制备
保护剂悬浮液与酵母菌悬液等体积混匀后得到酵母冻干母液,根据载体的吸附量,将母液与载体混合均匀得到样品,混合过程不断搅拌。在−20 ℃条件下预冷12 h后进行冻干。冻干后经研磨粉碎制得均匀的酵母冻干母粉。
1.3.3冻干制剂物理性状的测定
润湿时间参照农药可湿性粉剂润湿性测定方法GB 5451-2001[18];悬浮率参照农药悬浮率的测定方法GB/T 14825-2006[19]。载体的吸附容量参照江帆的方法[20]。试验以不加助剂的冻干粉为空白对照,下同。
1.3.4 载体筛选
选择白炭黑、高岭土和硅藻土作为备选载体,比较不同载体的吸附容量、润湿时间、悬浮率及对酵母活菌量的影响,每个样品重复3次。
1.3.5与助剂生物相容性的测定
各备选助剂按0.2%的加入量添加至YPD固体培养基中,将菌悬液稀释至适宜浓度后均匀涂布在YPD平板上,测定活菌数,不加助剂的YPD平板作为对照,试验重复3次。
1.3.6 助剂筛选
润湿剂包括十二烷基硫酸钠、十二烷基苯磺酸钠和皂角粉,分散剂包括羧甲基纤维素钠、木质素磺酸钠、亚甲基二萘磺酸钠、聚乙二醇PEG6000和多聚磷酸钠。按5%的添加比例分别将润湿剂和分散剂与冻干母粉充分混匀,测定制剂的润湿时间和悬浮率。
1.3.7 冻干制剂配方优化
将助剂分别按照质量分数5%、10%和15%的比例与原粉混合,测定润湿时间、悬浮率和活菌量。助剂单因素试验后,采用极端顶点设计法进行混料设计优化,设定酵母母粉、润湿剂和分散剂的质量分数和为1,其中制剂各成分的质量分数上限根据单因素试验结果确定。分别测定不同配方条件下制剂的润湿时间、悬浮率及活菌量等理化指标。通过Minitab 18软件对试验数据进行统计分析,得到酵母冻干制剂的最佳配方。其试验次数及对应比例如图1所示。
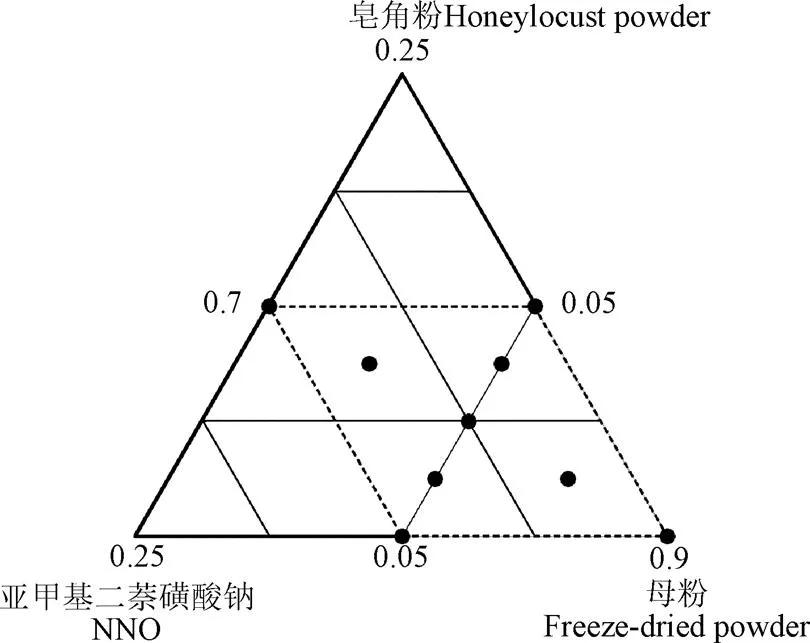
注:图中数字为各助剂含量占制剂总量的比例。
1.3.8 冻干制剂加速贮藏稳定性试验
参照Guo等[21]的方法,并稍作修改。分别将冻干制剂进行热塑密封包装后置于25、30、35、40 ℃恒温箱中,定期取样测定在不同温度下制剂活菌量。根据以下公式估算制剂在4 ℃条件下贮藏后的活菌量,试验重复3次。
一级反应动力学方程:
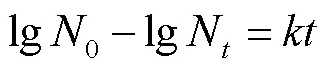
阿仑尼乌斯方程:

1.3.9 冻干制剂对柑橘果实采后主要病害的控制效果
参照Parafati等[22]的方法,略有修改。取10L 1×108cells/mL新鲜酵母菌悬液、1×108CFU/mL冻干制剂稀释液,均匀涂布在PDA平板的中轴线上,涂布范围为60 mm×2.6 mm,静置10 min后,在距中轴线30 mm处接种5L 5×105spores/mL,孢子悬浮液或生长5 d的的菌饼(直径为5 mm,取自菌落边缘处),以只接种病原菌的平板作为对照,25 ℃培养8 d后记录病原菌菌丝生长情况,以及色素圈大小。每个处理包含5个平板,重复3次。
参考Wang等[23]的方法,略有修改。用灭菌打孔器在果实赤道部位等距打两个孔(3 mm直径、3 mm深)。每个孔接种20L如下处理液:无菌水(Control);新鲜酵母(FY);固体制剂最优保护剂配方(P);冻干制剂稀释液(DY)。4 h后,再在每个孔接种10L、1×105spores/mL的或,或10L、1×106spores/mL的。待菌液吸收后,用聚乙烯薄膜袋(170 mm×140 mm)单果包装,贮藏在25 ℃、相对湿度85%~90%的环境下,每天统计发病率和病斑直径。每组10个果实,重复3次。
1.4 数据分析
以上指标均取3个平行样品,重复测定3次。运用EXCEL2019软件进行数据统计,数据分析采用SPSS(SPSS Inc., Chicago, IL, USA)软件,试验结果以平均值±标准差(X±SD)表示。方差分析采用ANOVA分析,利用Duncan’s多重比较进行显著性分析。图表绘制采用Origin 9.0(OriginLab, Northampton, MA, USA)软件。混料试验设计及其结果统计分析采用应用Minitab 18.1(Inc., Pennsylvania, USA)软件。
2 结果与分析
2.1 保护剂的单因素筛选试验
图2可知,添加保护剂的酵母冻干制剂与对照存活率(9.63%±0.60%)相比,其酵母存活率均有显著提高(<0.05),说明添加保护剂可有效降低冻干过程对菌体的损伤。其中保护剂A对酵母的保护效果最好,存活率可达82.05%±6.09%,其次分别是保护剂C(73.14%±4.10%)和保护剂B(59.08%±5.31%)。因此,选择保护剂A(蔗糖6.06%、谷氨酸钠3.4%和脱脂奶粉5.43%)作为酵母冻干保护剂进行后续试验。

注:A为脱脂奶粉5.43%、蔗糖6.06%和谷氨酸钠3.4%;B为脱脂奶粉10%、抗环血酸1%和海藻糖10%;C为脱脂奶粉28%、乳糖24%和抗坏血酸钠4.8%。不同小写字母代表不同处理间差异显著(P<0.05),下同。
2.2 载体对M. citriensis冻干制剂理化性质的影响
表1所示,载体的润湿性和分散性之间具有显著差异,白炭黑的润湿时间远高于高岭土和硅藻土。载体吸附容量大小决定了制剂中酵母初始活菌量的多少,载体的吸附容量由大到小分别为白炭黑、硅藻土、高岭土,其中白炭黑吸附容量是硅藻土吸附容量的约两倍左右。但比较冻干后制剂中酵母活菌量发现,白炭黑和硅藻土制剂中活菌量无显著差异。因此可选择硅藻土作为酵母制剂中的载体进行后续试验。
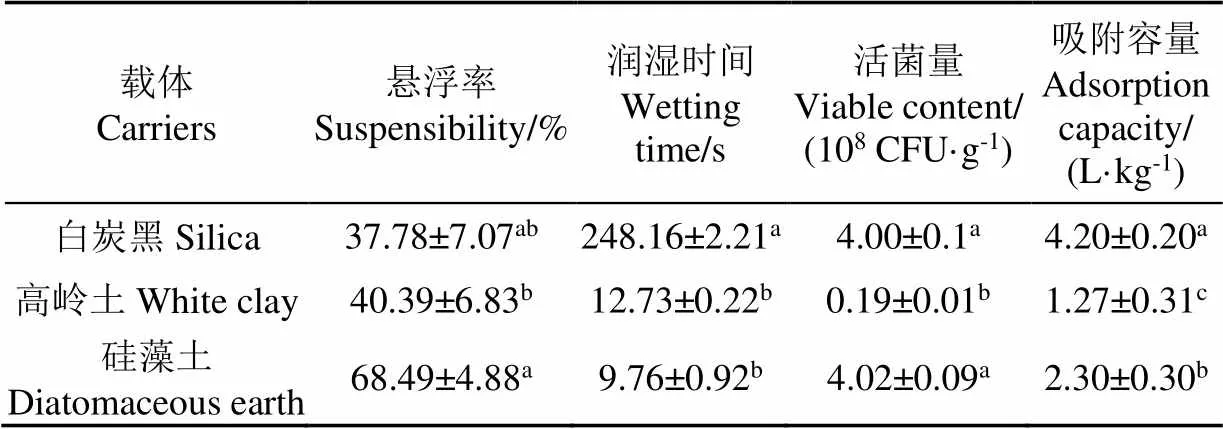
表1 载体种类对桔梅奇酵母冻干制剂理化性质的影响
注:表中同一列有相同字母表示试验结果差异不显著(>0.05)。下同。
Note: The same letter in the same column indicates that the difference of results is not significant (>0.05). The same below.
2.3 润湿剂对M.citriensis冻干制剂理化性质的影响
表2所示,润湿时间越短,制剂的润湿性越好。十二烷基苯磺酸钠的润湿时间最短,皂角粉与十二烷基硫酸钠无显著差异。活菌量最高的是皂角粉,其次是十二烷基苯磺酸钠、十二烷基硫酸钠,且皂角粉加入后高于其余两者一个数量级。悬浮率最高的是十二烷基苯磺酸钠,其次是十二烷基硫酸钠,皂角粉的悬浮率最低。因此可选择皂角粉作为润湿剂进行后续试验。
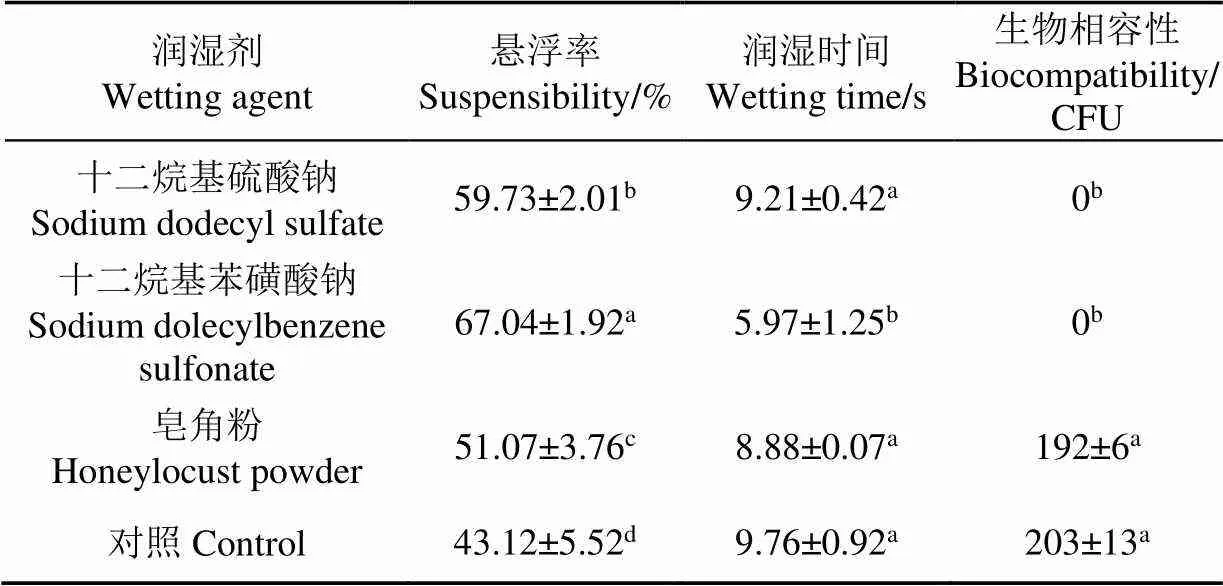
表2 润湿剂对桔梅奇酵母冻干制剂理化性质的影响
2.4 分散剂对M.citriensis冻干制剂理化性质的影响
悬浮率越高,制剂的悬浮性和分散性越好。表3所示,与母粉相比,分散剂加入后均可以不同程度提高菌粉的悬浮率。在备选的分散剂中悬浮性和分散性最好的依次是亚甲基二萘磺酸钠、聚乙二醇、木质素磺酸钠、羧甲基纤维素钠、多聚磷酸钠。因此可选择亚甲基二萘磺酸钠作为分散剂进行后续试验。
2.5 助剂添加量对M.citriensis固体制剂理化性质的影响
如表4所示为皂角粉和亚甲基二萘磺酸钠添加浓度的单因素试验筛选结果,随着皂角粉添加量的增加,制剂悬浮率呈逐渐增加的趋势,同时皂角粉浓度过高,可能会影响制剂中活菌量。亚甲基二萘磺酸钠的加入,可以显著改善制剂的悬浮效果,同时也能够降低制剂的润湿时间,改善润湿性。较高浓度的亚甲基二萘磺酸钠加入后,不仅会降低母粉添加比例,造成制剂中酵母活菌量较低(2.12×108CFU/g),因此选择适宜浓度的助剂添加量仍需进一步确定。
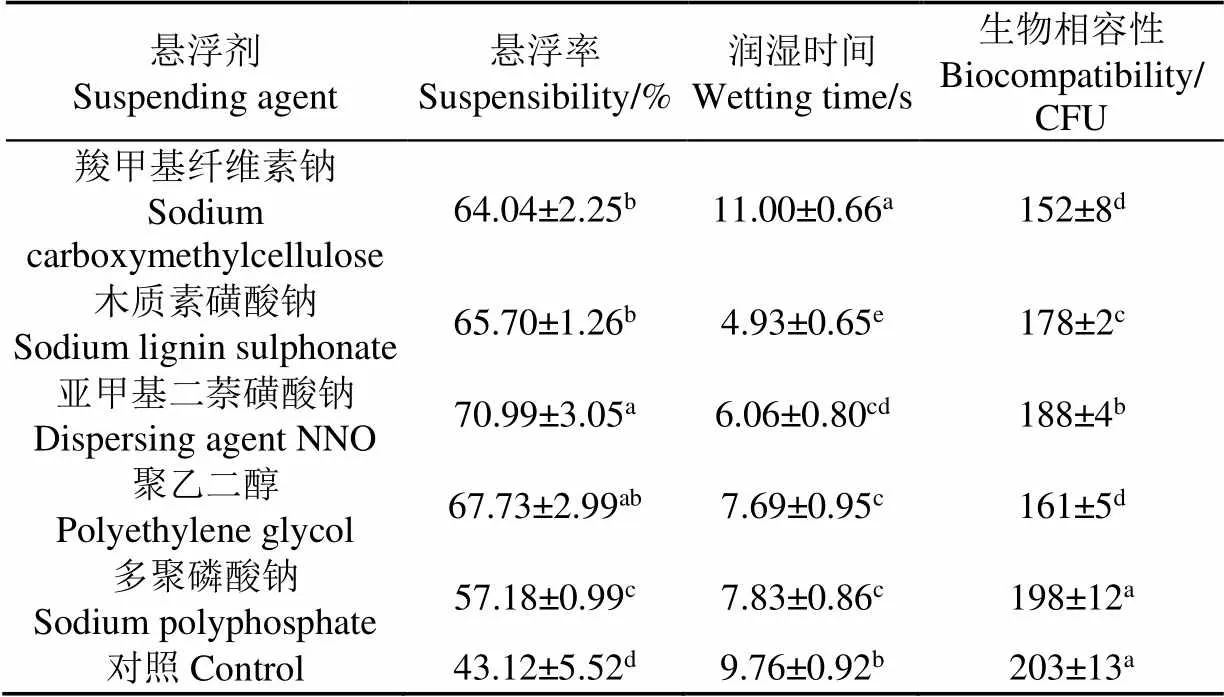
表3 分散剂对桔梅奇酵母冻干制剂理化性质的影响
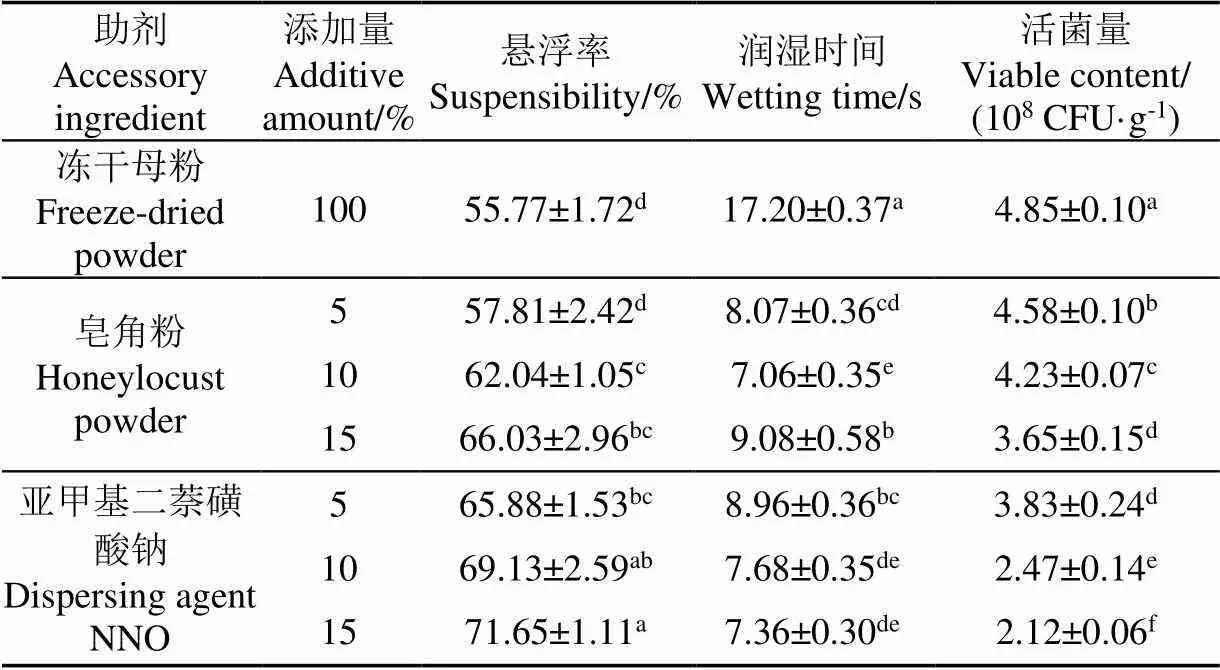
表4 润湿剂和分散剂的添加量对桔梅奇酵母冻干制剂理化性质的影响
2.6 混料设计优化M. citriensis固体制剂配方
混料设计具体方案及理化性质测定结果见表5所示。
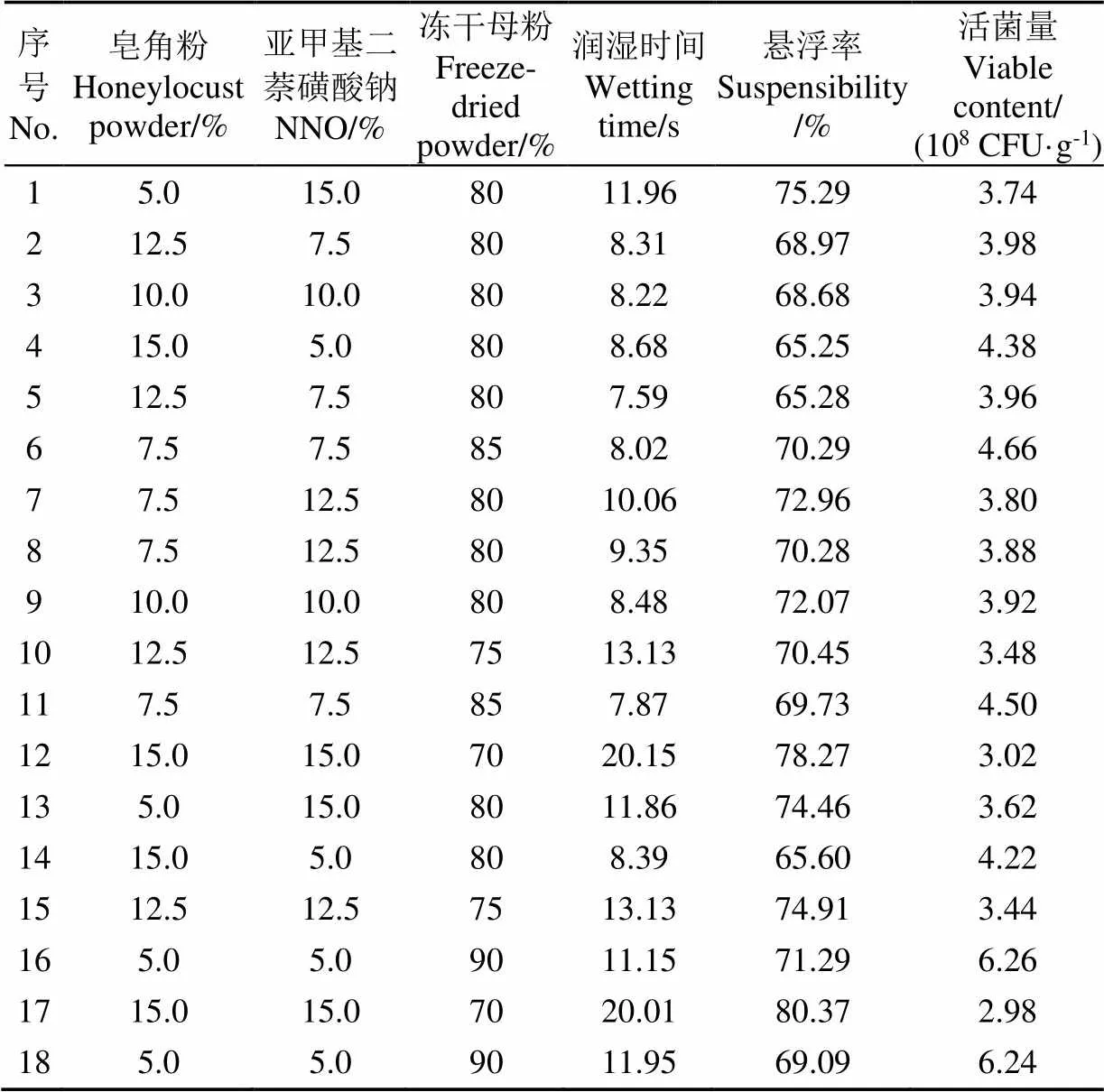
表5 极端顶点试验设计方案及响应值
模型回归方程的建立如表6所示,3个模型回归均表示显著(<0.05),且失拟项不显著(>0.05)。设定制剂的润湿时间、悬浮率和活菌量的期望值范围分别为7~10 s、70%~75%和4.5×108~5×108CFU/g进行多指标优化,得到如图3所示区域,在图中白色域内选择最佳配方为皂角粉为5.69%、亚甲基二萘磺酸钠为8.74%、母粉为85.57%。基于此配方,混料后所得制剂的实测值与各项指标的预测值比较接近(如表7所示),表明在该优化区域中所得的制剂配方是可行的,可以将其作为可湿性粉剂的配方。

表6 各指标的预测模型
注:1、2、3分别代表配方中皂角粉、亚甲基二萘磺酸钠和母粉在制剂中的质量分数。
Note:1,2,3represent the mass fraction of honeylocust powder, NNO and Freeze-dried powder in the formulation, respectively.
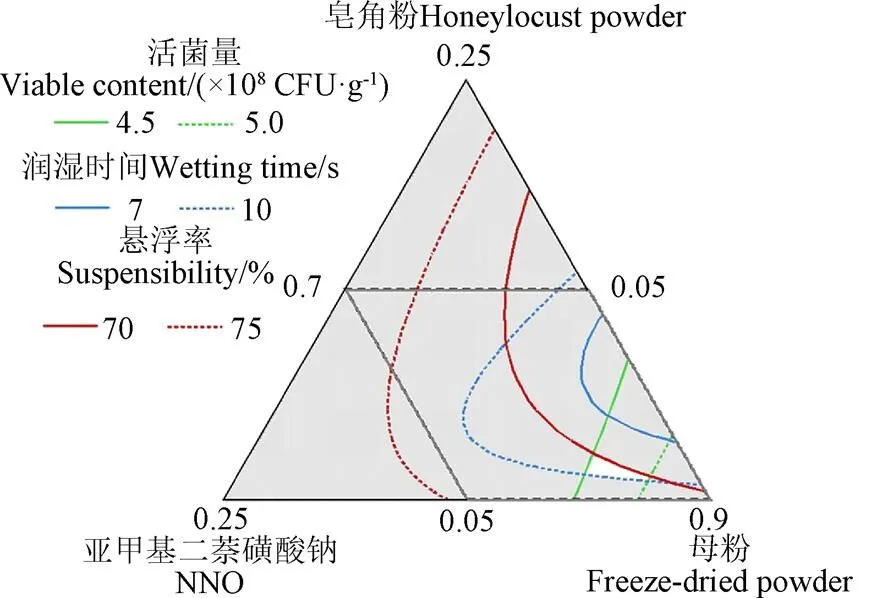
图3 桔梅奇酵母冻干制剂多指标配方优化区域
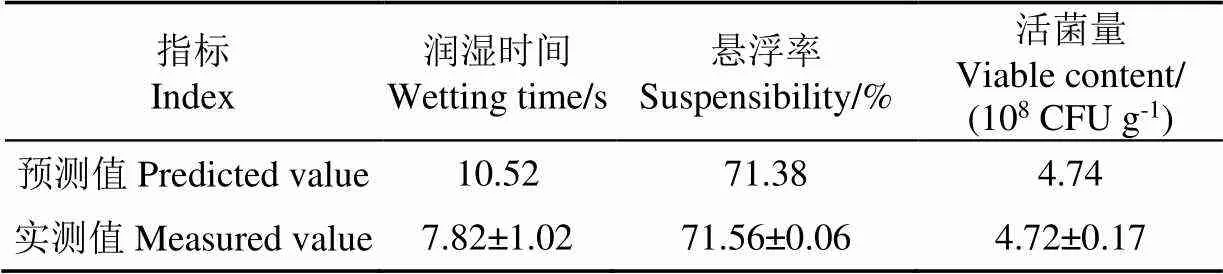
表7 优化制剂配方的试验验证
2.7 M. citriensis冻干制剂的贮藏稳定性
冻干制剂在不同温度下的失活速率方程如表8所示,随着贮藏时间的增加,lg(N/0)不断下降,说明酵母的存活率在贮藏期间不断下降。通过各拟合方程的斜率可以确定在不同温度下酵母的失活速率,即25为0.014 4(2=0.995 7),30为0.056 3(2=0.995 8),35为0.191 2(2=0.992 2),40为0.332 5(R=0.995 9),温度的升高失活速率越快。
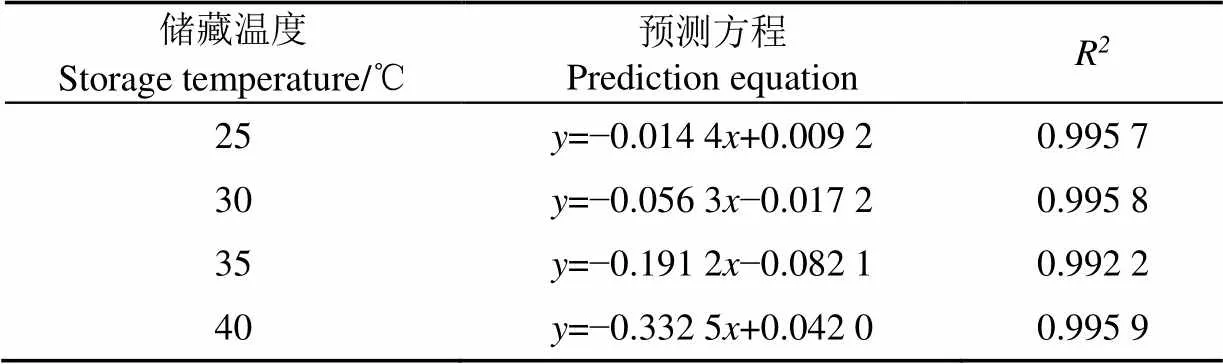
表8 不同温度下的失活速率方程
注:表示贮藏时间,d;表示贮藏后活菌数与初始活菌数比值的对数值。
Note:represent the storage time, d;represent logarithmic value of the ratio of storage viable count to initial viable count.
阿伦尼乌斯方程的拟合结果如图4所示,由拟合方程=−8 623.4+27.150(2=0.960 5)可通过计算得到,在4 ℃贮藏条件下,冻干制剂的失活速率常数为1.044×10-4d-1,该温度下贮藏1年后制剂中酵母活菌数约为4.6×108CFU/g。由此说明,在低温下保存冻干制剂更有利于酵母存活,能够延长制剂的货架期。
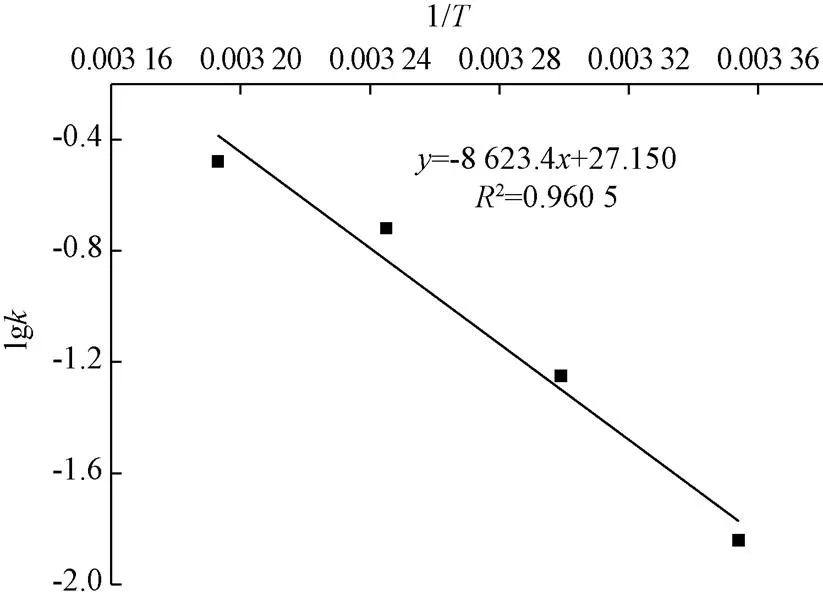
注:T为热力学温度,K;k为失活速率常数,d-1。
2.8 M. citriensis冻干制剂对柑橘果实采后主要病原菌体外抑菌试验
如图5a所示,冻干制剂与新鲜酵母对病原菌的菌丝生长均存在不同程度的抑制效果,能够产生较明显的抑菌圈,且抑菌圈大小大于9 mm,三种病原菌的菌丝均不能越过酵母细胞生长,其中,酵母对产生的抑菌圈最大,其次分别是和。新鲜酵母与冻干制剂相比,对三种病原菌产生的抑菌圈大小均无显著性差异,说明在冻干制剂中酵母仍能够保持较高的活性。当酵母分别与三种病原菌共培养时,酵母均可产生红色色素带,即酵母仍可产生普切明酸与培养基中的铁离子进行结合产生红色色素,其宽度如图5b所示,其中,新鲜酵母与病原菌共培养时,与同时存在的色素圈最大,为18.33mm,其次分别是(17.25 mm)和(15.93 mm),其中,与共培养时冻干制剂产生的色素圈显著低于新鲜酵母(<0.05)。由此说明酵母经冻干、复配等过程后活力大多无显著改变,均可保持对病原菌的生防效力。
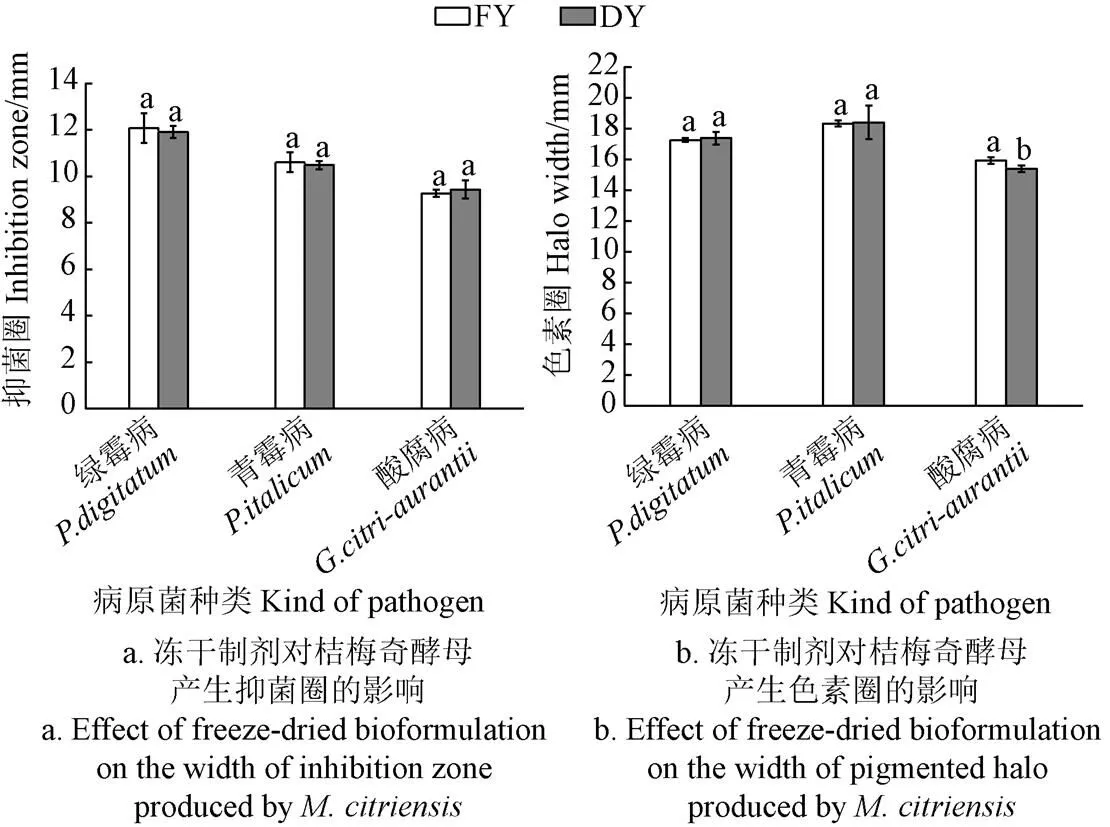
注:图中相同字母表示试验结果差异不显著(P>0.05)。FY为新鲜酵母;DY为冻干制剂,下同。
2.9 M.citriensis冻干制剂对柑橘果实采后主要病害的控病效果
如图6所示,在贮藏过程中,新鲜酵母对柑橘果实采后绿霉病、青霉病和酸腐病均有显著控制效果,可有效降低果实发病率(如图6a、6c和6e)和病斑直径(如图6b、6d和6f),与接种无菌水相比,均有显著性差异(<0.05)。接种酵母冻干制剂的处理组与新鲜酵母的处理组相比,三种病害的发病率和病斑直径在贮藏初期均无显著性差异,随着贮藏时间的延长,酵母冻干制剂处理后柑橘果实绿霉病和青霉病的显著高于新鲜酵母处理组(<0.05)(如图6a和6c),而酸腐病的发病率显著低于新鲜酵母处理组(<0.05)(如图6e)。由此说明,新鲜酵母和酵母冻干制剂对柑橘果实采后主要病害均有显著控制效果,与对照组相比,在贮藏6 d后,可有效降低果实绿霉病和青霉病发病率40%左右,降低果实酸腐病发病率70%左右。与新鲜酵母相比,酵母冻干制剂可提高对酸腐病的控制。

注:Control为无菌水;P为助剂及保护剂配方。
3 讨 论
获得最大的存活率对工业生产的微生物活菌制剂来说是关键因素。微生物菌体的真空冷冻干燥是在低温低压条件下利用水分子的升华性能,使菌体低温脱水实现干燥的一种方式。在冻干过程中菌体丧失活力的主要原因是渗透压改变和细胞膜损伤。而冻干保护剂的加入会影响冷冻干燥后菌体的活性。因此,笔者考察了3种不同保护剂配方对冻干后酵母存活率的影响,其中添加保护剂A可使冻干存活率达到82.05%±6.09%,显著高于其他两种配方(<0.05),Niu等[15]使用该配方对进行冷冻干燥后,酵母存活率为76.90%,说明在冻干过程中,该保护剂配方能够有效降低干燥过程对微生物菌体的伤害。
为增加冻干制剂的流动性、分散性,常加入载体、润湿剂和分散剂等成分[24]。载体在制剂中所占比例较大,因此其润湿性和分散性对制剂的理化性质有较大影响[25]。李慧等[26]关于制备荧光假单胞菌()可湿性粉剂的研究表明硅藻土与滑石粉复配联用后载体的吸附作用和菌体释放率均较高。在本研究中,硅藻土作为载体时制剂的悬浮率最高、润湿时间最短且活菌数最高。生防制剂在果蔬表面有效定殖和保持较高的种群数量被认为是控制采后病害的重要因素[27]。表面活性剂可以通过降低表面张力来改善液体介质在表面的润湿性质,不仅能够改善制剂的理化性能,还有助于微生物在果蔬表面分散定殖[28]。在本研究中,选择皂角粉和亚甲基二萘磺酸钠作为冻干制剂的润湿剂和分散剂。
微生物经冷冻干燥后不会完全变成惰性状态,其呼吸作用也不会完全停止[29],而在低温条件下,可维持低水平的代谢活动,防止有毒代谢物在载体中积累,此外,低温可有效减少水分过度流失,有利于微生物的长期储藏[30]。而Xue等[31]的研究发现过低的贮藏温度同样不利于菌体的存活,蠕虫埃斯特菌()冻干粉在−20 ℃条件下贮藏1个月后其菌体几乎全部失活,而在4 ℃下其生存力仍保持良好。唐飞[32]将海洋酵母()冻干制剂储藏3个月发现4 ℃条件下更适合冻干粉的贮藏,其活菌数比25 ℃条件下贮藏时高4个数量级。在加速贮藏试验中,降低温度可使菌体失活速率常数减小(图4),因此适当降低温度可以延长制剂货架期。
有研究表明,菌株在冻干后无法完全保持生防活性,为此,我们比较了新鲜酵母与冻干制剂对柑橘果实主要病害的防治效果。如图6所示,在离体条件下新鲜酵母和冻干制剂对病原菌的拮抗作用无显著性差异,冻干过程并没有对酵母的生防作用造成不良影响,这与Niu等[15]的研究结果一致。图7所示,冻干制剂对柑橘果实采后主要病害具有较好的控制效果,病斑直径与对照组相比显著减小,表明在接种酵母后,一定程度上抑制了病原菌的生长,进一步证实桔梅奇酵母通过营养和空间的竞争来达到控制病害的作用,且在贮藏前期与新鲜酵母相比生防作用无显著性差异。这与本实验室前期研究结果一致[33-34]。

图7 桔梅奇酵母同孔接种处理柑橘采后绿霉病、青霉病和酸腐病的发病症状
4 结 论
本研究将酵母作为可湿性粉剂的有效成分进行研究开发,研制出一种以为主要活性成分的冻干制剂,通过助剂的单因素筛选试验和混料试验,得到其配方为:皂角粉5.69%、亚甲基二萘磺酸钠8.74%、母粉85.57%(质量分数)。在该配方条件下冻干制剂中酵母活菌数可达到4.72×108CFU/g。
将上述冻干制剂最优配方进行密封真空包装后,分别在25、30、35和40 ℃条件下进行加速试验预测冻干制剂的贮藏稳定性。通过拟合方程计算得到,在4 ℃贮藏条件下,冻干制剂的失活速率常数为1.044×10-4d-1。说明制剂配方的优化可大大提高其贮藏稳定性。与新鲜酵母相比,冻干制剂在离体条件下和柑橘果实上均可有效控制其采后病害的发生。与对照组相比,在贮藏6 d后,可有效降低果实绿霉病和青霉病发病率40%左右,降低果实酸腐病发病率70%左右。
本试验结果可为后期将拮抗酵母进行商业化应用提供理论依据。如果期望菌株在冻干后完全保持生防活性,可以进一步加入相关助剂以提高制剂的生防效果,但需考察助剂与酵母活性的兼容性。
[1] 荆佳伊,刘晓佳,邓丽莉,等. 采收成熟度对晚熟W.默科特柑橘贮藏期品质的影响[J]. 农业工程学报,2021,37(5):303-309.
Jing Jiayi, Liu Xiaojia, Deng Lili, et al. Effects of harvesting maturity on the quality changes during storage of late maturing W.[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(5): 303-309. (in Chinese with English abstract)
[2] 许金娟,杨书珍,张美红,等. 碳酸铵对意大利青霉的作用机制及对不同柑橘果实品质的影响[J]. 农业工程学报,2021,37(15):299-307.
Xu Jinjuan, Yang Shuzhen, Zhang Meihong, et al. Mechanism of ammonium carbonate onand its effect on the quality of different citrus fruits[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(15): 299-307. (in Chinese with English abstract)
[3] Liu J, Sui Y, Wisniewski M, et al. Review: Utilization of antagonistic yeasts to manage postharvest fungal diseases of fruit[J]. International Journal of Food Microbiology, 2013, 167(2): 153-160.
[4] Tamreihao K, Ningthoujam D S, Nimaichand S, et al. Biocontrol and plant growth promoting activities of astrain UCR3-16 and preparation of powder formulation for application as biofertilizer agents for rice plant[J]. Microbiological Research, 2016, 192: 260-270.
[5] Houngbedji M, Sidbewende C C, Emeric M Y, et al. Maize flour is a promising and low-cost carrier material for producing freeze-dried starter cultures adapted to cereal fermentation in West Africa[J]. Cogent Food & Agriculture, 2020, 6(1): 1858532.
[6] Carboni G, Fancello F, Zara G, et al. Production of a lyophilized ready-to-use yeast killer toxin with possible applications in the wine and food industries[J]. International Journal of Food Microbiology, 2020, 335: 108883.
[7] Stephan D, Da Silva A-P M, Bisutti I L. Optimization of a freeze-drying process for the biocontrol agentspp. and its influence on viability, storability and efficacy[J]. Biological Control, 2016, 94: 74-81.
[8] You Q, Juan P, Xie Y, et al. Optimization of protective agents and freeze-drying conditions forLT-L614[J]. Journal of Biobased Materials and Bioenergy, 2019, 13(1): 123-128.
[9] Cheng H, Li L, Hua J, et al. A preliminary preparation ofCE3 wettable powder for biological control of postharvest diseases[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2015, 43(1): 159-164.
[10] 张致军,罗远婵,章真,等. 防治白菜根肿病的新型海洋微生物农药:解淀粉芽孢杆菌Txc2-1可湿性粉剂配方优化及药效研究[J]. 农药学学报,2020,22(1):145-153.
Zhang Zhijun, Luo Yuanchan, Zhang Zhen, et al, Formulation optimization of the wettable powder of Bacillus amyloliquefaciens: A novel marine microbial pesticide for the control of cabbage clubroot[J]. Chinese Journal of Pesticide Science, 2020, 22(1): 145-153. (in Chinese with English abstract)
[11] 刘盼西,李淑兰,李元广,等. 海洋芽孢杆菌可湿性粉剂配方的优化[J]. 农药学学报,2014,16(2):206-212.
Liu Panxi, Li Shulan, Li Guangyuan, et al. Formulation optimization ofwettable powder[J]. Chinese Journal of Pesticide Science, 2014, 16(2): 206-212. (in Chinese with English abstract)
[12] 田媛媛. 檀香炭疽病拮抗细菌的筛选及其菌剂研制[D]. 长沙:中南林业科技大学,2015.
Tian Yuanyuan. Screening and Development of Biological Agent of Antagonistic Bacterium Against[D]. Changsha: Central South University of Forestry and Technology, 2015. (in Chinese with English abstract)
[13] 姚晓东. 枯草芽孢杆菌D-29可湿性粉剂的研制及其生防效果的研究[D]. 太原:山西农业大学,2016.
Yao Xiaodong. Preparation for Wettable Powder ofD-29 and its Application as Biocontrol Agent[D]. Taiyuan: Shanxi Agricultural University, 2016. (in Chinese with English abstract)
[14] 陈力维,张鸿雁,邓丽莉,等. 桔梅奇酵母液体制剂的制备及其在柑橘果实上的应用[J]. 农业工程学报,2021,37(18):299-306.
Chen Liwei, Zhang Hongyan, Deng Lili, et al. Preparation and application of liquid bioformulation ofon citrus fruits[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(18): 299-306. (in Chinese with English abstract)
[15] Niu X, Deng L, Zhou Y, et al. Optimization of a protective medium for freeze-driedand application of this biocontrol agent on citrus fruit[J]. Journal of Applied Microbiology, 2016, 121(1): 234-243.
[16] 李侨飞. 拟粉红锁掷孢酵母Y16控制葡萄采后病害及其机制和制剂化研究[D]. 镇江:江苏大学,2017.
Li Qiaofei. Biocontrol of Postharvest Diseases of Table Grapes byY16 and Study on Its Mechanism and Preparation[D]. Zhenjiang: Jiangsu University, 2017. (in Chinese with English abstract)
[17] Chen H, Chen S, Li C, et al. Response surface optimization of lyoprotectant forduring vacuum freeze-drying[J]. Preparative Biochemistry & Biotechnology, 2015, 45(5): 463-475.
[18] 中华人民共和国国家质量监督检验检疫总局. GB/T 5451-2001. 农药可湿性粉剂润湿性测定方法[S]. 北京:中国标准出版社,2001.
[19] 中华人民共和国国家质量监督检验检疫总局. GB/T 14825-2006. 农药悬浮率测定方法[S]. 北京:中国标准出版社,2006.
[20] 江帆. 芽孢杆菌AI微生物农药制剂的研制[D]. 上海:上海师范大学,2015.
Jiang Fan. Bacillus AI the Development of Microbial Pesticide Formulations[D]. Shanghai: Shanghai Normal University, 2015. (in Chinese with English abstract)
[21] Guo W S, Yang X, Li C, et al. Comprehensive optimization of composite cryoprotectant forduring freeze-drying and evaluation of its storage stability[J]. Preparative Biochemistry & Biotechnology, 2019, 49(9): 846-857.
[22] Parafati L, Vitale A, Restuccia C, et al. Biocontrol ability and action mechanism of food-isolated yeast strains againstcausing post-harvest bunch rot of table grape[J]. Food Microbiology, 2015, 47: 85-92.
[23] Wang L, Wu H, Qin G, et al. Chitosan disruptsand controls postharvest blue mold of jujube fruit[J]. Food Control, 2014, 41: 56-62.
[24] 明亮,陈志谊,储西平,等. 生物农药剂型研究进展[J]. 江苏农业科学,2012,40(9):125-128.
[25] 姜虹,闫凤超,于文清. 微生物农药助剂研究进展[J]. 现代化农业,2020(1):2-6.
[26] 李慧,王平,肖明. 硅藻土和滑石粉作为荧光假单胞菌P13菌剂的载体研究[J]. 中国生物防治,2009,25(3):239-244.
Li Hui, Wang Ping, Xiao Ming. Use of diatomite and talc as carriers of theP13[J]. Chinese Journal of Biological Control, 2009, 25(3): 239-244. (in Chinese with English abstract)
[27] Guijarro B, Melgarejo P, De Cal A. Influence of additives on adhesion ofconidia to peach fruit surfaces and relationship to the biocontrol of brown rot caused by Monilinia laxa[J]. International Journal of Food Microbiology, 2008, 126(1/2): 24-29.
[28] Guijarro B, Larena I, Melgarejo P, et al. Surfactant effects on wettability offormulations to improve brown rot biocontrol[J]. Journal of the Science of Food and Agriculture, 2018, 98(15): 5832-5840.
[29] Burges H D, Jones K A. Trends in Formulation of Microorganisms and Future Research Requirements, Formulation of Microbial Biopesticides[M]. Netherlands: Springer, 1998: 311-332.
[30] Trivedi P, Pandey A, Palni L M S. Carrier-based preparations of plant growth-promoting bacterial inoculants suitable for use in cooler regions[J]. World Journal of Microbiology & Biotechnology, 2005, 21(6/7): 941-945.
[31] Xue J J, Hou J G, Zhang Y A, et al. Optimization of storage condition for maintaining long-term viability of nematophagous fungusas biocontrol agent against pinewood nematode[J]. World Journal of Microbiology & Biotechnology, 2014, 30(11): 2805-2810.
[32] 唐飞. 海洋生防酵母干燥工艺研究[D]. 杭州:浙江大学,2012.
Tang Fei. The Study of Drying Process of[D]. Hangzhou: Zhejiang University, 2012. (in Chinese with English abstract)
[33] Wang S, Ruan C, Yi L, et al. Biocontrol ability and action mechanism ofagainst Geotrichum citri-aurantii causing sour rot of postharvest citrus fruit[J]. Food Microbiology, 2020, 87: 103375.
[34] Liu Y, Wang W, Zhou Y, et al. Isolation, identification and in vitro screening of Chongqing orangery yeasts for the biocontrol ofon citrus fruit[J]. Biological Control, 2017, 110: 18-24.
Preparation of wettable powder and its application on citrus fruits based onfreeze-dried powder
Chen Liwei1, Zhang Hongyan1, Zeng Kaifang1,2,3※
(1.,400715,;2.,,400715,;400712)
Microbial preparation refers to the living microorganism as the main component, including inert carrier materials, nutrients, and other accessory ingredients. It is necessary to maintain the vitality and effectiveness of microorganisms in the biocontrol preparations for a long time, particularly in the development of biocontrol products. The storage stability of biocontrol agents can be a key factor to ensure the number of microorganisms and the biological control.can be expected to efficiently control the postharvest green mold and sour rot caused byandon the citrus fruit, indicating its great application and development value. This study aims to develop antagonistic yeast biocontrol agents with a long shelf life and stable biocontrol effect. The wettable powder was also prepared with theas the main active ingredient. The single factor and mixing tests were carried out to optimize the accessory ingredient for the wettable powder. Then, the wettable powder was applied to the citrus fruits. An accelerated storage test was conducted to predict the storage stability of the preparation, and evaluate the control effect of the preparation on the main postharvest diseases of citrus under in vitro and in vivo conditions. The results showed that the carriers, wetting powder, and suspending agent were screened by the single factor test with the mixing test. An optimal combination of the preparation was achieved with the honeylocust powder of 5.69%, dispersing agent NNO of 8.74%, and freeze-dried powder of 85.57%. The number of viable yeast in the freeze-dried preparation reached 4.72×108CFU/g, and the wetting time was (7.82±1.02) s, while the suspensibility was up to 71.56%±0.06%. The accelerated storage test demonstrated that better storage performance was achieved in the freeze-dried bioformulation. Among them, the wettable powder was stored at four temperatures. The deactivation rate constant of yeast gradually increased in the wettable powder, whereas, the death rate of yeast accelerated with the increase in storage temperature. The viable yeast population in the preparation was estimated to be 4.6×108CFU/g, when the storage at 4℃ for one year. Therefore, there was an appropriate reduction of storage temperature for better storage ability. In vitro tests and fruit tests were carried out to learn the application effect of the preparation. The experiments showed that the wettable powder effectively controlled the occurrence of postharvest citrus fruit diseases. It was found that there was no significant change in the inhibitory effect of wettable powder on the postharvest pathogen and pigment production capacity of, compared with fresh yeast. Specifically, the inhibition zone reached more than 9 mm. Fresh yeast presented a remarkable control effect on the blue and green mold, and sour rot on the citrus fruits. The formulation reduced the incidence of three citrus postharvest diseases by 40%-70%. To sum up, the preparation treatment ofcan be expected to effectively retain cell viability and biocontrol efficacy. The wettable powder with theas the main active ingredient indicated a significant decrease in the incidence of postharvest disease on the citrus fruits. The finding can provide the theoretical and practical basis for the application ofin the biological control of postharvest citrus diseases.
agricultural products; postharvest disease;; freeze-dried preparation; postharvest; citrus fruits; biological control
10.11975/j.issn.1002-6819.2022.15.033
TS255.3
A
1002-6819(2022)-15-0305-09
陈力维,张鸿雁,曾凯芳. 基于桔梅奇酵母冻干粉制备可湿性粉剂及其在柑橘上的应用[J]. 农业工程学报,2022,38(15):305-313.doi:10.11975/j.issn.1002-6819.2022.15.033 http://www.tcsae.org
Chen Liwei, Zhang Hongyan, Zeng Kaifang. Preparation of wettable powder and its application on citrus fruits based onfreeze-dried powder[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(15): 305-313. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.15.033 http://www.tcsae.org
2022-04-07
2022-07-11
重庆市技术创新与应用发展专项重点项目(cstc2021jscx-cylhX0015);四川省科技计划重点研发项目(2021YFQ0071)
陈力维,研究方向为农产品加工及贮藏。Email:chenliwei013211@163.com
曾凯芳,博士,教授,博士生导师,研究方向为果蔬贮藏与物流保鲜。Email:zengkaifang@163.com

