海藻酸钠-酚醛树脂复合凝胶球制备及对Au(III)的吸附性能
刘 云, 向 勇, 陈香萌, 弓浩宇, 徐 丽
(郑州大学 化工学院, 河南 郑州 450001)
1 前 言
黄金因独特的物化性质在珠宝首饰、电子电器、医疗设备、航空航天等领域应用广泛,且需求量和价格随着高新技术的发展持续上升,而我国黄金资源有限,仅为世界总储量[1-2]的7%。出于黄金的高价值和稀缺性,生产过程中大量排放的含金废水可作为回收金的二次资源。离子交换[3]、溶剂萃取[4]、膜分离[5]、化学沉淀[6]等金回收方法在不同场合应用时虽有一定效果,但仍存在效率低、价格昂贵和产生二次污染等问题。吸附法因经济高效、操作简单和环境安全的特点,在金属富集回收领域被广泛应用。但目前报道较多的用于吸附金离子的材料,如螯合纤维[7]、MoS2纳米片[8]、MOF 材料[9]等制备过程复杂且成本较高,因此开发出高性能、低成本、易回收的金吸附材料是吸附法在金回收中应用的关键。
本课题组前期利用酚醛树脂改性聚合物吸附Au(III),发现该材料对Au(III)具有优异的吸附效果,但由于树脂粉末粒度较小,吸附金属离子后不易从溶液中分离回收[10-12]。因此,本研究利用凝胶性良好的海藻酸钠(SA)作骨架,通过包埋共混酚醛树脂(RF),与Ca2+交联后形成宏观凝胶,获得了易分离、低成本的海藻酸钠-酚醛树脂复合凝胶球(SA-RF)吸附材料。采用傅里叶变换红外(FT-IR)、扫描电镜(SEM)、透射电镜(TEM)和X 射线衍射(XRD)等手段对SA-RF 凝胶球进行表征,考察不同实验条件对吸附性能的影响,并通过吸附动力学和热力学研究探讨Au(III)在SA-RF 上的吸附行为。结果表明,SA-RF 凝胶球吸附容量可观,在富集回收金资源方面有望成为一种极具潜力的吸附剂。
2 实验部分
2.1 实验试剂
间苯二酚和氨水购自国药集团化学试剂有限公司;甲醛、盐酸和氢氧化钠购自洛阳化学试剂厂;乙醇和无水氯化钙购自天津永大化学试剂有限公司;海藻酸钠购自天津市科密欧化学试剂有限公司;氯化金水合物、六水合氯化铁、三水合硝酸铜、硝酸铬九水合物、硝酸镍六水合物、六水合氯化钴和氯化锌购自Macklin。以上化学试剂均为分析纯,去离子水为实验室自制。
2.2 SA-RF 复合凝胶球的制备
RF 通过改进Stöber 法制备[13-14],具体步骤:取去离子水、乙醇和氨水依次添加到烧杯中,室温下搅拌1 h 后向混合液中依次加入间苯二酚和一定量的甲醛。持续搅拌24 h 后将红棕色悬浮液离心,残留固体物用去离子水和乙醇多次洗涤,在60 ℃烘箱中干燥至恒重。取所得产品RF 与一定浓度的SA 溶液混合,室温搅拌至溶液分散均匀,将混合液以液滴形式匀速滴加到质量分数为2% CaCl2溶液中,滴加完毕后静置一段时间以稳定吸附剂的球体结构,后用去离子水多次洗涤除去表面残余Ca2+,即得SA-RF 复合凝胶球,浸泡在去离子水中以备后续实验使用,制备流程如图1 所示。

图1 SA-RF 凝胶球的制备步骤Fig.1 Processes of SA-RF gel beads preparation
2.3 材料表征
SA-RF 凝胶球干燥研磨均匀后,通过FT-IR 光谱测试(FT-IR300,深圳昂威电子有限公司)分析官能团;通过SEM(JSM-7500F,日本电子)和TEM(TalosF200,美国FEI 公司)观察样品微观形貌;通过XRD(德国Bruker AXS 公司D8 Advance 型,Cu-Kα 辐射)获得材料结构信息;通过原子吸收分光光度计(TAS-990,北京通用分析仪器有限公司)测量Au(III)质量浓度。
2.4 静态吸附实验
所有间歇吸附实验均取一定质量的吸附剂和设定质量浓度、pH 的Au(III)溶液混合,黑暗环境下振荡吸附一段时间后过滤,测定滤液中残留Au(III)的质量浓度,系统研究溶液pH、接触时间、初始质量浓度、吸附温度对SA-RF 吸附性能的影响。评估选择性时,考虑到实际废水所含Au(III)的质量浓度很低,制备模拟液时设定其他金属离子的质量浓度远高于Au(III),吸附完成后使用0.45 μm 滤头过滤,采用电感耦合等离子体光谱技术(ICP-OES)测量滤液中各金属离子的质量浓度。吸附率(q,%)和吸附容量(Qe,mg·g-1)分别按式(1)、(2)计算:

式中:ρ0、ρe分别为Au(III)溶液初始质量浓度和平衡质量浓度,mg·L-1;m为实验过程中所用的吸附剂质量,g;V为实验过程中所用的金属离子溶液体积,L。
3 结果与讨论
3.1 SA-RF 的表征
SA、RF 和SA-RF 的红外光谱如图2 所示,815、889 cm-1处的弱峰对应SA 所含β-D-甘露糖醛酸残基及C─H 弯曲振动[15],1 026、1 410、1 592 cm-1处的尖强峰分别为醇羟基C─O 键、羧酸盐(─COO-)的对称和不对称伸缩振动峰,3 100~3 700 cm-1处的宽带峰对应─OH键伸缩振动[16]。对于RF 和SA-RF,3 303 cm-1的宽带峰和3 666 cm-1处的弱尖峰均对应于─OH 伸缩振动,C─H 伸缩振动峰位于2 898 和2 982 cm-1处。受RF 位于1 170、1 232 cm-1处C=C─O 伸缩振动[17-18],和1 395、1 455、1 613 cm-1处羟基变形及酚羟基拉伸或羧基反对称及苯环C=C 骨架伸缩振动峰的影响[12],SA-RF 凝胶球在1 250 cm-1处的宽峰对应酚C─O 伸缩振动,羧酸盐振动峰分别移动至1 406 cm-1和1 597 cm-1处,说明SA 和RF 可能存在相互作用[16,19]。

图2 SA, RF和SA-RF的红外光谱图Fig.2 FTIR spectra of SA, RF and SA-RF
SA-RF 凝胶球的微观形貌如图3 所示,吸附前后材料的形态无明显变化,RF 微球均匀嵌于SA 基体上;单一RF 微球被SA 包裹,吸附Au(III)后内部有小颗粒存在。为分析其组分,对吸附前后的凝胶球进行XRD 分析,如图4 所示,SA-RF 为无定形非晶结构,在吸附Au(III)后有明显结晶衍射峰出现,2θ=38.2°、44.4°、64.6°和77.5°处的峰分别对应于元素金的(111)、(200)、(220)和(311)晶面,说明吸附过程中SA-RF在吸附Au(III)的同时可将其还原为金单质[12]。

图3 吸附前后SA-RF 的SEM 和TEM 图Fig.3 SEM and TEM images of SA-RF before and after adsorption

图4 SA-RF 和SA-RF-Au 的XRD 图谱Fig.4 XRD patterns of SA-RF and SA-RF-Au
为了进一步探究凝胶球所含官能团对吸附过程的影响,采用XPS 对吸附前后的SA-RF 进行分析。Au 4f 的窄谱分析结果如图5 所示,吸附在SA-RF 上的金物种可分为Au(0)和Au(III)两类,粗略计算其质量分数可发现,吸附过程中,大部分三价金属盐被还原为金单质,与XRD 分析结果相符。

图5 吸附Au(III)后SA-RF 的Au 4f 光谱Fig.5 Au 4f spectra of SA-RF after Au (III) adsorption
对SA-RF 凝胶球所含元素(C、O、Ca、Cl)进行分峰拟合,以说明Au(III)在材料表面的吸附机制。如图6 所示,对于C 1s,结合能为286.56 eV(C─O)和288.36 eV(C=O)处的两峰在吸附Au(III)后发生偏移,而O 1s 光谱中也可观察到531.43 和532.94 eV 处的两峰在吸附后分别移至531.35 和532.80 eV 处。基于XPS 分析吸附前后SA-RF 表面官能团的组成变化,如表1 所示,吸附Au(III)后,C─O 质量分数减小,C=O质量分数增加,说明C─O 基团在吸附和还原Au(III)的过程中发挥着重要作用。因SA-RF 制备时使用CaCl2交联,Ca 2p 和Cl 2p 特征峰强度在吸附Au(III)后均减弱,说明吸附过程中以阴离子形态存在的AuCl4-或与Cl-发生离子交换[16]。因此,推测以AuCl4-存在的金物种经离子交换、静电吸引及C─O、C=O 螯合到吸附剂表面,且在吸附过程中伴随着部分酚羟基被氧化,Au(III)被还原为Au(0),沉积在材料表面。

表1 基于XPS 分析吸附前后SA-RF 表面不同官能团组成Table 1 Composition of functional groups on SA-RF surface before and after adsorption (XPS analysis)
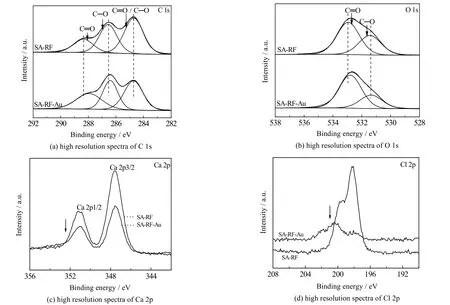
图6 吸附Au(III)前后SA-RF 的C 1s、O 1s、Ca 2p 和Cl 2p 的高分辨光谱Fig.6 High resolution spectra on C 1s, O 1s, Ca 2p and Cl 2p of SA-RF before and after Au(III) adsorption
3.2 吸附实验
溶液pH 值影响金离子的存在形式和吸附剂所带官能团的电离状态。本实验在各个样品瓶中均添加15 mg 吸附剂和10 mL 初始质量浓度为50 mg·L-1的Au(III)溶液,使用稀HCl 和NaOH 溶液调节pH 范围为1~7,在25 ℃下以200 r·min-1的震荡速度吸附2 h,考察酸度对吸附性能的影响。如图7 所示,吸附率随pH 值升高先增大后减小,在pH=4 时达到较优吸附。这是因为pH 值较低时,酸性溶液中大量Cl-与AuCl4-竞争材料表面的吸附位点[20],且SA 结合H+形成羧基,影响有效官能团与金属离子的配位,从而降低材料对Au(III)的吸附能力[21];pH 值进一步升高,AuCl3(OH)-、AuCl2(OH)2-、AuCl(OH)3-和AuCl(OH)4-等氯金配合物质量分数增加,静电排斥或使得吸附率降低[22]。为简化操作和节约成本,后续实验均使用pH=5 的原配金溶液。

图7 溶液pH对吸附的影响Fig.7 Effects of solution pH on adsorption
在各个样品瓶中均添加4.5 mg 吸附剂和3 mL pH 为5、初始质量浓度为50 mg·L-1的Au(III)溶液,在25 ℃下以200 r·min-1的震荡速度在1~300 min 内考察接触时间对材料吸附性能的影响。如图8 所示,凝胶球对Au(III)的吸附率在初始45 min 内迅速增大,随着时间t延长,吸附率缓慢增大,直至在3 h 后达到吸附平衡。这是因为吸附初期,SA-RF 表面存在大量吸附位点,且溶液中Au(III)质量浓度较大引起的传质推动力较高,促使Au(III)被快速吸附,随着表面位点逐渐被占据,溶液残留Au(III)质量浓度降低,导致传质推动力减弱[23],吸附速率减缓,同时脱附速率增加,最后达到吸-脱附平衡。

图8 接触时间对吸附的影响Fig.8 Effects of contact time on adsorption
研究Au(III)初始质量浓度对吸附的影响可获得材料的最大吸附量。在各个样品瓶中均添加7.5 mg 吸附剂和10 mL pH 为5、初始质量浓度在100~700 mg·L-1的Au(III)溶液,在25 ℃下以200 r·min-1的震荡速度进行吸附反应,4 h 后过滤并收集滤液。如图9 所示,随着初始质量浓度的增大,吸附率减小,吸附容量增大,在初始质量浓度达700 mg·L-1时,吸附量增大减缓,当Au(III)和表面活性位点间的相互作用与溶液和材料间的传质阻力持平时,吸附剂基本达到吸附饱和状态,此时吸附量为508 mg·g-1。通过与表2 中的其他生物质吸附剂对比可以发现,SA-RF 凝胶球对Au(III)具有良好的吸附能力。

表2 某些生物吸附剂对Au(III)的吸附容量比较Table 2 Comparison of adsorption capacities of different Au(III) biosorbents

图9 Au(III)初始质量浓度对吸附的影响Fig.9 Effects of Au(III) initial concentration on adsorption
在4 个样品瓶中各添加15 mg 吸附剂和10 mL pH为5、初始质量浓度为600 mg·L-1的Au(III)溶液,以200 r·min-1的震荡速度在不同温度下吸附3 h。如图10 所示,图中T为吸附热力学温度(K),从图中可看出,温度升高有利于吸附,这是因为溶液中的Au(III)在温度较高时能较快到达凝胶球表面,导致吸附剂表面的Au(III)质量浓度增加,推动平衡向吸附方向移动,从而使得材料表面的平衡覆盖率增大,吸附容量提高[21]。

图10 吸附温度对吸附的影响Fig.10 Effects of adsorption temperature on adsorption
3.3 热力学研究
采用Van't Hoff 方程拟合数据进行热力学研究,可初步了解吸附过程的性质,拟合曲线如图11 所示。根据方程(3)~(5)可获得焓变ΔH°(kJ·mol-1)、熵变ΔS°(kJ·mol-1·K-1)及吉布斯自由能ΔG°(kJ·mol-1):

图11 SA-RF 吸附Au(III)的Van’t Hoff 曲线Fig.11 Van’t Hoff plots of Au(III) adsorption on SA-RF

式中:Kd为分配系数;ρa为吸附剂表面的Au(III)质量浓度,mg·L-1;R为摩尔气体常数,8.314 J·mol-1·K-1。
实验数据经拟合计算,所得结果如表3所示,ΔG°<0,ΔH°>0,ΔS°>0,说明SA-RF 凝胶球对Au(III)的吸附为自发吸热过程;ΔG°随温度升高逐渐减小,说明所选温度范围内,温度较高时更利于吸附[10]。

表3 吸附热力学拟合参数Table 3 Fitting parameters of adsorption thermodynamics
3.4 吸附动力学研究
为了进一步了解Au(III)在SA-RF上的吸附过程,使用伪一级和伪二级模型进行吸附动力学研究,其表达式如式(6)、(7)所示:

式中:Qt为时刻t的吸附量,mg·g-1;k1(min-1)和k2(g·mg-1·min-1)分别为伪一级和伪二级速率常数;2 种模型的线性拟合图和相应参数如图12 和表4 所示。相对而言,伪二级模型(相关系数R2=0.987 7)对实验数据的拟合度更高,这说明SA-RF 凝胶球捕获金离子的过程中化学吸附占主导[11]。
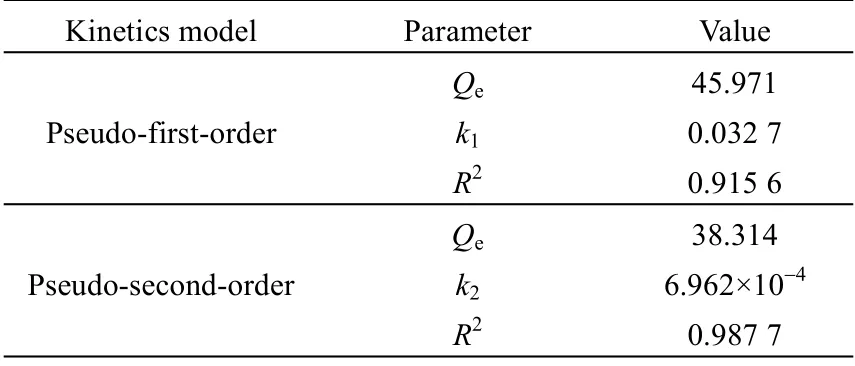
表4 吸附动力学拟合参数Table 4 Fitting parameters of adsorption kinetics

图12 SA-RF 吸附Au(III)的动力学模型Fig.12 Kinetic models for Au(III) adsorption on SA-RF
3.5 吸附等温线研究
通过研究吸附等温线可以更深层次地理解Au(III)在材料上的吸附行为。Langmuir 和Freundlich 两种常用等温线的线性表达式如式(8)、(9)所示:

式中:Qm为理论最大吸附量,mg·g-1;KL、KF分别为Langmuir、Freundlich 模型吸附常数,L·mg-1;1/n为吸附过程的难易度。2 种等温线模型的拟合结果如图13 和表5 所示,Freundlich 模型(相关系数R2=0.991 1)的拟合度更高,说明异质表面活性位点分布不均匀,Au(III)在SA-RF 凝胶球上表现为多分子层吸附。此外,0.1<1/n<1.0,可认为吸附过程容易进行[10]。

表5 等温吸附线拟合参数Table 5 Fitting parameters of adsorption isotherms

图13 SA-RF 吸附Au(III)的等温线模型Fig.13 Isotherm models for Au(III) adsorption on SA-RF
3.6 选择性和洗脱再生
实际工业活动产生的含金废水成分复杂,多种离子共存影响材料对Au(III)的吸附,因此研究SA-RF 凝胶球的选择性十分重要。按照已报道文献中的离子组成配制模拟混合液[30],竞争吸附的结果如图14 所示。相比于其他离子,SA-RF 对Au(III)的亲和力更高,可能是因为酸性水溶液中Au(III)以AuCl4-形式存在,带负电,依靠静电作用与树脂相互吸引,而其他杂离子均带正电荷,受树脂表面官能团排斥[10]。
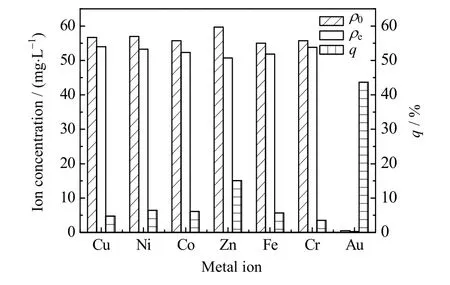
图14 共存离子对吸附的影响Fig.14 Effects of coexisting ions on adsorption
为研究SA-RF 凝胶球的再生性能,将其投加到10 mL 初始质量浓度为50 mg·L-1的Au(III)溶液中吸附一定时间,后使用等体积洗脱液进行脱附。吸脱附循环结果如图15 所示,酸性硫脲溶液(1 mol·L-1HCl+质量分数5% 硫脲)虽具有洗脱效果,但脱附后的凝胶球在二次吸附中对Au(III)去除程度较小,使用其他种类的洗脱液再生效果均不理想。考虑到洗脱液后处理的高成本和污染性,以及凝胶球的低成本和金资源的高价值,可使用酸性硫脲溶液一次洗脱法或焚烧法回收凝胶球上富集的金物种。

图15 循环次数对吸附的影响Fig.15 Effects of cycle times on adsorption
4 结 论
采用简单的共混法将海藻酸钠和酚醛树脂复合制备了SA-RF 凝胶球,用于从水溶液中选择性回收Au(III)。间歇吸附实验表明,7.5 mg 吸附剂投加到10 mL pH 为5、初始质量浓度为800 mg·L-1的含金溶液中,25 ℃保持震荡吸附4 h 后,SA-RF 对Au(III)的吸附量可达508 mg·g-1。动力学和热力学研究表明,Au(III)在SA-RF 上的吸附由多分子层化学吸附主导,吸附过程自发吸热,适合用伪二级动力学方程和Freundlich 等温线模型描述,即使在多离子混合液中仍可选择性地吸附Au(III)。氧化还原、配位作用,离子交换和静电吸引共同作用于SA-RF 凝胶球对Au(III)的吸附。这种合成简单、环保经济、易于分离的新型吸附剂在贵金属回收领域具有巨大潜力,同时也为新型吸附剂的合成提供了新思路。

