天麻素对脑缺血大鼠缺血侧额叶皮质中RhoA和ROCK-2蛋白表达的影响
李芹,殷姿,刘江品,邱金明,胡郭,刘敏
(1. 皖南医学院临床医学院,安徽 芜湖 241002;2. 皖南医学院解剖教研室,安徽 芜湖 241002)
天麻(gastrodi elata blume)是我国传统的中药材,被广泛用于治疗头痛、头晕、痉挛、癫痫、中风、健忘症等疾病,在医学上有重要的价值[1]。经临床研究证实,天麻素注射液可以有效减轻神经系统的损害程度,且具有良好的抗炎、抗氧化、抗细胞凋亡及神经元保护等活性[2]。血栓或栓子造成的血管阻塞是引起脑缺血的原因,在脑缺血期间,大脑局部缺氧和营养不足,诱导神经细胞异常新陈代谢,进而使细胞紊乱致大脑受到严重损害,阻断脑缺血时神经细胞异常新陈代谢对治疗脑缺血起着重要作用[3]。有研究表明,有效抑制Ras同源基因家族成员A(ras homolog gene family member A,RhoA)的表达可促进神经轴突的再生,改善脑缺血大鼠的认知和记忆功能[4]。还有研究显示,在神经细胞中,Rho相关卷曲螺旋蛋白激酶(rho-associated coiled-coil containing kinase,ROCK-2)的大量表达可能会导致神经炎症和变性,降低ROCK-2的表达可以促进轴突再生,抑制凋亡,避免神经元的损伤[5-6]。已有研究证明,天麻素能显著升高缺血侧VEGF水平,强化细胞增殖并增加缺血周围区域新生神经细胞的数量。同时,天麻素还能控制炎症反应,抑制细胞凋亡,诱导神经保护,促进神经发生并恢复Wnt/β-Catenin 信号通路,改善脑损伤[7]。但目前仍然缺乏对天麻素发挥脑缺血局灶保护作用的具体机制的研究。本研究从调控RhoA/ROCK-2信号转导通路角度进一步探讨天麻素对大脑中动脉阻塞法(MCAO)大鼠缺血侧额叶皮质的神经保护机制,目的是为临床上应用天麻素治疗缺血性脑损伤提供相关理论依据。
1 材料与方法
1.1实验动物及分组 40只健康成年SD大鼠(雄性),体重(200±20) g,由青龙山动物实验中心提供[合格证号:SCXK(沪)2018-0004],适宜条件下分笼饲养,保证其自然饮水、摄食。1周后,随机分组,每组10只,共4组(正常组、假手术组、模型组及天麻素组)。
1.2主要仪器及试剂 尼氏(Nissl)染色液、山羊抗兔IgG二抗、超敏ECL化学发光试剂盒、SABC免疫组织化学染色试剂盒均购自碧云天生物技术有限公司,天麻素注射液(2 mL∶200 mg)购自西南药业股份有限公司,RhoA、ROCK-2抗体为美国Affinity、增强型HRP-DAB底物显色试剂盒购自天根生化科技(北京)有限公司。
1.3模型制备及筛选 按照董文青等的研究所采用的方法复制模型,以线栓阻塞大鼠右侧颈内动脉(ICA)[8]。造模前12 h断食不断水,称重,麻醉[1.5%戊巴比妥钠腹腔注射(0.4 mL/200 g)],固定、备皮、消毒、切开,游离腺体、筋膜、肌肉、动脉及神经,操作动作放轻,尽量减少牵拉,避免不必要损伤。置线结扎颈总动脉(CCA)的近心端,动脉夹夹闭远心端,在动脉夹附近置线备用,在线近端ICA处用套管针扎一小孔,将线栓置入后取下动脉夹,沿ICA前行至微感阻力,深度(18.50±0.50) mm,扎紧备用线以固定栓线和防止出血,剪去血管外栓线。切口常规缝合、消毒。假手术组同模型组操作,但不插入栓线。造模结束麻醉苏醒后,观察大鼠行为,判断模型是否成功,将造模成功的大鼠继续后续实验。
1.4干预方法 造模成功后第1天开始,对天麻素组进行干预,腹腔注射天麻素制剂(2 mg/200 g),每晚1次,持续14 d。其他组不加干预。
1.5取材方法及检测方法 取材方法:在天麻素组治疗结束后,每组随机取5只大鼠,用1.5%戊巴比妥钠(0.4 mL/200 g)腹腔注射麻醉、4%多聚甲醛灌注后,断头取脑,石蜡包埋、切片(厚度5 μm),用于Nissl和免疫组化染色。再取每组另外5只大鼠,用1.5%戊巴比妥钠(0.4 mL/200 g)腹腔注射麻醉后,断头取脑置于冰上,快速提取右侧额叶皮质,-80 ℃保存,用于Western blot检测。Nissl染色法:备用石蜡切片常规脱蜡至水(依次放入二甲苯Ⅰ和Ⅱ、乙醇梯度、双蒸水)后,Cresyl Violet Stain染色液浸染(56 ℃烤箱),1 h后用冷双蒸水洗去,Nissl Differentiation分化液分化10 s左右,重复上述分化步骤,至镜下观察背景、细胞分明。脱水、透明、封固,在400倍镜视野下采集图片,利用Image J软件分析系统对每张切片右侧额叶皮质相同区域细胞数量进行统计。免疫组织化学染色法:备用石蜡切片常规脱蜡至水后,滴加3%过氧化氢反应8~10 min(37 ℃)后,用PBS洗去(5 min×3次),再枸橼酸缓冲液微波修复(高火2 min,低火12~15 min),自然冷却后冲洗,滴加免疫组化染色通透液(TritonX-100)常温放置30 min后,用PBS洗去,再滴加5%BSA牛血清封闭液37 ℃封闭1 h,擦去封闭液后分别滴加一抗(RhoA和ROCK-2抗体稀释液,1∶100)4 ℃ 16 h(过夜)。第2天,取出复温用PBS洗去一抗后,滴加二抗(山羊抗兔IgG)37 ℃ 1 h后,用PBS洗去二抗,再滴加三抗(SABC)37 ℃ 1 h后用PBS洗去。滴加DAB(1000∶50∶50)避光显色,至镜下观察细胞、背景分明后,流水冲去DAB,干片,常规固封,在400倍视野下采集图片,利用Image-Pro Plus 6.0软件测定右侧额叶皮质相同区域阳性细胞的平均吸光度值。Western blot检测:取出冷冻(-80 ℃)保存的右侧额叶皮质提取组织总蛋白后,测分子量,经验性选择配置凝胶,加样电泳1.5~2 h,转膜(110 V,湿转)100 min,脱脂奶粉封闭2 h后,用TBST液洗1次(10 min),根据Maker线裁剪膜后分别放入稀释的RhoA、ROCK-2一抗(均1∶1000)以及β-actin(内参)溶液中,4 ℃过夜(摇床上)。第2天,3个抗体分开用TBST分别洗3次,1次10 min,然后将膜放入稀释的二抗(山羊抗兔IgG)(1∶1000)中室温下(摇床上)1 h后用TBST洗去。用ECL化学发光液(A∶B=500∶500)及Amersham Imager 600系统进行曝光。采用Image J软件测量并分析各组条带的灰度值。
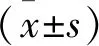
2 结果
2.1各组大鼠缺血侧额叶皮质Nissl染色结果比较 正常组和假手术组缺血侧额叶皮质神经元排列整齐,结构清晰完整,胞质丰富淡染,胞核居中深染,核仁清晰可见。模型组大鼠缺血侧额叶皮质神经元排列不均,数量减少,胞体明显萎缩,胞质减少,部分胞核固缩。天麻素组大鼠缺血侧神经元萎缩状况较模型组明显减轻,细胞形态也明显改善(见图1、图2)。

图1 各组大鼠右侧额叶皮质的Nissl染色图(×400)

注:与假手术组相比,###P<0.001;与模型组相比,*P<0.05。
2.2各组大鼠缺血侧额叶皮质免疫组织化学染色检测RhoA和ROCK-2表达结果比较 与正常组相比,假手术组缺血侧额叶皮质RhoA和ROCK-2蛋白的阳性表达差异均无统计学意义(P>0.05)。与假手术组相比,模型组缺血侧额叶皮质RhoA和ROCK-2蛋白的阳性表达均显著增加(P<0.001)。与模型组相比,天麻素组缺血侧额叶皮质RhoA蛋白的阳性表达有所减少(P<0.05);ROCK-2蛋白的阳性表达显著减少(P<0.001),见图3、图4。
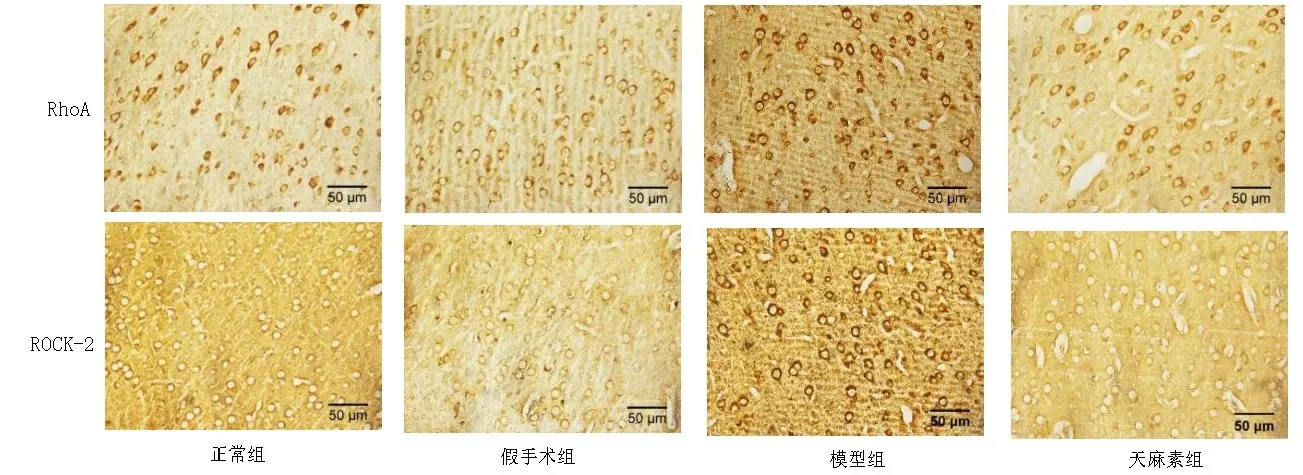
图3 各组大鼠右侧额叶皮质RhoA和ROCK-2免疫组织化学染色图(×400)

RhoA:与假手术组相比,###P<0.001;与模型
2.3各组大鼠缺血侧额叶皮质Western blot法测定RhoA和ROCK-2相对表达量结果比较 与正常组相比,假手术组缺血侧额叶皮质RhoA和ROCK-2蛋白的相对表达量差异均无统计学意义(P>0.05)。与假手术组相比,模型组缺血侧额叶皮质RhoA蛋白的相对表达量升高(P<0.05);ROCK-2蛋白的相对表达量显著升高(P<0.01)。与模型组相比,天麻素组缺血侧额叶皮质RhoA蛋白的相对表达量有所降低(P<0.05);ROCK-2蛋白的相对表达量显著降低(P<0.01),见图5。


RhoA:与假手术组相比,#P<0.05;与模型组相比,*P<0.05;ROCK-2:与假手术组相比,## P<0.01;与模型组相比,**P<0.01。
3 讨论
卒中是全世界第三大死因,全球每年平均卒中发病率为每1000人新增2例,每年大约有79.5万人原发卒中或卒中复发[9]。其中,急性缺血性脑卒中(AIS)是目前最常见的类型,占比87%[10]。已有临床研究证实,大多数脑缺血患者会发生神经元的损伤和凋亡[11]。在过去的几年中,急性缺血性卒中的治疗取得了显著的进展,尤其是与血管重建相关的治疗,但是在神经保护领域取得的进展较少[12]。本实验Nissl染色结果显示模型组缺血侧额叶皮质神经细胞数比假手术组明显减少,表明脑缺血损害了神经细胞。因此,寻找一种能干预脑缺血后相关蛋白表达对梗死灶周围和远隔部位神经组织影响的治疗药物或方法具有重要临床意义。
最新研究显示,中药三七、黄芪、丹参在缺血性脑卒中可以通过多靶点、多途径发挥神经保护作用[13]。三七被誉为“人参之王”,治疗缺血性脑卒中效果显著。药理研究证实,三七可通过抗炎、清除氧自由基、增加脑血流量等修复神经血管单元[14]。而黄芪-丹参药对中的黄芪为补气之王,能益气补虚;丹参为调血之首,偏于活血化瘀,两药配伍可以通过多种作用保护血管内皮和抑制细胞凋亡、抗炎、抗血栓以及保护血脑屏障[15]。天麻素也是我国传统中药材天麻中有效成分含量最高的单体,天麻素制剂对神经具有持久保护作用,目前临床辅助应用于脑血管病的治疗已得到我国专家的共识[16]。近期研究表明,天麻素可通过抑制活性氧(ROS)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)的表达发挥抗炎、抗氧化作用,进而减轻大鼠脑缺血损伤。此外,天麻素还可通过抑制激活的小胶质细胞中Notch途径和上调Sirt3减轻缺血缺氧性脑损伤,为激活的小胶质细胞介导的神经炎症提供有希望的治疗靶点[17]。
缺血性卒中所致终生残疾与神经元不可再生紧密相联,在受损的中枢神经系统中,轴突生长抑制配体的表达阻止了轴突的再生,进而抑制神经元再生[18]。小GTP酶RhoA是各种细胞外信号的分子开关,参与多种生物细胞功能,包括收缩、迁移、黏附、细胞周期调控和基因表达[19]。研究表明,RhoA在神经元发育和再生中作为关键的抑制信号通路因子参与肌动蛋白微丝重排[20]。丝氨酸/苏氨酸蛋白激酶ROCK可作为 RhoA下游效应分子介导对Ca2+的敏感度[21]。ROCK-2是存在于大脑、心脏和血管中ROCK蛋白的一种亚型,有研究显示,ROCK-2可以促进肌球蛋白轻链的磷酸化,使突触前、后的细胞骨架蛋白解聚,抑制轴突生长,促进突触重构[22]。Nogo-A是一种存在于中枢神经系统的轴突再生抑制因子,能够抑制轴突的生长和阻止脑卒中后轴突的重建[23]。吴锋等前期研究表明,天麻素可下调缺血后局灶皮质Nogo-A,NgR高表达,改善脑缺血大鼠神经功能症状[24]。还有研究表明,Nogo-A的两个功能结构域Nogo-A-66和Nogo-A-Δ20共同激活RhoA,进而结合并激活神经细胞的效应器ROCK。在脑缺血大鼠中,Nogo-A、RhoA、ROCK-2蛋白的高表达会限制轴突再生性和神经元可塑性[25]。本实验天麻素组Nissl染色结果显示,天麻素具有神经元保护作用,抑制神经元凋亡,免疫组化和免疫印迹结果一致显示,天麻素可在一定程度上下调脑缺血大鼠额叶皮质中RhoA、ROCK-2蛋白的表达。
RhoA和ROCK-2 组成的一种重要细胞内信号转导通路--RhoA/ROCK-2信号通路,参与调节生长、发育、分化和迁移等多种细胞功能。近年来已有研究证实,在卒中、脑梗死等造成中枢神经系统损伤疾病的病理生理过程中均可见RhoA/ROCK-2信号通路被激活,并发挥重要作用[26]。已有实验证实,急性缺血性脑卒中会激活RhoA/ROCK信号通路,抑制内皮型一氧化氮氧合酶(eNOS)和肌球蛋白轻链磷酸酶的产生,诱发肌动蛋白细胞骨架动态重组,直接参与缺血性脑卒中所致的神经元损伤,在诱导神经元凋亡阶段发挥着重要作用[27]。近期研究证明,RhoA/ROCK-2信号通路不仅可以调节肌动蛋白微丝动力学,而且还通过参与spastin和p60-katanin调节微管蛋白动力学抑制轴突再生[28]。特异性抑制这一信号通路的药物可以为缺血性卒中的临床治疗提供有效的方案,也可以为血管研究提供药理学依据。本实验结果与上述研究结果具有一致性,提示控制RhoA/ROCK-2信号转导通路在缺血侧额叶皮质的过度激活可能是天麻素抑制脑缺血大鼠神经功能损伤的重要原因之一。
综上所述,天麻素可能是通过下调脑缺血大鼠额叶皮质中RhoA及ROCK-2蛋白的过度表达和抑制RhoA/ROCK-2信号转导通路的过度激活来促进脑缺血大鼠额叶皮质神经元修复再生,进而恢复额叶皮质的功能。然而既往研究表明,RhoA/ROCK-2信号通路的上游调控因子NgR1、Nogo-A可以调节RhoA、ROCK-2的表达[24,29]。所以对于天麻素调控RhoA、ROCK-2表达的直接效应和间接效应关系还需进一步研究。

