NLRC3在宫颈CIN病变中表达及临床价值
张建海 王巍 王前 许佳伦 高娜
宫颈癌在女性恶性肿瘤中发病率较高,据2019年全国癌症报告,宫颈癌发病约占6.25%,病死率约占3.96%,相较于卵巢癌、子宫内膜癌等均更高,分别位于第6 位与第8 位;并且宫颈癌发病呈现出年轻化趋势,严重威胁着女性健康。宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)为宫颈癌前病变,高级别鳞状上皮内病变(highgrade squamous intraepithelial lesion,HISL)发生可加速宫颈癌癌前病变进程,使宫颈癌发病风险明显增加[1-2]。故而,通过早期诊断宫颈CIN 病变,有效阻断宫颈病变,并提高宫颈癌筛查效果具有重要临床意义。宫颈细胞学筛查常用于宫颈病变诊断,但是该方法假阴性率相对较高[3-4]。肿瘤微环境改变与肿瘤发生发展及转移联系紧密,免疫炎性微环境在宫颈癌发生中承担着重要作用[5]。模式识别受体(pattern recognition receptors,PRRs)为宿主固有免疫系统关键组成,胞浆PRRs 主要为NOD 样受体(NOD-like Receptors,NLRs)。NLRC3属于NLR 家族,可参与调控NF-κB 信号通路,进而对肿瘤发生发展产生影响。诸多研究[6-7]表明,NLRC3 与炎症反应存在关联,可对炎症信号通路进行负性调控,其功能失调与多种自身免疫性疾病及结肠癌、肺癌等肿瘤相关。近些年有研究[8]表明,NLRC3 可参与子宫内膜癌的发生发展。但目前,NLRC3 调控宫颈病变发生发展的机制尚未明晰。本研究分析NLRC3 表达与宫颈CIN病情的关系,探究其预测CIN 发生及诊断HISL 的效能,旨在为宫颈癌前病变筛查及诊疗提供支撑。报道如下。
1 资料和方法
1.1 一般资料
选取北京市大兴区中西医结合医院2021年3月至2022年2月宫颈CIN 患者96 例为观察组,均经细胞学以及病理检查明确诊断。年龄平均(30.26±3.52)岁,体质量指数(body mass index,BMI)平均(22.36±2.11)kg/m2,有生产史63 例。根据世界卫生组织(world health organization,WHO)CIN 分级标准[9]进行划分,CIN1(35 例):轻度非典型增生,细胞异型程度较轻,排列整齐性较差,但仍有极性,异常增殖细胞范围仅局限于上皮层1/3;CIN2(42 例):中度非典型增生,异型程度明显,排列紊乱,异常增殖细胞范围延伸至上皮层下2/3;CIN3(19 例):重度非典型增生,异型程度显著,极性丧失,异常增殖细胞扩展范围近乎全层。CIN1归为低级别鳞状上皮内病变(LSIL),CIN2、CIN3 归为高级别鳞状上皮内病变(HSIL)。见图1。
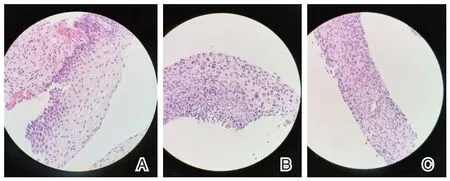
图1 宫颈上皮内瘤变组织学染色(HE,×20)Figure 1 Histological staining of cervical intraepithelial neoplasia(HE,×20)
纳入标准:①经细胞学、病理检查明确诊断为宫颈CIN[10];②年龄18 岁以上;③纳入本研究前未用药治疗。排除标准:①宫颈手术既往史;②合并恶性肿瘤;③伴内分泌、感染性疾病。于同期选取行宫颈检查正常者37 名为对照组。年龄平均(29.51±3.71)岁,BMI 平均(22.43±1.89)kg/m2,有生产史21 例。两组一般资料比较差异无统计学意义(P>0.05)。入试者均签署知情同意书。本研究经医院伦理协会审核批准。
1.2 方法
在入组时,两组对象均采集外周静脉血2 mL两份。应用日本TAKARA 人全血RNA 试剂盒提取全血RNA,采用微量核酸仪测定RNA 纯度与浓度。逆转录合成cDNA,置于-80℃冰箱待测。cDNA作模板进行qPCR 扩增,基于Genebank,检索并确定NLRC3 基因及目标扩增序列,应用Prism5.0 软件设计特异性引物,PCR 引物序列:NLRC3 F 为5′-CCCATACATGGATTCTCCACAA-3′,R 为5′-CCACTTCCAGATCCTACATCAAG-3′;GADPH F为5′-TGCACCACCAACTGCTTAGC-3′,R 为5′-GGCATGGACTGTGGTCATGAG-3′。RT-PCR 反应条件:在94℃环境下预变性60 s,95℃条件下变性5 s,接着,在60℃条件下复性30 s,而后,72℃条件下延伸1 min,循环共有35 个。观察溶解曲线,结果计算采用2-ΔΔct 法,测定NLRC3mRNA 相对表达量。
采用Western blot 实验测定NLRC3 蛋白相对表达量。加入RIPA 裂解液与苯基甲烷磺酰氟(1%PMSF)均质裂解液,匀浆离心,离心转速3 000 r/min,半径13.5 cm,离心15 min,取上清液提取蛋白。应用BCA 方法测定蛋白浓度,沸水浴15 min 使蛋白变性,适量蛋白样品与10%SDS-PAGD 凝胶混合,垂直电泳后完全分离,切下含NLRC3 与内参GAPDH 的胶段,移至PVDF 膜,置于5%脱脂奶粉溶液中浸泡,室温下封闭60 min。加入20 mL 一抗稀释液(1∶1 000)与20 mL GAPDH 一抗稀释液(1∶45 000),置于4℃环境下孵育过夜,洗膜完全后,加入二抗稀释液(1∶3 000),室温下孵育60 min;洗膜完全后,利用电化学发光液采用化学发光发测定NLRC3 蛋白相对表达水平。一抗稀释液购自Abcam 公司,GAPDH 购自武汉三鹰公司,二抗稀释液购自武汉塞维尔公司。
1.3 统计学方法
应用SPSS 22.0 分析数据资料。符合正态分布的计量资料以()表示,两组间比较行t 检验,多组间比较采用单因素ANOVA 方差分析;计数资料以n(%)表示,行χ2检验;采用Spearman 相关分析NLRC3 表达与宫颈CIN 患者病情程度的相关性;绘制受试者工作特征(ROC)曲线分析NLRC3mRNA、NLRC3 蛋白表达预测CIN 发生及诊断HISL 的价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组NLRC3 mRNA、NLRC3 蛋白相对表达量比较
观察组NLRC3 mRNA 相对表达量、NLRC3 蛋白相对表达量均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组NLRC3 mRNA、NLRC3蛋白相对表达量比较(±s)Table 1 Comparison of the relative expression levels of NLRC3 mRNA and NLRC3 protein between the two groups(±s)
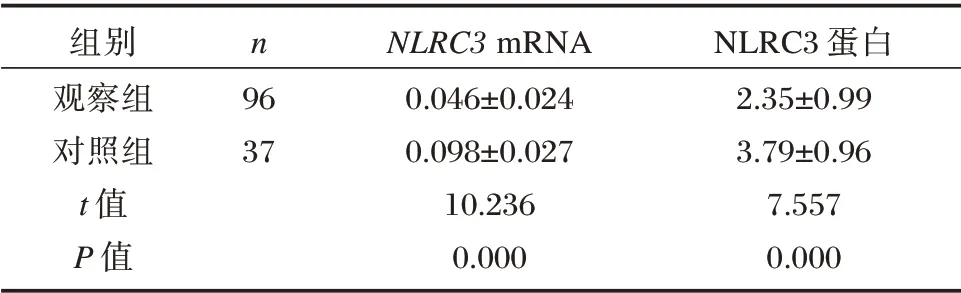
表1 两组NLRC3 mRNA、NLRC3蛋白相对表达量比较(±s)Table 1 Comparison of the relative expression levels of NLRC3 mRNA and NLRC3 protein between the two groups(±s)
组别观察组对照组t 值P 值n 96 37 NLRC3 mRNA 0.046±0.024 0.098±0.027 10.236 0.000 NLRC3 蛋白2.35±0.99 3.79±0.96 7.557 0.000
2.2 不同CIN 分级NLRC3 mRNA、NLRC3 蛋白相对表达量比较
不同CIN 分级NLRC3mRNA 相对表达量、NLRC3 蛋白相对表达量比较CIN1>CIN2>CIN3,差异有统计学意义(P<0.05)。见表2。
表2 不同CIN 分级NLRC3 mRNA、NLRC3 蛋白相对表达量比较(±s)Table 2 Comparison of relative expression levels of NLRC3 mRNA and NLRC3 protein in different CIN grades(±s)

表2 不同CIN 分级NLRC3 mRNA、NLRC3 蛋白相对表达量比较(±s)Table 2 Comparison of relative expression levels of NLRC3 mRNA and NLRC3 protein in different CIN grades(±s)
注:与CIN1 比较,aP<0.05,与CIN2 比较,bP<0.05。
CIN 分级CIN1 CIN2 CIN3 F 值P 值n 35 42 19 NLRC3 mRNA 0.071±0.017 0.037±0.013a 0.019±0.005ab 105.799 0.000 NLRC3 蛋白3.37±0.51 2.16±0.38a 0.91±0.25ab 226.163 0.000
2.3 NLRC3 表达与CIN 病情程度的相关性
Spearman 相关性分析显示,NLRC3mRNA 相对表达量与CIN 分级呈显著负相关(r=-0.863,P=0.000)、NLRC3 蛋白相对表达量与CIN 分级呈显著负相关(r=-0.894,P=0.000)。
2.4 NLRC3 表达预测CIN 发生及诊断HISL 的价值
ROC 曲线分析NLRC3mRNA、NLRC3 蛋白的AUC 分别为0.916、0.832,均有较高预测价值。见表3、图2。

图2 NLRC3 mRNA、NLRC3蛋白预测CIN发生的ROC曲线Figure 2 ROC curve of NLRC3 mRNA and NLRC3 protein predicting the occurrence of CIN

表3 NLRC3 mRNA、NLRC3 蛋白预测CIN 发生的ROC 分析结果Table 3 ROC analysis results of NLRC3 mRNA and NLRC3 protein predicting the occurrence of CIN
建立ROC 曲线分析NLRC3mRNA、NLRC3 蛋白诊断HISL 的价值:NLRC3mRNA、NLRC3 蛋白的AUC 分别为0.684、0.762,均有一定预测价值。见表4、图3。

图3 NLRC3 mRNA、NLRC3 蛋白预测HISL 的ROC 曲线Figure 3 NLRC3 mRNA and NLRC3 protein predicted ROC curves of HISL

表4 NLRC3 mRNA、NLRC3 蛋白预测HISL 的ROC分析结果Table 4 ROC analysis results of NLRC3 mRNA and NLRC3 protein predicting HISL
3 讨论
宫颈柱状上皮在各类不同高危因素诱导下发生早期病变,可使宫颈癌前病变发生风险明显上升。人乳头瘤病毒(human papilloma virus,HPV)16/18 高危亚型感染,可促使癌基因异常激活,宫颈柱状上皮细胞分化障碍风险显著增加,更容易诱发宫颈原位癌[11]。对宫颈病变进行早期筛查,可为临床实施宫颈部分切除或锥形切除等方案提供指导与参考,从而有效阻断宫颈CIN 逐渐发展至宫颈癌的演变过程。临床上常采用宫颈细胞学进行常规筛查,但是该筛查方式存在一定主观差异,并且对于部分宫颈病变位置较深者,部分研究报道筛查灵敏度较低,低于70%,而漏诊率较高[12]。单纯HPV 病毒分型应用于宫颈病变筛查效果确切,然而在宫颈高级别上皮瘤变诊断上阳性符合率较低,部分可因药物使用而导致HPV 假阴性[13]。
PRRs 可激活相关炎症通路,促使机体启动防御机制。NLRs 为其主要成员之一,共有C 末端、中央NOD 与N 末端三个特征结构域,在炎症反应以及信号传导级联反应中承担着重要作用,可通过抗炎性与促炎性调节炎症反应。NLRC3 位于第16 号染色体,为胞内模式识别受体,具有高度保守显著特征。NLRC3 中央、C 末端结构域具有富含亮氨酸的重复序列,且有由6-α 螺旋束构成的CARD 域。目前,愈多研究[14-15]表明炎症反应与肿瘤发生发展联系密切,异常炎症反应或为肿瘤新生的重要标志或肿瘤主要特征。肿瘤形成早期,炎症微环境能够促使多种信号通路激活,从而驱动癌前病变进展与恶变损伤;渐而至晚期,癌细胞获得保卫机制,可从免疫监测下逃脱并避免清除。有研究[16]表明,NLRC3 参与了炎症反应过程,可负性调控炎症信号通路。NLRC3 可与ASC、caspase-5 等炎性因子在直接作用相互结合,对经典以及非经典NF-κB 信号通路进行调控,可影响肿瘤发生发展过程[17]。有研究[18]发现,NLRC3 在结肠癌中表达水平较正常组织明显降低,NLRC3是PI3K-AKT-mTOR 信号通路的抑制性感受器,可对该通路活化产生抑制作用,降低结肠癌发生风险。本研究结果与上述研究具有相似性。NLRC3或参与宫颈CIN 发生发展过程,NLRC3 低表达示CIN 病理分级差,NLRC3 可能成为预测CIN 发生以及诊断HISL 的指标。本研究进一步采用ROC曲线分析NLRC3 表达的价值发现,NLRC3mRNA、NLRC3 蛋白在预测CIN 发生及诊断HISL上均有较高价值,灵敏度较高,但特异度一般。可与临床宫颈细胞学检查、HPV 病毒分型等方式联合应用,以提高宫颈CIN 早期筛查效果。
综上,NLRC3 在宫颈CIN 病变中表达水平明显降低,不同CIN 分级NLRC3 表达水平存在差异,NLRC3 表达随着CIN 分级升高而逐渐下降,二者呈显著负相关关系。并且,NLRC3 表达在预测CIN 发生及辅助诊断HISL 上具有较高价值,临床或可联合常规筛查方式,以提高宫颈CIN 早期筛查效果,从而为临床诊疗提供支持,降低宫颈癌发生率。本研究也存有样本量偏小局限,且未对NLRC3 免疫组化检测结果展开研究,今后有待进一步丰富、深入研究内容。

