趋化因子CXCL7通过血管形成途径促进结直肠癌增殖、迁移及侵袭的机制研究
程刚 李东鹏 张华鹏 刘华 孙峰 梁海 李龙海
结直肠癌(colorectal cancer,CRC)是全球消化系统最常见的癌症之一,发病率和死亡率居前列[1]。2015年中国的一项调查报告显示,CRC 患者和死亡人数分别为37.63 万人和19.1 万人,其次是胃癌、肝癌和食道癌[2]。目前,CRC 的发病机制尚未完全阐明,主流观点认为与基因或表观遗传不稳定、饮食习惯、接触化学致癌物质、肿瘤血管生成等因素有关[3]。CXCL7 是一种中性粒细胞激活趋化因子,主要来源于外周血小板,其通常被认为与调节糖酵解、有丝分裂和前列腺素合成等有关。近年来国外研究报道了CXCL7 与CRC 患者预后相关,可作为CRC 的诊断生物标志物[4-5],然而关于CXCL7 在CRC 的发生与发展中的作用机制却鲜有研究。本研究通过一系列实验来评估分泌性趋化因子对CRC 肿瘤微环境的影响,探究趋化因子CXCL7 对CRC 细胞增殖、转移及侵袭的影响与血管生成的关系,旨在阐明CXCL7 促进CRC发展的分子机制。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞与试剂
人CRC 细胞系SW620(美国ATCC 公司);NCM460 正常细胞株(美国ATCC 公司);慢病毒载体LV5(EF-1aF/GFP&Puro)(苏州吉玛基因科技有限公司);胎牛血清(批号1658396,Hyclone 公司);人脐静脉内皮细胞(批号HUVEC001,澳赛尔斯生物技术有限公司);Transwell 小室(康宁公司);Matrigel 胶(美国BD 公司);PBS(批号20140918,北京索莱宝科技有限公司);细胞周期测定试剂盒(美国BD 公司);胰蛋白酶(北京索莱宝科技有限公司);凋亡测定试剂盒(Beyotime 公司);ECL 试剂盒(美国Millipore 公司);ELISA 试剂盒(武汉赛培生物科技有限公司)
1.1.2 实验仪器与设备
酶标仪(VICTOR X5,美国Perkinelmer 公司);BX53MRF-S 显微镜(日本Olympus 公司);垂直电泳仪(北京六一生物科技有限公司);CO2培养箱(型号MIR-162-PC/MIR-262-PC,日本松下公司);流式细胞仪(美国贝克曼公司)
1.2 实验方法
1.2.1 细胞培养
取对数期生长的CRC 细胞在培养基中进行传代培养,并添加10%胎牛血清、100 μg/mL 的链霉素100 μL。所有细胞均置于饱和湿度、37℃的5%CO2培养箱中孵育。
1.2.2 CXCL7 稳转株的构建
通过qPCR 及ELISA 法检测CRC 细胞株的表达情况,挑选出高低表达细胞株,对高表达细胞株进行敲降(Knock down),低表达细胞株行过表达(Over expression)处理。克隆位点:NotI BamHI,借助慢病毒载体转染细胞株构建稳定过表达以及敲降细胞株。
1.2.3 CXCL7 对CRC 细胞增殖能力的影响
使用CCK-8、EdU 染色和平板克隆形成实验测定CXCL7 对CRC 细胞增殖能力的影响。
1.2.4 CXCL7 对CRC 细胞周期和凋亡作用
收集CXCL7 过表达及敲降的稳转株,PBS 洗涤,75%乙醇固定后,PBS 继续漂洗1~2 次,使用细胞周期测定试剂盒,流式细胞仪测定各管细胞周期分布情况。同样使用不含ETDA 的胰蛋白酶消化处理细胞,经固定与漂洗后,使用凋亡测定试剂盒,流式细胞仪测定细胞凋亡情况。
1.2.5 Transwell 肿瘤细胞侵袭实验
Transwell 小室上层加入CXCL7+NC 组细胞,下层加入血清培养液,中间加入胶。4%多聚甲醛固定10 min,1%结晶紫染色30 mim,镜下观察并拍照,100 倍光镜下随机选取5 个视野进行计数,平均值作为计算结果并进行比较。
1.2.6 趋化因子CXCL7 对脐静脉内皮细胞血管形成实验
96 孔板放置于-20℃预冷,每孔以50 μL Matrigel 胶包被,置于37℃中孵育30 min,使胶凝固;胰酶消化对数生长期的脐静脉内皮细胞,用人LoVo 细胞培养上清液重悬后计数,细胞接种于Matrigel 胶包被的96 孔板,每孔接种100 μL 中细胞数4 000 个。培养板置于细胞培养箱中培养,6 h 后加入Calcein-AM/PBS 溶液,37℃避光孵育30 min,PBS 洗涤2 次,荧光显微镜下观察并拍照计数管腔形成数目。
1.2.7 血管内皮生长因子(VEGF)、血管内皮生长因子受体(VEGF-R)表达水平测定
ELISA 试剂盒测量培养上清VEGF 水平,Western blot 检测血管内皮生长因子受体(VEGF-R)表达水平。
1.3 统计学方法
采用SPSS 17.0 统计学软件进行统计学处理,计量资料采用()表示,多组间比较采用单因素方差分析,两组间比较采用SNK-q检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组不同时间点吸光度值比较
48、72 h 各组吸光度比较:CXCL7 干扰组>NC 组>空白对照组,差异有统计学意义(P<0.05)。见表1。
表1 各组不同时间点吸光度值比较(±s)Table 1 Comparison of cell proliferation rates in each group at each time point(±s)

表1 各组不同时间点吸光度值比较(±s)Table 1 Comparison of cell proliferation rates in each group at each time point(±s)
注:与空白对照组比较,aP<0.05;与NC 组比较,bP<0.05。
72 h 1.41±0.12ab 1.13±0.11a 1.01±0.13 17.475<0.001组别CXCL7 干扰组NC 组空白对照组F 值P 值n6 6 6 0 h 0.25±0.02 0.24±0.01 0.25±0.01 1.000 0.391 24 h 0.34±0.02 0.32±0.02 0.31±0.03 2.471 0.118 48 h 0.82±0.10ab 0.69±0.08a 0.62±0.09 7.567 0.005
2.2 Transwell 细胞迁移实验
迁移细胞数比较:CXCL7 干扰组(1021.14±106.55)个>空白对照组(348.36±48.64)个>NC 组(331.98±46.81)个,差异有统计学意义(P<0.05)。见图1。

图1 各组Transwell 细胞迁移实验结果(1%结晶紫染色,×100)Figure 1 Transwell cell migration test results in each group(1% crystal violet stain,×100)
2.3 细胞侵袭实验
侵袭进入下室的细胞数比较:CXCL7 干扰组(103.21±15.33)个>空白对照组(28.54±8.17 个>NC组(24.65±8.36)个,差异有统计学意义(P<0.05)。
2.4 脐静脉内皮细胞血管形成实验
处理CRC 细胞6 h 后,结果显示空白对照组和NC 组仅有少量小管形成,而CXCL7 干扰组却形成了大量网状结构的小管。管腔形成数目:CXCL7 干扰组>NC 组>空白对照组,差异有统计学意义(P<0.05)。见表2、图2。
表2 各组管腔形成数目比较(±s)Table 2 Comparison of the number of formed lumen in each group(±s)
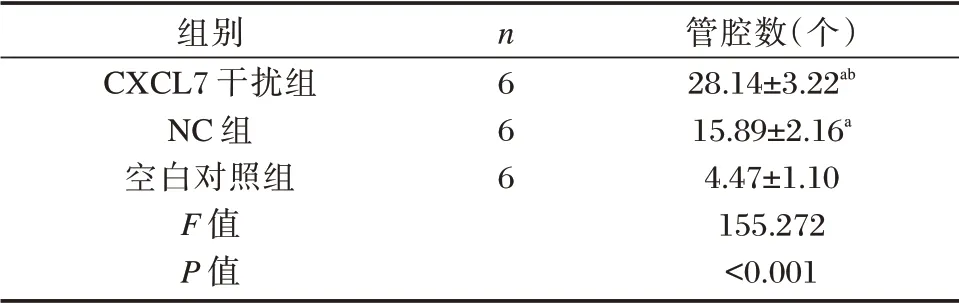
表2 各组管腔形成数目比较(±s)Table 2 Comparison of the number of formed lumen in each group(±s)
注:与空白对照组比较,aP<0.05;与NC 组比较,bP<0.05。
组别CXCL7 干扰组NC 组空白对照组F 值P 值n6 6 6管腔数(个)28.14±3.22ab 15.89±2.16a 4.47±1.10 155.272<0.001
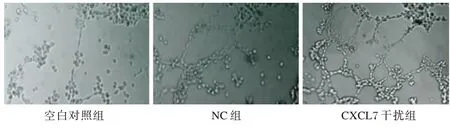
图2 各组脐静脉内皮细胞血管形成实验结果Figure 2 Experimental results of umbilical vein endothelial cells angiogenesis in each group
2.5 各组VEGF 水平及VEGF-R 阳性表达率比较
VEGF 水平及VEGF-R 阳性表达率:CXCL7 干扰组>NC 组,差异有统计学意义(P<0.05)。见表3。
表3 各组VEGF 水平及VEGF-R 阳性表达率比较(±s)Table 3 Comparison of VEGF levels and VEGF-R positive expression rates in each group(±s)

表3 各组VEGF 水平及VEGF-R 阳性表达率比较(±s)Table 3 Comparison of VEGF levels and VEGF-R positive expression rates in each group(±s)
组别CXCL7 干扰组NC 组t/χ2值P 值VEGF(pg/mL)576.25±84.63 357.47±28.34 15.504<0.001 VEGF-R 阳性表达率(%)90.0(36/40)67.5(27/40)6.050 0.014
3 讨论
近年来国内外大量研究发现,一些趋化因子在肿瘤细胞的增殖、迁移、侵袭以及血管形成过程中发挥重要作用[6-7]。趋化因子是一种8~12 kDa的分泌蛋白,可以调节白细胞的迁移,并参与炎症或伤口组织的修复等生理和病理过程。根据N 末端附近保守半胱氨酸的位置,这些小蛋白可分为CXC-、CX3C-、CC- 和XCL 亚组趋化因子[8-9]。CXCL7 属于ELR+CXC 趋化因子,其功能与其受体CXCR2 结合,并通过将中性粒细胞聚集到血管损伤部位,影响机体免疫反应[10]。目前,CXCL7 已被证明是乳腺癌、肺癌等多种癌症中重要的肿瘤微环境调节剂,也是癌症诊断中的潜在生物标志物[11]。但关于CXCL7 在CRC 发生与发展中的作用机制研究较为少见。本研究拟在前期工作基础上,运用分子生物学手段及动物实验技术系统研究CXCL7 对结直肠癌肿瘤微环境的影响,以及对结直肠癌细胞增殖、转移及侵袭的影响,阐明CXCL7 促进结直肠癌发展的分子机制。本研究有望在趋化因子调节水平为CRC 的诊断及防治提供新的视角和理论依据,并为CRC 的靶向治疗和预后提供重要指导。
本研究发现,在细胞增殖实验中,细胞培养48 h后,CXCL7 干扰组吸光度明显高于NC 组与空白对照组,细胞增殖作用明显增强,Transwell 实验中CXCL7 干扰组迁移与侵袭细胞数均多于NC 组与空白对照组,说明CXCL7 具有协助细胞增殖、迁移与侵袭的作用。血管生成是一个重要的生理过程,在肿瘤的增殖、侵袭和转移中也起着关键作用。血管生成为肿瘤的发展提供了营养支持,并促进肿瘤的持续生长。近年来相关文献报道[12],血管生成在CRC 复发和转移中起重要作用,许多蛋白质和信号分子与CRC 细胞中的血管生成有关,包括VEGF 和趋化因子。VEGF 在CRC 肿瘤中高表达并与不良预后相关。既往研究专注于CRC 患者血清中的CXCL7,及其在CRC 预后中的潜在应用,然而,CXCL7 和血管生成之间的关系鲜为研究。近年来,一些研究揭示了趋化因子在调节血管生成中的作用,如CCL19 通过下调CRC 细胞中VEGF-A的表达来抑制血管生成的能力[13]。因此,可将此类研究作为研究CXCL7 在CRC 患者血管生成中作用的基础进行参考。本研究结果说明趋化因子CXCL7 可增强小管形成能力,促进肿瘤血管形成。此外,通过选择VEGF 作为血管生成的标志物,发现CXCL7可增强CRC 细胞中VEGF 的表达。Du 等[14]报道,CXCL7通过激活PI3K/AKT/mTOR 信号通路与肿瘤生长、侵袭、迁移和血管生成有关。AKT 信号通路存在于人的所有细胞中,参与细胞生长、凋亡、迁移等多种代谢过程[15]。CXCL7 还可以通过与肿瘤血管生成相关的Ras/Raf/丝裂原活化蛋白激酶(MAPK)信号通路发挥其作用。CXCL7 可加速肿瘤转移通过调节VEGF-R 在CRC 中的表达。因此,CXCL7 可能是通过激活AKT 等信号通路参与CRC 的发生与发展。综上所述,趋化因子CXCL7 可调控肿瘤微环境,促进肿瘤血管形成,进而协助结直肠癌细胞的增殖、转移和侵袭。本研究下一阶段的研究任务主要是通过动物实验探究CXCL7 对裸鼠CRC 细胞成瘤能力的影响。

