模拟根系分泌物输入对高寒退化草地土壤微生物残体的影响
邓先智,类延宝,沈 杰,李 杨,李露航,包寒阳,扎琼巴,Plenkovic ′  ̄Moraj 孙 庚,*
1中国-克罗地亚生物多样性和生态系统服务“一带一路”联合实验室,中国科学院山地生态恢复与生物资源利用重点实验室,生态恢复与生物多样性保育四川省重点实验室,中国科学院成都生物研究所,成都 610041 2 中国科学院大学,北京 101408 3 西南民族大学青藏高原研究院,成都 610041 4 扎琼仓生态文化交流中心,若尔盖 747205 5 克罗地亚萨格勒布大学理学院生物系,萨格勒布 10000
青藏高原作为我国重要的生态安全屏障区,具有水源涵养、土壤保持和生物多样性保护等核心功能[1],但其脆弱的生态环境对气候变化和人类活动干扰极为敏感[2—3]。近年来,高寒草地退化面积每年增加5%—10%[4],退化草地面积已达到2920万hm2,占青藏高原草地总面积的38.8%[5]。土壤是陆地生态系统最大的碳贮蓄库[6—7],退化导致草地生产力下降[8]、土壤养分流失,碳储量急剧下降[9],进而严重影响牧区的经济生活和草地生态系统的健康发展。最近研究发现,退化草地表现出巨大的固碳潜力[10],可通过促进退化草地的恢复来提升土壤固碳效应[11],这为我国实现“双碳”目标提供了新的途径。
土壤有机碳的来源与组成十分复杂[12],目前关于土壤有机碳的形成过程逐渐从过去的腐殖质理论转变为关注微生物的转化与调控作用[13—15]。在碳循环过程中,土壤微生物具有双重生态效应,不仅可通过分解作用向大气中释放CO2,还可利用自身合成代谢将外源碳转化成以微生物残体的形式累积在土壤中[16—19]。生物标志物氨基糖是微生物细胞壁的重要成分,在微生物死亡后仍然可以在环境中保存很长时间,因此土壤中长期积累的氨基糖主要来自于微生物残体[20]。由于土壤中胞壁酸(MurA)只来源于细菌,而氨基葡萄糖(GluN)主要来自真菌,因此可用GluN/MurA来评价真菌和细菌残体在土壤有机质形成过程中的相对贡献[21]。随着生物标志物研究方法的发展,越来越多的研究显示微生物残体是土壤有机碳的重要组成部分[22—27],这对有机碳的长期固持和积累具有重要意义。
植物根系分泌物作为植物-土壤-微生物“交流”的媒介[28],可通过根系分泌物浓度的变化向根际微生态系统发出反馈信号,调控物质的迁移和转化[29—30]、影响微生物[31]和根系生长[32]以及土壤酶活性的变化[33—34]。有研究发现,根系分泌物的浓度和种类受植物生长时期、生长环境和植物种类的影响[35—36];大多数植物的根系分泌物在生长期分泌量较多[37—39],并且不同植物种类之间组分差异较大[40]。另外,当土壤氮素较低时,根系分泌物会刺激土壤有机质分解合成额外的氮[41—42]。植物根系分泌物的C/N通常要比根际微生物的C/N高,这可能造成根际微生物与植物根系之间对环境有效氮素的激烈竞争,使得根际成为碳过多而有效氮获取受限制的区域[43—44]。除此之外,Yang等[45]通过胞外酶化学计量比证据发现,草地恢复过程中微生物活动由磷受限向氮受限转变。因此,根系分泌物氮或碳氮比可能是驱动根际微生物群落组成和活性的重要调控因子,直接影响根际环境养分代谢等过程[46],进而影响退化草地微生物残体碳的形成。
目前关于微生物残体对根系分泌物输入响应的直接试验证据几乎还没有报道,故本研究以高寒极度退化草地土壤为研究对象,通过模拟根系分泌物输入和利用氨基糖生物标志物的方法,来探讨不同氮浓度和多样性的根系分泌物对退化草地微生物残体的影响,以期为根系分泌物调控下的碳循环研究提供理论依据,同时也为高寒退化草地的有效恢复及土壤固碳增汇提供实践指导。
1 材料与方法
1.1 供试土壤采集
本研究所用土壤为极度退化草地土壤,其物理结构和生态功能均受到严重破坏,便于分析根系分泌物输入对微生物残体的影响。采样地点位于四川省若尔盖麦溪乡境内(33°56′—33°58′ N,102°11′—102°18′ E),平均海拔3430 m,属典型高原寒温带湿润季风气候。年均气温1.3℃,年降水量615 mm,年蒸发量1352.4 mm,无绝对无霜期[47];土壤类型原为高寒草甸土,退化为沙化土;样地植被稀疏,主要的优势物种有沙生苔草(Carexspp)、赖草(Leymussecalinus(Georgi) Tzvel.)等沙生植物。随机布置5个10 m×10 m的样方,沿样方对角线用内径为3.5 cm的土钻取0—20 cm表层土3钻,每个样方5个重复,将所取土样混匀成一个混合样品。用冰袋保存带回实验室,过2 mm细筛处理备用。试验土壤的基本理化性质为全碳2.1 g/kg,全氮0.25 g/kg,全磷0.4 g/kg,pH 7.8,容重1.62 g/cm3。
1.2 试验设计
本试验参照Steinauer等模拟根系分泌物浓度及多样性的配制方法[48],保持混合物中碳浓度(0.5 gC/kg)不变,设置2个不同氮含量的处理组(低氮-LN:0.1 gN/kg;高氮-HN:0.2 gN/kg),各组中分别设置添加2个不同多样性根系分泌物的子处理(低多样性-LD,添加物:葡萄糖、乙酸、甘氨酸;高多样性-HD,添加物:葡萄糖、蔗糖、果糖、乙酸、乳酸、琥珀酸、丙氨酸、甘氨酸和酪氨酸)。共5个处理,分别表示为CK(不添加外源分泌物)、LN+LD、LN+HD、HN+LD及HN+HD,各处理均含3次重复。试验中,配制低氮(C/N为5∶1)及高氮(C/N为5∶2)添加液时,按照表1各化合物(3种和9种)中碳原子个数占混合物的比例来确定各化合物的添加量。

表1 配制不同氮浓度和多样性根系分泌物各组分碳原子个数占混合物的比例
试验流程简述如下:准确称取400 g供试土壤于500 mL广口瓶中,随后置25 ℃恒温培养箱内避光培养15 d;培养期间,每24 h利用注射器(10 mL)缓慢、均匀加入7.5 mL的模拟根系分泌物溶液(预实验表明,每日添加7.5 mL蒸馏水可维持土壤含水量在田间最大持水量的75%左右),CK处理加入等量的蒸馏水。
1.3 土壤总碳氮、微生物量碳氮、酶活性及氨基糖的测定
土壤总碳、氮测定[49]:将风干土样利用研钵粉粹、混匀,过100目筛,准确称80 mg粉粹土壤样品,用锡纸包裹,使样品不外漏,然后将样品置于105 ℃烘箱中2 h,将处理好的样品置于元素分析仪(Elementar Vario EL Ⅲ, 德国)测定。
土壤微生物量碳(MBC)及氮(MBN)用氯仿熏蒸硫酸钾浸提法测定[50]。熏蒸:取培养后的鲜土25 g置于培养皿中,将其放入真空干燥箱中,并放置一个盛有50 mL去乙醇氯仿的烧杯(100 mL)(烧杯中放有玻璃球防止抽真空时瀑沸)和一个盛有稀氢氧化钠溶液的小烧杯(吸收熏蒸期间释放出来的CO2);确定密封干燥器,之后用真空泵抽真空至氯仿沸腾5 min,关闭阀门,然后放入25 ℃培养箱中避光熏蒸24 h。浸提:将熏蒸后的土壤转移至250 mL锥形瓶中,加入80 mL 0.5mol K2SO4,震荡1 h(200 rev/min)后用定量滤纸过滤,收集滤液并冷冻保存。同时称取等量未熏蒸土壤,并用上述方法进行浸提。上机:熏蒸和未熏蒸土壤的提取液用TOC仪(Milti N/C 2100S)进行含量测定。土壤MBC、MBN含量(mg/kg)计算公式如下:
(1)
(2)
式中,ΔEC、ΔEN为熏蒸与未熏蒸土壤碳氮含量的差值;kC为MBC的浸提系数,为0.45;kN为MBN的浸提系数,为0.54。
土壤酶活性测定[51]:土壤酸性磷酸酶(AP)、β-N-乙酰葡糖胺糖苷酶(NAG)和β-葡萄糖苷酶(βG)活性采用多孔板荧光光度法测定;过氧化物酶(POD)活性采用多孔板分光光度法测定。
土壤氨基糖含量参照Indorf等的方法测定[52],具体步骤如下:称取冷冻干燥后的土壤样品1 g于10 mL水解瓶中,加入10 mL 6 mol/L的HCl溶液,密封后,置于高压灭菌锅中105 ℃水解8 h。冷却至室温后,加入100 μL 1 mg/mL内标肌醇溶液,振匀后过0.45 μm滤膜。滤液用旋转蒸发仪蒸干,残余物溶于20 mL去离子水后转移至聚四氟乙烯小瓶中,并用0.4 mol/L KOH溶液将pH调至中性(pH 6.6—6.8),然后以3000 rpm/min离心10 min去除沉淀。上清液转移至50 mL玻璃瓶中,冻干后,用3 mL无水甲醇溶解,离心10 min 使溶液中多余盐分沉淀。将上清液转移到5 mL衍生瓶中,在45 ℃下用N2吹干,再次加入1 mL去离子水并冷冻干燥(8 h以上)。向干燥后的样品中加入300 μL衍生试剂,加盖密封,在75—80 ℃水浴加热30 min,其间振荡 3—4次使反应均匀。冷却至室温后,加入1 mL乙酸酐,密封后,水浴加热20 min。冷却后,加入1.5 mL的二氯甲烷,涡旋使溶液混合均匀。过量衍生试剂的去除:首先,加入 1 mol/L HCl 溶液1 mL,涡旋震荡30 s后,静置后移除上层液体;随后,用1 mL蒸馏水洗涤4次。去除过量衍生试剂后的样品在 45 ℃下吹N2干燥后,溶于400 μL的乙酸乙酯-正己烷(v/v=1∶1)中,通过气相色谱质谱联用仪(Agilent 7890A- 5975C,USA)对产物进行分离和检测。记录样品和标准品的保留时间,通过比较判断氨基糖衍生物的峰值,将纯化前向样品中加入的肌醇作为内标对氨基糖进行定量分析。相关计算方法如下[24]:
(3)
BRC=45×MurA
(4)
MRC=FRC+BRC
(5)
式中FRC为真菌残体碳(mg/kg);BRC为细菌残体碳(mg/kg);MRC为微生物残体碳(mg/kg);251.23为胞壁酸(MurA)的分子量;179.17为氨基葡萄糖(GluN)的分子量;9和45分别为对应的转换系数;
1.4 数据处理与统计分析
用单因素方差分析(One-way ANOVA)结合Turkey法检验模拟根系分泌物添加对退化草地土壤微生物残体的影响,并考察各处理间土壤碳氮、微生物生物量、酶活性的差异显著性(P=0.05)。利用线性回归分析土壤微生物残体与土壤碳氮、微生物生物量及酶活性等指标之间的关系。同时利用Pearson相关分析量化在根系分泌物添加下土壤碳氮、微生物生物量及酶活性之间的相关性。以上统计分析和作图均在R 4.1.2(ggplot2包、hrbrthemes包)完成。
2 结果与分析
2.1 不同根系分泌物添加处理中的土壤总碳氮以及微生物量碳氮
培养后,各处理土壤总碳氮及微生物量碳氮的结果如图1所示。可见,LN+LD、HN+LD处理的土壤总碳分别显著低于LN+HD、HN+HD处理,同时HN+HD处理显著低于LN+HD处理。而LN+LD、HN+LD处理的微生物量碳含量分别显著高于LN+HD、HN+HD处理,同时HN+LD、HN+HD处理分别显著高于LN+LD、LN+HD处理,表明高氮含量及低多样性的分泌物添加能有效促进土壤微生物的生长,并加速土壤碳库的分解;而土壤总氮和微生物量氮在LN和HN两组处理的组内及组间均无显著差异,仅HN+LD的土壤总氮显著高于LN+LD,HN+HD的微生物量氮显著高于LN+HD。
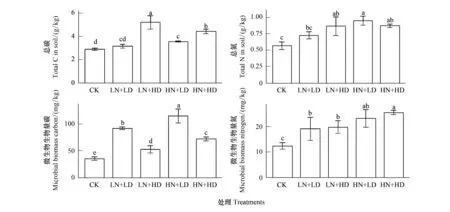
图1 不同根系分泌物添加对土壤总碳、总氮以及微生物生物量碳氮的影响Fig.1 Effects of different root exudates on soil total carbon, total nitrogen and microbial biomass carbon and nitrogen CK:对照;LN+LD:低氮浓度+低多样性;LN+HD:低氮浓度+高多样性;HN+LD:高氮浓度+低多样性;HN+HD:高氮浓度+高多样性;误差线为标准偏差(n=3),柱上方不同小写字母(a-e)表示不同处理间差异显著(P<0.05)
2.2 不同根系分泌物添加中的氨基糖和微生物残体碳
添加模拟根系分泌物各处理的微生物残体碳和真菌残体碳均显著高于CK,且LN+LD、HN+LD处理中的微生物残体碳和真菌残体碳含量分别显著高于LN+HD、HN+HD处理,同时在HN+LD处理显著高于LN+LD处理,这说明LD和HN处理可能有助于微生物残体的积累。同上比较下发现,细菌残体碳在LN+LD和HN+LD、LN+HD和HN+HD之间无显著差异,仅HN+LD处理高于HN+HD处理。此外,结合各添加处理中GluN/MurA比例,土壤真菌与细菌残体碳比例,表明退化草地微生物残体主要由真菌残体贡献,且不受根系分泌物添加影响(图2;表2)。
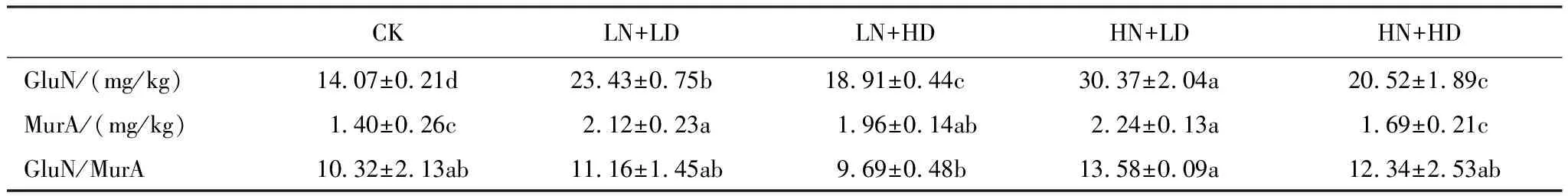
表2 根系分泌物添加下,土壤氨基葡糖糖、胞壁酸含量及其比例

图2 不同根系分泌物添加对微生物残体碳的影响Fig.2 Effects of different root exudates on microbial residues carbonCK:对照;LN+LD:低氮浓度+低多样性;LN+HD:低氮浓度+高多样性;HN+LD:高氮浓度+低多样性;HN+HD:高氮浓度+高多样性;误差线为标准偏差(n=3),柱上方不同小写字母(a-d)表示不同处理间差异显著(P<0.05)
2.3 根系分泌物添加对土壤酶活性的影响
添加模拟根系分泌物各处理的土壤酸性磷酸酶、β-葡萄糖苷酶、过氧化物酶活性均显著高于CK,而β-N-乙酰氨基葡萄糖苷酶活性显著低于CK。另外,添加分泌物各处理间酸性磷酸酶活性无显著差异;β-葡萄糖苷酶活性仅HN+LD处理显著高于HN+HD处理;β-N-乙酰氨基葡萄糖苷酶活性HN+LD处理显著高于其他添加处理;过氧化物酶活性仅HN+LD处理显著高于LN+LD处理,其他添加处理间无显著差异(图3)。

图3 不同根系分泌物添加对土壤酶活性的影响Fig.3 Effects of different root exudates on soil enzyme activityCK:对照;LN+LD:低氮浓度+低多样性;LN+HD:低氮浓度+高多样性;HN+LD:高氮浓度+低多样性;HN+HD:高氮浓度+高多样性;误差线为标准偏差(n=3),柱上方不同小写字母(a-d)表示不同处理间差异显著(P<0.05)
2.4 微生物残体碳与土壤C/N、MBC/MBN以及酶活性等的相关性
各土壤指标间的Pearson相关分析结果见表3。可知,土壤微生物量氮、酸性磷酸酶、过氧化物酶活性与土壤总氮含量呈显著正相关(P<0.05);微生物生物量碳与β-N-乙酰氨基葡萄糖苷酶活性呈显著负相关(P< 0.01);β-葡萄糖苷酶、过氧化物酶活性均与酸性磷酸酶呈现显著正相关关系(P<0.01);同时β-葡萄糖苷酶和过氧化物酶活性之间呈显著正相关(P<0.05)。
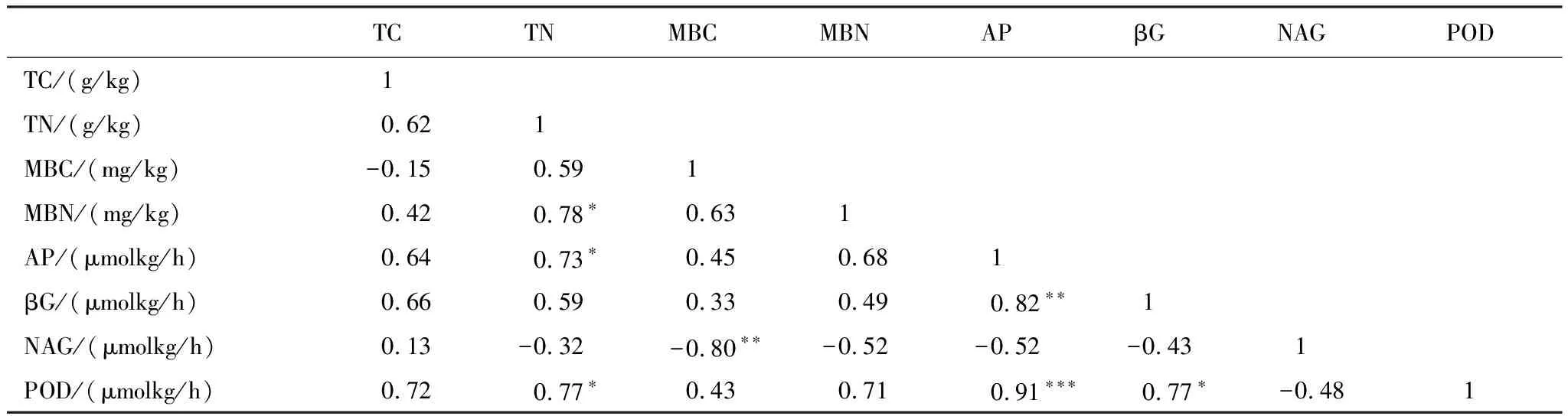
表3 根系分泌物添加下,土壤碳、氮以及酶活性等指标之间的相关性
土壤微生物量C/N及相关酶活性与微生物残体碳含量的线性回归分析结果如图4所示。可见,该退化草地土壤中的微生物残体碳含量与土壤C/N呈显著线性负相关 (P<0.01),与MBC/MBN (P<0.001)、酸性磷酸酶(P<0.05)、β-葡萄糖苷酶(P<0.001)、过氧化物酶活性(P<0.05)呈显著线性正相关,而与β-N-乙酰氨基葡萄糖苷酶活性无显著性关系(P>0.05)。
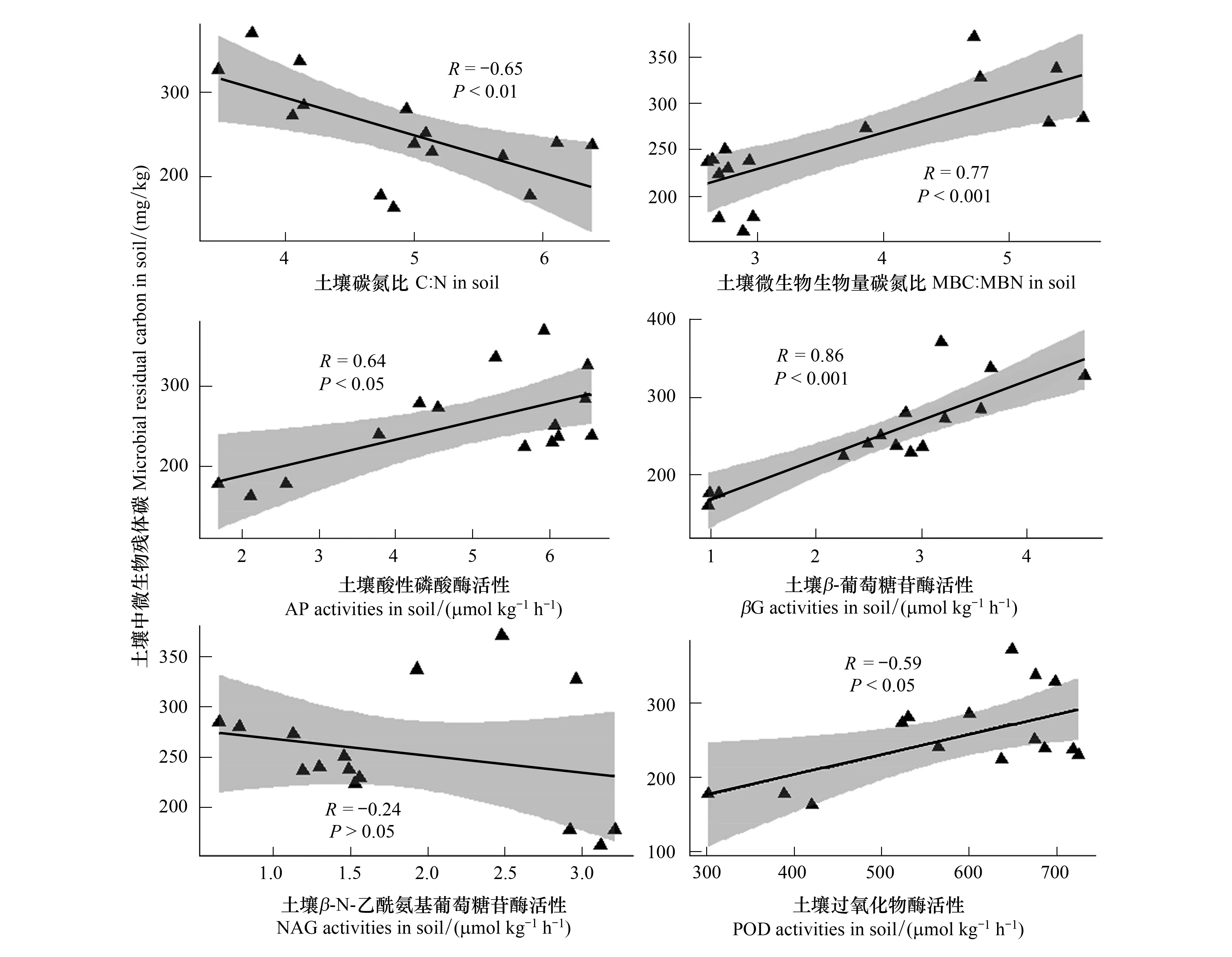
图4 微生物残体碳与土壤碳氮比、微生物生物量碳氮比以及土壤酶活性的回归分析(n=15)Fig.4 Regression analysis of microbial residual C to soil C/N ratio, microbial biomass C/N ratio and enzyme activities(n=15)
3 讨论
根系分泌物因富含碳氮物质,可促进土壤微生物的生长并提升其活性,深刻影响土壤有机质分解和养分转化过程[53—54]。土壤中微生物残体的变化取决于生成和分解两者之间的平衡,本研究探讨了模拟根系分泌物输入对高寒退化草地土壤微生物残体的影响。结果表明,根系分泌物的输入显著增加了土壤微生物残体碳含量,且受根系分泌物的氮浓度及多样性的影响显著。
3.1 根系分泌物通过影响土壤微生物来促进土壤微生物残体生成
本研究中,根系分泌物的输入同时提升了土壤微生物生物量碳氮和微生物残体碳含量。可能是由于外源有机质输入激活土壤微生物参与碳循环过程,促进微生物大量生长。土壤激发效应是微生物响应新鲜碳输入对土壤有机碳分解的变化,是全球碳循环的关键组成部分[55]。有研究表明,向土壤中添加有效的低分子底物(如葡萄糖和氨基酸) 可以促进激发效应,激活休眠的土壤微生物,增加土壤微生物量[56—57]。此外,微生物氮矿化假说认为:外源碳的添加为土壤微生物获取氮素提供能源,提高其氮矿化活性[58]。本研究中,在低根系生物量和植物凋落物输入的退化草地环境下,外源根系分泌物的输入可激活土壤微生物,增加土壤微生物残体碳的生成,进而提升土壤有机碳的存储量。
3.2 不同氮浓度和多样性的根系分泌物对土壤微生物残体的影响
本研究中,不同氮浓度和多样性的根系分泌物处理对土壤微生物有不同的影响,高氮的根系分泌物添加促进土壤微生物生长的效果更显著。与本研究结果相似,Chen等[59]研究也发现,蔗糖和氮添加显著加速有机质的矿化,但有机质矿化的速率由氮有效性控制,表明氮的有效性是影响土壤有机质分解的关键因子。Cui等[60]利用V-T模型发现,高纬度草地的微生物代谢主要受到氮限制,证实了退化草地中氮是影响微生物生长及活性的关键因素。因此,本研究中高氮根系分泌物的输入,有效缓解了高寒退化草地微生物代谢的氮限制,促进了微生物的生长。另外根系分泌物的多样性对微生物的代谢以及生长的作用也存在差异性。有研究发现,微生物对底物的利用存在偏好性[61]。比起其他碳源,微生物会优先利用葡萄糖这类低分子化合物[62]。Lehmann等[63]研究也发现,底物较低的多样性有利于分解者群落专门化,而较高的多样性会增加微生物利用这些底物的成本。因此,本研究中低多样性根系分泌物输入,减少了土壤微生物利用底物的成本,促进了退化草地土壤微生物残体积累。
3.3 根系分泌物通过刺激土壤酶活性来影响土壤微生物残体
土壤中酶介导的分解过程是控制全球养分循环的关键步骤[64]。本研究中,根系分泌物的输入,增加了土壤β-葡萄糖苷酶、土壤磷酸酶和过氧化物酶活性,而降低了β-N-乙酰氨基葡萄糖苷酶活性。土壤磷酸酶可以将土壤中的有机磷分解成易于利用的速效磷,缓解微生物代谢的磷限制[65]。土壤中β-葡萄糖苷酶是纤维素水解酶,可以将寡糖水解成单糖,而过氧化物酶可参与木质素等大分子的降解,这两者都可为土壤微生物提供可利用底物和能源[66],以提高微生物利用碳源的能力,这与Zhou等[67]的研究结果一致。因此,本研究中根系分泌物输入可能通过增加上述相关酶活性,将土壤中的大分子进行“剪切”,使其转化为可被微生物直接吸收利用的小分子[68],进而提高土壤“微生物碳泵”体内周转速率[69]。这种高速的细胞周转速率有利于土壤微生物残体的积累。土壤中的β-N-乙酰氨基葡萄糖苷酶可催化几丁质和肽聚糖的水解[70],这两种化合物是真菌和细菌残体的主要部分。本研究中根系分泌物的输入显著降低了β-N-乙酰氨基葡萄糖苷酶活性,从而减少了土壤微生物残体的分解。另一方面,作为含氮的化合物,几丁质和肽聚糖也可作为微生物的潜在有机氮源;而外源根系分泌物氮的添加,可能缓解了土壤环境的氮限制,进而降低了微生物对上述内源氮(几丁质和肽聚糖)的需求;最终使得β-N-乙酰氨基葡萄糖苷酶的活性下降,并提高了土壤微生物残体碳的含量。
4 结论
本研究基于“模拟根系分泌物输入”控制试验,发现根系分泌物输入可显著增加高寒退化草地土壤微生物残体含量,且以真菌残体为主,其中高氮和低多样性处理增加最明显。根系分泌物的输入可增加土壤β-葡萄糖苷酶、土壤磷酸酶和过氧化物酶活性,促进微生物的生长,而降低β-N-乙酰氨基葡萄糖苷酶活性,减少微生物残体的分解。这表明在未来退化草地恢复中,可充分利用模拟根系分泌物输入的土壤固碳策略,即通过提高土壤氮的有效性,促进微生物的生长,加快代谢周转,进一步提高微生物残体含量。

