2例新型冠状病毒肺炎病例的流行病学及基因特征分析
王 寅, 黄 瑶, 张 军, 李鑫娜, 周 乐, 朱维维, 杨庆贵, 徐 勤, 孔桂美
(1. 江苏省扬州市疾病预防控制中心, 江苏 扬州, 225002; 2. 江苏国际旅行卫生保健中心, 江苏 南京, 210000; 3. 扬州大学医学院, 江苏 扬州, 225009)
新型冠状病毒肺炎(简称新冠肺炎)是由新型冠状病毒(SARS-CoV-2)感染引起的一种急性呼吸系统新发传染病,主要临床表现为发热、咳嗽以及一些不太典型的肺外表现。新冠肺炎的大流行促使SARS-CoV-2不断发生进化和变异,对疫情防控造成了巨大的负面影响[1]。奥密克戎变异株于2021年11月在南非被首次发现[2], 此后该变异株迅速传播至全球数百个国家和地区,对人类的身心健康产生了严重影响[3-4]。江苏省扬州市于2022年1月首次报告新冠肺炎奥密克戎变异株感染病例,此后于当月又发现1例感染病例。本研究采用第3代纳米孔测序技术对2例境外输入新冠肺炎奥密克戎变异株感染患者进行全基因组基因测序,并进行流行病学溯源分析和实验室检测结果分析,旨在为SARS-CoV-2奥密克戎变异株感染的疫情防控及时提供数据支持和决策依据。
1 对象与方法
1.1 研究对象
将江苏省扬州市2022年1月5日和1月23日在中国传染病报告管理信息系统中报告的2例境外输入新冠肺炎确诊病例作为研究对象。
1.2 方法
1.2.1 调查方法: 按照《新型冠状病毒肺炎防控方案(第八版)》的要求对研究对象开展面对面流行病学调查,排查追踪其密切接触者,并对其集中隔离医学场所进行风险评估。
1.2.2 资料收集: 收集2例患者的流行病学调查资料及其在扬州市第三人民医院就诊的资料。
1.2.3 病例判定: 按照《新型冠状病毒肺炎诊疗方案(第八版)》的要求,结合扬州市新冠肺炎医疗救治组专家会诊结果判定病例。
1.2.4 实验室核酸及抗体检测: 按照《新型冠状病毒肺炎防控方案(第八版)》中《新型冠状病毒肺炎实验室检测技术指南》的要求,采用硕世核酸提取仪及核酸提取试剂盒提取病毒核酸,并采用ABI7500荧光定量PCR仪、江苏硕世生物科技有限公司和北京卓诚生物科技有限公司SARS-CoV-2检测试剂盒进行核酸检测,实验过程及结果判读严格按照试剂盒说明书要求进行。血清中SARS-CoV-2免疫球蛋白M(IgM)、免疫球蛋白G(IgG)抗体水平使用英诺特新型冠状病毒IgM/IgG抗体胶体金检测试剂和迈克生物公司全自动化学发光免疫分析仪i3000及其配套试剂进行检测。
1.2.5 测序文库构建和全基因组测序[5]: 参照北京微未来ULSEN超灵敏度新型冠状病毒全基因组捕获试剂盒说明书的要求对病毒全基因组进行扩增,采用Qubit3.0荧光定量仪对扩增产物进行定量,连接测序试剂盒(SQK-LSK109, Oxford Nanopore)用于制备测序文库。使用Oxford Nanopore MK1C纳米孔测序系统和Flow Cell芯片(Flow Cell Primming Kit,货号EXP-FLP002)以第3代纳米孔全基因组测序技术进行SARS-CoV-2全基因组测序。
1.2.6 序列拼接与分析: 使用杭州柏熠科技有限公司的SARS-CoV-2全基因组分析系统对第3代测序数据进行组装拼接,获得全基因组序列,并在线(https: //clades. nextstrain. org/)进行型别及变异位点分析。采用DNAstar Lasergene V7.0软件进行全基因组序列比对和同源性分析,参比序列来源于GISAID数据库不同型别变异株,使用PhyloSuiteV 1.2.2软件绘制系统发育树,进行5 000次bootstrap抽样,构建最大似然法系统发育树。
2 结 果
2.1 流行病学调查结果
2.1.1 基本信息: 2例新冠肺炎确诊病例的流行病学调查基本信息见表1。

表1 2例新冠肺炎确诊病例的流行病学调查基本信息
2.1.2 密切接触者判定和管理: 根据《新型冠状病毒肺炎防控方案(第八版)》密切接触者的判定原则,初步判定2个班次转运车(昆山至扬州酒店隔离点)的19名同车人员为密切接触者,均采取14 d集中隔离医学观察及7 d居家健康监测。其余人员均接受闭环管理或采取有效防护措施,故未纳入密切接触者人群,仅作为一般接触者开展健康监测和核酸检测。
2.2 实验室核酸检测结果
病例1 于2021年12月31日入境时双采口咽拭子和鼻咽拭子, SARS-CoV-2核酸检测结果为阴性, 2022年1月4日进行鼻咽拭子单采, SARS-CoV-2核酸检测结果为阳性。病例2于2022年1月18日入境时双采口咽拭子和鼻咽拭子, SARS-CoV-2核酸检测结果为阴性, 2022年1月22日进行鼻咽拭子单采, SARS-CoV-2核酸检测结果为阳性。2例患者鼻咽拭子单采的SARS-CoV-2核酸检测结果见表2。
2.3 血清抗体检测结果
2例患者SARS-CoV-2 IgM、IgG抗体的胶体金法检测结果均为阴性; 化学发光法抗体检测结果显示,病例1的IgG抗体为阳性[吸光度值与临界值比值(S/CO)>1为阳性,反之为阴性], IgM抗体为阴性,病例2的IgG、IgM抗体均为阴性。见表3。
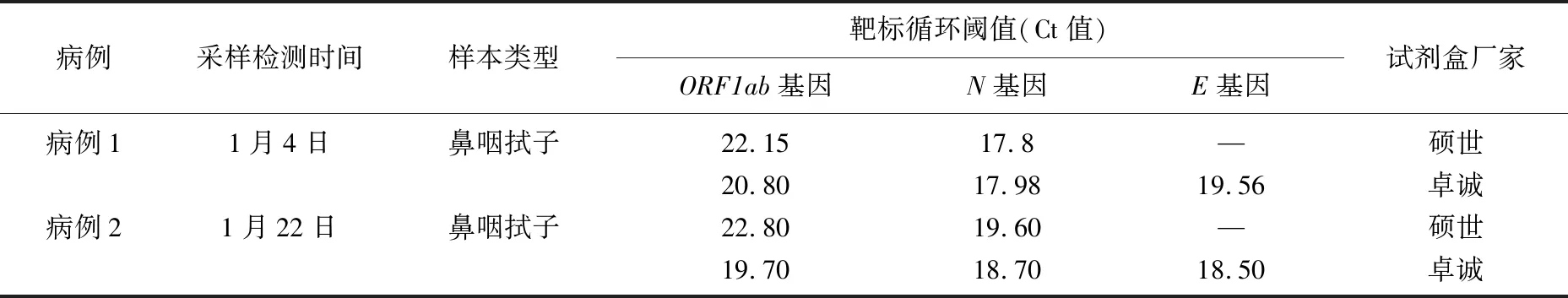
表2 2例新冠肺炎确诊病例SARS-CoV-2核酸检测结果

表3 2例新冠肺炎确诊病例血清SARS-CoV-2抗体检测结果
2.4 基因测序结果
2.4.1 基因组测序基本情况: 对病例1与病例2的标本进行第3代纳米孔基因组测序,基因组平均测序深度分别为3 701.33×与4 710.93×, 基因长度分别为29 873 bp与29 850 bp, 全基因组基因测序覆盖度分别为99.85%与99.83%, 与标准参考序列MN. 908 947.3比对,基因序列一致性均为99.62%, 氨基酸序列一致性分别为99.60%与99.31%, 2例标本基因序列一致性为99.83%, 氨基酸序列一致性为99.52%。
2.4.2 基因组变异位点结果分析: 将拼接后的基因序列上传至https: //clades. nextstrain. org/进行型别及变异位点分析,参照Pangolin分型法与Nextstrain分型法,病例1属于BA. 1.1与21K, 病例2 属于BA. 2.3与21L, 与标准参考序列MN. 908 947.3相比, 2组序列在S蛋白分别出现31、28个氨基酸位点突变,共享39个核苷酸变异位点,产生32个氨基酸突变位点。病例1的核苷酸突变位点、氨基酸突变位点分别为57、47个,病例2的核苷酸突变位点、氨基酸突变位点分别为68、52个,具体突变位点见表4。
2.4.3 系统进化树分析: 将测得的全基因组序列与从GISAID数据库下载的不同型别变异株参考序列共62条进行比对,构建系统发育树,发现不同型别毒株归属于不同进化分支。2例患者感染的SARS-CoV-2毒株均属于奥密克戎变异株,但属于不同亚变体,病例1属于BA. 1.1分支,与hCoV-19_USA_FLCDC-STMN2MXMA3HU_2021同源性最高,达到99.95%,病例2属于BA2.2.3分支,与hCoV-19_Finland_THL-202205846_2022、hCoV-19_Japan_PG-177427_2022、hCoV-19_England_NEWC-3B0D0F0_2022同源性最高,达到100.00%,见图1。
3 讨 论
截至2022年2月22日,江苏省共报告28例境外输入奥密克戎变异株所致新冠肺炎病例,其中19例为BA.1型(占67.86%),9例为BA.2型(占32.14%)。扬州市报告的第2例境外输入新冠肺炎奥密克戎变异株感染病例属于BA.2型分支(全省首例),而全省奥密克戎变异株分支型别的变化规律是由以BA.1型为主逐渐向BA.1型与BA.2型混合转变。
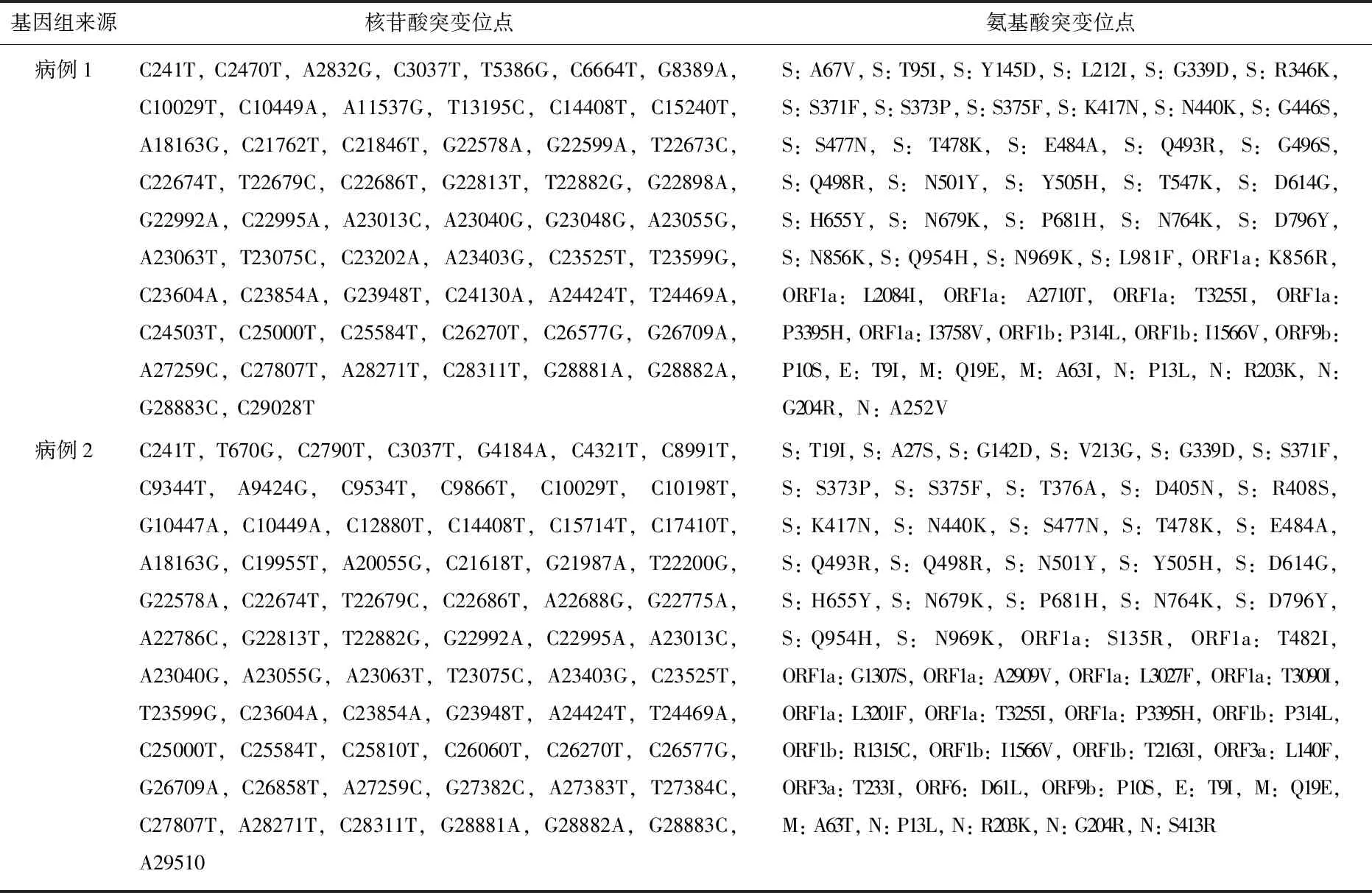
表4 病例1与病例2的基因组核苷酸突变位点、氨基酸突变位点

SARS-CoV-2奥密克戎变异株BA.1.1及BA.2.3高频出现于欧美国家,根据流行病学调查情况和第3代基因测序结果,本研究推断病例1在芬兰被感染的可能性较大,病例2在加纳或荷兰被感染的可能性较大(在此期间,上海市集中隔离点与扬州市集中隔离点14 d内均未有确诊病例,而其密切接触者经14 d集中隔离观察后亦未确诊,故判定其在隔离点及转运过程中被感染的可能性几乎不存在)。2例患者临床症状均较轻,仅有轻微的呼吸道症状,与目前SARS-CoV-2奥密克戎变异株感染病例的临床症状一致,即以轻微症状为主,重症很少,且无其他变异株感染引发的味觉或嗅觉丧失等新冠肺炎典型症状[6]。2例病例均采取严格的闭环管理措施,且所有转运人员佩戴N95口罩,后续未有相关病例检出。相关研究[4]证明, SARS-CoV-2奥密克戎变异株致病性不强、传染性极强,但严格闭环管理和规范佩戴口罩可有效预防新冠肺炎感染,且现行防护措施对奥密克戎变异株同样有效。
实验室核酸检测结果显示,2例境外输入奥密克戎变异株所致新冠肺炎病例的核酸检测Ct值较低,提示感染病毒载量较高[7]。本研究采用胶体金法和化学发光法进行抗体检测,其中胶体金法无需任何仪器设备,可在不同条件下直接检测并观察结果,但易受多种因素干扰且存在一定风险,而化学发光法则具有高通量、自动化、低风险、高灵敏度等优点[8]。胶体金法检测结果显示, 2例病例SARS-CoV-2 IgM、IgG抗体均为阴性; 化学发光法检测结果显示,病例1的IgM抗体为阴性, IgG抗体为阳性,病例2的IgM、IgG抗体均为阴性。病例1的IgG抗体的胶体金法检测结果与化学发光法检测结果不一致,结合此前流行病学调查结果(病例1感染前接种过辉瑞新冠肺炎疫苗2针次),推测其IgG抗体因免疫应答反应而呈阳性,符合化学发光法检测结果,其胶体金法检测结果为阴性可能是因为胶体金法相较于化学发光法灵敏度较低。ZHOU J A等[9]也证实,相较于胶体金法,化学发光法应用于SARS-CoV-2 IgM、IgG抗体检测具有更可靠的实用性和灵敏度。研究[10]证实SARS-CoV-2变异株即使在免疫人群中也具有较高的传播率,本研究病例1亦未因接种过新冠肺炎疫苗而免于感染。相关研究[7]称SARS-CoV-2 IgM抗体在患者感染1周内阳性率较低,初始感染期Ct值较低,本研究通过实验室检测结果和入境时核酸检测阴性结果推测2例病例均为新发感染。
奥密克戎变异株是目前已知的SARS-CoV-2变异株中S蛋白变化位点最多的,包含其他4种关切变异株(VOC)S蛋白上出现的所有重要的氨基酸变异位点。本研究第3代基因测序结果也证实了这一点, 2例病例感染的奥密克戎变异株与标准参考株相比,在S蛋白上分别存在32、28个氨基酸位点改变,在受体结合区域(RBD)共享12个氨基酸突变位点,为G339D[11]、S373P[12]、S375F[13]、K417N[14]、N440K[15]、S477N[16]、T478K[12]、E484A[13]、Q493R[13]、Q498R[15]、N501Y[11]和Y505H[16], 这些位点已被证实与奥密克戎变异株产生免疫逃避机制相关。病例2序列BA. 2.3与病例1序列BA. 1.1相比, RBD多出了T376A、D405N和R408S这3个突变位点,缺少了G446S[16]、G496S[12]突变位点, RBD上的这些位点差异可能导致其对多种治疗性抗体的抗性不同,这些突变对疾病传播、发病机制和疫苗效力的影响正在深入研究中[17-18]。
进化树分析显示,SARS-CoV-2的突变是一个连续过程,会导致多种变异株的出现,而新变种奥密克戎乃至其他变种的不断出现导致了新冠肺炎疫情的持续。目前,关于奥密克戎变异株的研究仍在继续,以往关于阿尔法变异株和德尔塔变异株的研究经验提示,只有长时间进行严密监测,才能得到更多关于该新变种的信息,例如其传播特点、疫苗效力和严重性等。本研究认为,采取科学的防疫措施,加快、加强境外输入风险管控,坚持采取有效的个人防护措施切断传播途径,保护易感人群,根据变异株基因进化趋势随时调整疫苗接种策略,仍将是遏制新冠肺炎新毒株传播和防止出现新冠肺炎重症与死亡病例的关键方法。
目前,新冠肺炎感染患者临床样本的基因组测序多采用第2代测序技术,本研究采用的第3代纳米孔测序技术属于单分子测序技术,与第2代测序技术相比,其具有读长长、速度快、测序数据实时监控等优点[19]。研究[20-22]表明,纳米孔测序平台应用于新冠肺炎疫情的基因测序中表现良好,尤其适用于病毒载量低的标本。本研究使用第3代测序平台纳米孔测序技术对SARS-CoV-2标本成功进行测序, 1 d内完成了PCR靶向扩增、建库、测序及数据分析等步骤,成功获得2例患者奥密克戎变异株的全基因组序列并进行溯源分析,大大缩短了测序时间。由此提示,第3代纳米孔测序技术可有效应用于SARS-CoV-2的溯源分析,上机半小时即可锁定病毒的型别及来源,在应对突发疫情时可极大节省时间,尽快为疫情防控指明方向,在地市级疾控机构精准化防控策略的制订与实施中具有较高的应用价值。

