血清TSP-2对非酒精性脂肪性肝病和肝纤维化诊断的价值
何秀丽,万 莹,林 洁
(武汉市第一医院 消化内科,湖北 武汉 430000)
非酒精性脂肪性肝病(NAFLD)是全球日益严重的一个健康问题[1]。以弥漫性肝细胞大泡性脂肪变性为主要特征,排除其他肝脏疾病(例如病毒性肝炎及自身免疫性肝炎)、大量饮用酒精、服用致脂肪变的药物(例如胺碘酮、甲氨蝶呤或异烟肼),以及遗传性疾病等[2]。NAFLD发病原因复杂,根据“多重打击”假说,热量摄入过多和运动不足而导致的能量不平衡增加了胰岛素抵抗,这是基因易感性方面诱发的一个“关键性打击”,其次,进一步的“打击”包括脂肪组织分泌的激素、营养因子、肠道微生物群以及遗传和表观遗传因素的影响,促使脂肪变性发展为NAFLD,甚至更严重的肝纤维化进展[3]。基于NAFLD发病机制的“多重打击”假说,寻找潜在的生物标志物,对于临床诊断和治疗具有重要的实际意义。血小板反应蛋白(TSP)是一种具有多结构域的分泌型多细胞钙结合糖蛋白,属于血小板反应蛋白家族成员,可与多种细胞因子、生长因子、受体和细胞外基质相互作用[3]。既往研究表明TSP-2不仅有抗血管生成的作用,还与胶原纤维生成相关[4-5]。因此本研究旨在分析血清TSP-2水平与NAFLD及其肝纤维化程度的相关性,从而为NAFLD精准医疗提供候选生物标志物。
1 对象与方法
1.1 对象 本项前瞻性、横断面研究由当地医院伦理委员会批准,在遵循《赫尔辛基宣言》的前提下进行。2018年3月至2021年4月,在我院肝胆外科共招募96例NAFLD患者,男54例,女42例,平均年龄(52.99±13.48)岁,纳入标准:(1)所有患者均依据腹部超声检查结果进行诊断,没有酗酒史(酒精摄入量男性<140 g/周,女性<70 g/周),并且经过综合检查排除了其他引起肝脏疾病的原因(病毒性肝炎、药物性肝损伤、自身免疫性肝病、肝豆状核变性、酒精性肝炎、威尔逊氏病、遗传性血色素沉着症和Citrin缺陷病),符合《非酒精性脂肪性肝病诊疗指南》[6];(2)所有患者有完整的肝脏超声记录和肝脏瞬时弹性硬度检查报告,必要时,患者会进行肝脏活检以作组织学诊断;(3)获得所有参与者的书面同意。排除肝功能不全、患有全身性炎症(包括类风湿性关节炎、银屑病和炎症性肠病)、接受免疫抑制治疗的患者。最终纳入的患者临床状况都很稳定,收集的数据包括身高、体重、腰围、肝肾功能参数以及全血细胞计数等。记录所有患者的人口统计资料及合并病(如糖尿病、高血压、高脂血症或有心血管疾病史)。此外收集100例在我院进行健康体格检查的志愿者的血清样本,作为对照组,平均年龄(53.21±15.49)岁、性别构成(男50例,女50例)与NAFLD组患者一致(P>0.05),酒精摄入量男性<140 g/周,女性<70 g/周;在血清采集前也获得样本使用的知情同意书。
1.2 血清TSP-2水平检测 所有患者均于肝组织活检前采集肘静脉血,血液样本收集于BD SST II Advance血清分离管(BD Vacutainer Systems,美国)中。凝血30 min后,于25℃环境下,2 000 r/min离心10 min,分离上清液血清,储存于-80℃环境中,待进一步分析。血清使用微量滴定板孵育,室温下使用捕获抗体处理1 h。洗板后在室温下与特异性抗体孵育0.5 h,再洗板,然后将二抗加入滴定板,用终止液终止反应。使用酶标仪(BioRad,加拿大)记录450 nm处的吸光度。详细方案根据制造商说明书操作。
1.3 其他实验室检查 使用罗氏Cobas 8000型全自动生化分析仪及配套的原装试剂检测血清谷草转氨酶(AST)、谷丙转氨酶(ALT)、谷氨酰转肽酶(GGT)、总胆红素(TBIL)、血清肌酐(sCr)、糖化血红蛋白(HbA1c)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、C反应蛋白(CRP)等,另外使用SysmexXN-9000多功能全自动血细胞分析仪检测血小板计数(PLT)等,计算AST/PLT指数(APRI)和FIB-4指数[公式:(年龄×AST)/(PLT×ALT2)]。
1.4 Fibroscan检查 瞬时弹性成像使用Fibroscan®502 Touch(Echosens,法国)进行,由经过培训的专业人员使用标准化的操作进行所有的瞬时弹性成像检查。患者取仰卧位,右臂最大外展,通过肋间间隙测量右肝叶。所有检测都是从M探针开始,只有在设备的自动探针选择工具提示下才会过渡到XL探针。同一个患者由同一检查人员重复进行瞬时弹性成像检查。采用2次瞬时弹性成像检验的平均值。本分析中使用的肝脏硬度值(LSM)是通过两次检验获得的中位数的平均值。肝纤维化分期为:F0~F1期(无或轻度纤维化,<7 kPa)、F2期(中度纤维化,7~8.99 kPa)、F3期(严重纤维化,9~12.49 kPa)和F4期(肝硬化,≥12.5 kPa)[7]。将F0~F2期的患者作为轻中度组,F3~F4期作为重度组。

2 结果
2.1 两组受试者血清TSP-2水平比较 经ELISA分析,与健康对照组相比,NAFLD组患者血清TSP-2水平显著升高[48.39(30.15,86.28)ng/mLvs32.37(22.47,66.84)ng/mL,Z=7.321,P<0.001]。经ROC曲线分析,血清TSP-2水平诊断NAFLD的AUC为 0.784(95%CI:0.716~0.851),见图1。
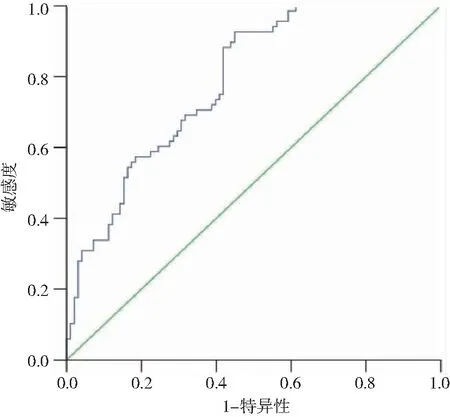
图1 血清TSP2水平诊断NAFLD的ROC曲线
2.2 NAFLD患者肝纤维化程度与临床特征的关系 根据Fibroscan结果,将本研究共有68例F0~F2期患者,共有28例F3~F4期患者。经分析,F3~F4期患者的年龄、男性比例、糖尿病及家族性糖尿病例数、血清TSP-2水平、APRI、FIB-4均显著高于F0~F2期患者(P<0.05,见表1)。
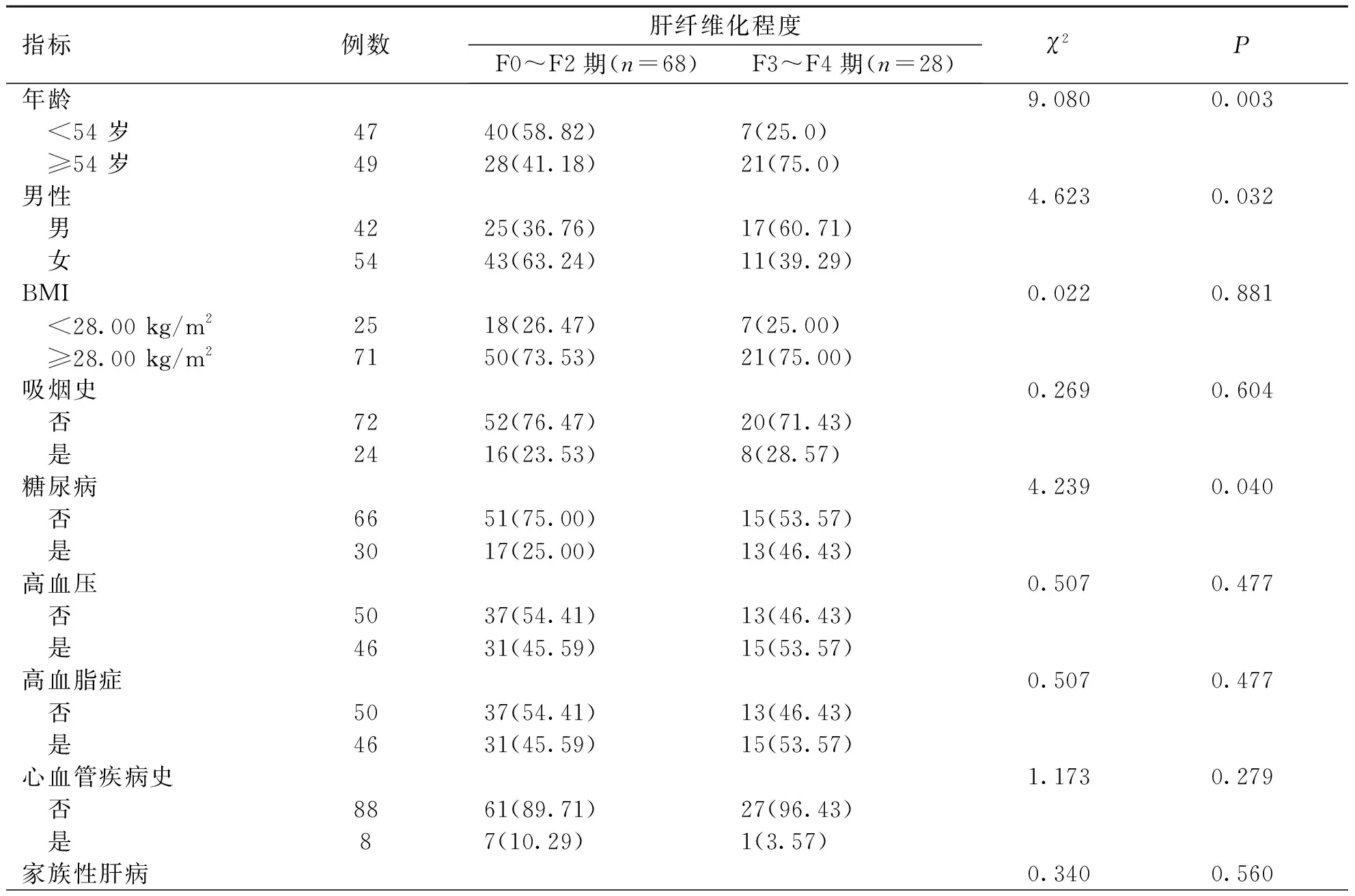
表1 NASFLD患者肝纤维化程度与临床特征的关系

(续表)
2.3 NAFLD组患者血清TSP-2水平与AST、ALT、APRI、FIB-4指数的关系 经Spearman秩相关系数分析,NAFLD组患者血清TSP-2水平与AST(rs=0.240,P=0.042)、ALT(rs=0.276,P=0.030)、APRI(rs=0.306,P=0.021)、FIB-4指数(rs=0.667,P<0.001)均呈正相关性(见图2),进一步校正年龄、性别等混在参数后,经多元线性回归分析,血清TSP-2水平与FIB-4指数(β=0.006,95%CI:0.003~0.010,P<0.001)仍呈正相关性。
2.4 NAFLD组患者血清TSP-2水平与Fibroscan结果的关系 经Spearman秩相关系数分析,NAFLD组患者血清TSP-2水平与Fibroscan结果呈正相关性(rs=0.331,P<0.001,见图3)。进一步校正年龄、性别、合并症史、家族性糖尿病史造成的偏倚,经多元线性回归方程校正上述混杂因素后,血清TSP-2仍然是影响NAFLD患者Fibroscan肝纤维化结果的独立因子(非标准化系数=0.004,t=1.801,95%置信区间=0.002~0.008,P=0.007)。

图3 NAFLD患者血清TSP-2水平与Fibroscan结果的Spearman分析
2.5 ROC曲线分析血清TSP-2水平用于诊断F3~F4期肝纤维化患者的临床价值 经ROC曲线分析,血清TSP-2水平分别联合APRI及FIB-4诊断F3~F4期肝纤维化NAFLD患者的AUC值分别为0.754(95%CI:0.649~0.859)、0.743(95%CI:0.631~0.855),均优于它们单独预测(Z=-2.719,-3.018,P<0.05,见表2、图4)。
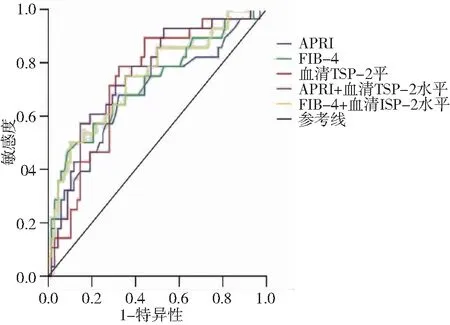
图4 APRI、FIB-4、血清TSP-2水平诊断NAFLD患者重度肝纤维化的ROC曲线
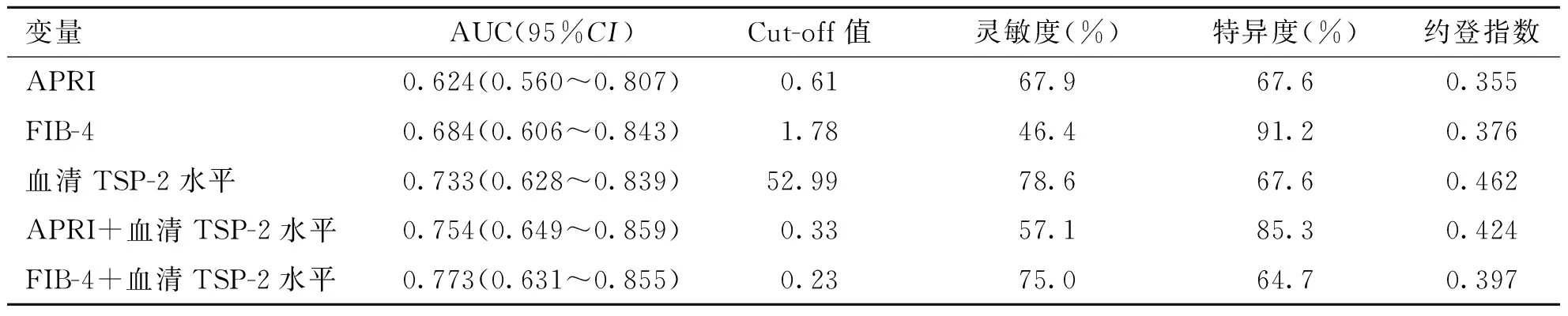
表2 APRI、FIB-4、血清TSP-2水平诊断NAFLD患者重度肝纤维化的ROC曲线分析
3 讨论
NAFLD的特征是肝脏内脂肪过度积累(≥5%),与酒精摄入和病毒感染无关。NAFLD发生过程十分复杂,但是已确定与肝细胞损伤、炎症和纤维化的过程紧密相连[8-10]。因此,“纤维化的生物标记物”通常能够反映这一病理进程[11]。临床诊断NASH主要依靠症状、肝脏影像学检查等综合判断,但价值有限。而本研究结果证实,血清TSP-2可以作为NAFLD以及中晚期肝纤维化的生物标志物。
TSP家族由5个亚型组成,根据分子n端1型重复结构域的存在(A组)或缺失(B组),可分为A组(TSP-1、TSP-2)和B组(TSP-3、TSP-4、TSP-5)。TSP-2为A组TSP,在结构上与TSP-1非常相似,某些功能也与TSP-1类似,如抑制血管生成、诱导内皮细胞凋亡、参与整合素介导的信号通路等。然而,TSP-1和TSP-2有一些关键的区别。TSP-1和TSP-2均由血管平滑肌细胞、巨噬细胞和成纤维细胞分泌,TSP-1储存在血小板α颗粒中,并在动脉损伤后大量释放,而TSP-2的释放相关缓慢且稳定,血管平滑肌细胞中TSP-2的释放在损伤后3d才检测到,并在损伤后10d时达到峰值。因此TSP-1可能更像急性期的反应物,而TSP-2可能在损伤后的炎症和重塑期更重要[12-13]。大量研究表明TSP-2 可能参与调节血管生成、增殖、细胞凋亡、肿瘤迁移、上皮间充质转化和转化生长因子(TGF)-β激活[14-16]。既往众多研究证实,APRI、FIB-4指数对于肝纤维化的诊断及严重程度有良好的评估效能,但易受用药因素影响[17-18],在本研究中,NAFLD患者血清TSP-2水平与AST、ALT、APRI、FIB-4均呈正相关,尤其是与APRI、FIB-4指数在校正年龄、性别等混杂因素后仍然有关,表明TSP-2与NAFLD的疾病进展及肝纤维化程度相关。虽然ALT和AST异常与NAFLD的存在和严重程度无关,但定量相关性仍然有一定的价值,因为它可以揭示肝损伤趋势和关联,以便进一步调查。
早有动物实验[4]发现,与野生型小鼠相比,在心肌细胞移植2周后TSP-2敲除小鼠纤维化面积减少了4.5倍,移植物周围瘢痕囊厚度减少了7倍,证实TSP-2在心肌细胞移植后的促纤维化及抑制血管生成作用;Kunkemoeller等[19]发现糖尿病小鼠和糖尿病患者皮肤组织中TSP-2表达升高,尽管TSP-2缺陷小鼠与糖尿病对照组小鼠相比出现了肥胖和高血糖,但它们的愈合显著得到改善,其特征是加速再上皮化及肉芽组织形成、成纤维细胞迁移及血管成熟。同时证实高血糖增加了成纤维细胞中TSP-2的表达,而成纤维细胞是创伤后TSP2的主要细胞来源;TSP在骨折愈伤组织中其发挥重要作用,在早期骨折愈伤组织的未分化区域可观察到类似的TSP-2表达细胞群,以及在愈伤组织形成后期也可观察到TSP-2表达集中在愈伤组织外围[20]。本研究经进一步分析发现,血清TSP-2水平的升高与肝纤维化程度增加相关,这与Kozumi等[18]的研究结论相符,经分析发现,血清TSP-2水平联合APRI或FIB-4且均具有良好诊断肝纤维化程度的效能。
综上所述,NAFLD患者血清TSP-2水平与Fibroscan检测结果呈正相关性,虽然还需要进一步的验证,但是TSP-2结合APRI、FIB-4,可以潜在地作为NAFLD肝纤维化进展的候选标志物,从而为临床上是否有必要进行肝活检提供一定的信息参考。然而,本研究也存在一定的不足:首先本研究为单中心队列研究,并没有分析TSP-2在NAFLD疾病进展中的作用;其次,本研究仅单次分析患者活检前的血清TSP-2水平,未对血清TSP-2水平进行动态监测、分析。后续应进一步对血清TSP-2水平进行分析,来最终确定使用TSP2作为NAFLD生物标志物的真正临床有效性和成本效益。

