SOCS6对前列腺癌分化的影响及其临床意义
苏 浩,王 蔚,袁东波,朱建国
(1.遵义医科大学 研究生院,贵州 遵义 563099;2.贵州省人民医院 泌尿外科,贵州 贵阳 550002)
前列腺癌(Prostate cancer,PCa)是全球男性中被诊断出的第三常见癌症,仅次于肺癌和结直肠癌[1]。虽然中国的前列腺癌发病率较欧美国家低,但随着我国经济水平提高、人民生活水平改善、人均寿命延长和筛查范围扩大,中国的前列腺癌发病率呈显著上升趋势,正逐步成为影响中老年男性健康的重要疾病[2]。近几年,前列腺癌已超过膀胱癌,成为在登记泌尿系癌症中第一位[3]。虽然前列腺癌是一种惰性癌,但大部分患者初诊时已处在疾病的中晚期[4],并且在激素治疗过程中容易发展为去势性抵抗前列腺癌[5]。因此,探索新的分子标记物,并对其更详细地探索,对开发更有效的治疗方式起着非常重要的作用。
细胞因子信号抑制因子(Suppressors of cytokine signalling,SOCS)是细胞因子受体信号的负性调节蛋白,在癌症的免疫中起重要的作用,SOCS6是其中重要的一员[6-7]。SOCS6在子宫、甲状腺和胰腺的正常组织样本中高表达,然而在自卵巢、肺、胃、膀胱、前列腺组织相对低表达[8-9]。SOCS6在大部分的肿瘤研究中主要起到抑癌基因的作用。本课题组前期研究发现,SOCS6在前列腺癌中的相对表达量较正常前列腺组织显著降低,上调SOCS6表达可显著抑制前列腺癌细胞的迁移和侵袭能力,促进细胞的凋亡,且与Gleason评分等密切相关[10]。Gleason评分与PCa的病理分期密切相关,故猜测SOCS6表达情况影响了前列腺癌的分化。本研究将进一步验证SOCS6在前列腺癌中表达情况,通过动物体外成瘤实验,分析其表达情况与前列腺肿瘤分化的影响,探讨其作用机制和临床意义。
1 材料与方法
1.1 组织样本采集 本研究经贵州省人民医院伦理委员会批准(编号:2016026),收集在贵州省人民医院泌尿外科行前列腺癌手术的10例患者的组织标本。所有患者手术前均没有接受化疗或放疗,组织标本术后经病理诊断为前列腺癌。
1.2 细胞与试剂 人前列腺癌细胞株(PC3和LNCaP)购自美国模式培养物集存库( ATCC);胎牛血清( FBS)、胰蛋白酶(EDTA)、1640培养基购买于美国Gibico公司;细胞培养瓶、细胞培养皿、巴氏管、离心管等塑料制品购买自NEST公司;免疫组化试剂盒、伊红、苏木素染液购买自北京索莱宝科技有限公司;β-actin、SOCS6抗体及辣根过氧化物酶标记的二抗购买自Abcam公司;牛血清白蛋白(BSA)、BCA蛋白检测试剂盒和ECL试剂盒购买自碧云天。
1.3 免疫组化染色 福尔马林固定和石蜡包埋切片,免疫组织化学染色使用标准免疫组织化学(IHC)方法,用一抗SOCS6进行孵育,在室温下用优化的稀释度。本课题组前期已使用组织芯片证实前列腺癌组织中SOCS6的相对表达量较正常前列腺组织显著降低[11]。此次实验将使用SP法进行免疫组织化学染色,检测前列腺癌组织中SOCS6表达及分布情况。
1.4 SOCS6过表达细胞株PC3/LNCaP的构建及鉴定 将前列腺癌PC3和LNCaP细胞株放在加入含10% 胎牛血清的1640培养基中,并加入1%的双抗,置于常规培养箱中培养,细胞生长至80%~90%时换液传代。实验选用对数生长期细胞,使用慢病毒载体构建SOCS6过表达细胞株(LNCaP-pre-scos6、PC3-pre-scos6)和空载细胞株(LNCaP-pre-000、PC3-pre-000)。将3种细胞株(过表达组、空载组、正常组)进行蛋白样品制备,BCA法测定各样本蛋白浓度,以恒压80V、20 min(浓缩胶),120 V、100 min(分离胶)条件电泳,取分离胶进行转膜至PVDF膜上,于室温用5% BSA进行封闭1 h,SOCS6一抗(1∶1 000)4°冰箱摇床孵育过夜,第2天洗膜后二抗(1∶10 000)室温孵育1 h。根据ECL化学发光试剂盒说明书对PVDF膜上的蛋白印迹进行曝光,Tanon 5200型凝胶成像系统拍照。β-actin作为内参蛋白对照,相对灰度=目的条带灰度值/内参条带灰度值×100%。
1.5 实验动物及饲养条件 BLAB/c雄性裸鼠,4~5周龄,体重(15±2) g,12只;购买于广东医学实验动物中心。SPF级的环境中饲养,每笼3只,所有动物饲养在通风干燥的房间。
1.6 裸鼠肿瘤模型构建 取对数生长期的LNCaP-pre-scos6、PC3-pre-scos6和LNCaP-pre-000、PC3-pre-000克隆细胞,用EDTA消化细胞,待贴壁细胞开始掉落,终止消化,吹打混匀制成细胞悬液,进行细胞计数,随后将细胞收集到15 mL离心管中,1 000 r/min ,5 min。弃上清液,用无血清培养基重悬为1.5× 107/mL悬液。根据接种细胞种类分为4组裸鼠,每组3只,每只裸鼠肾包膜上接种100 μL细胞混匀液,共接种12只。LNCaP对照组1-3号裸鼠左侧肾包膜注射LNCaP-pre-000细胞数为3.16×106个,实验组1~3号裸鼠左侧肾包膜注射LNCaP-pre-SCOS6细胞数为3.16×106个;PC3对照组1~3号裸鼠左侧肾包膜注射PC3-pre-000细胞数为3.44×106个,实验组 1~3号裸鼠左侧肾包膜注射PC3-pre-SCOS6细胞数为3.44×106个。在SPF级环境中,放回笼中分开继续饲养观察。LNCaP组接种后的34 d取材,PC3组接种后的27 d取材。
1.7 瘤体组织取材及HE染色 所有动物经过处理后,每天观察裸鼠生长状况。生长时间到达后,麻醉状态下完整取出瘤体以及其他内脏器官,脱颈椎处死动物,称重并且拍摄,随即在4%多聚甲醛溶液中固定48 h,制作石蜡切片,根据HE染色步骤进行染色,随后在显微镜下进行观察组织病理改变。
2 结果
2.1 SOCS6在前列腺癌组织中表达情况 通过免疫组化染色,在光镜下可观察到SOCS6表达主要集中于前列腺癌上皮基底细胞,阳性细胞着色主要定位于细胞浆、细胞核,在前列腺癌样组织中免疫组化染色强度主要为中、弱阳性,镜下部分结果如图1所示。
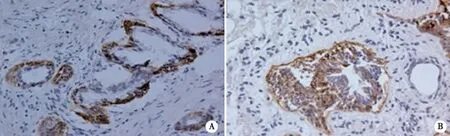
A:镜下×200;B:镜下×400。图1 SOCS6在前列腺癌组织中的表达
2.2 Western blot检测LNCaP/PC3过表达细胞株SOCS6蛋白表达水平 以β-actin蛋白为内参,检测SOCS6在PC3正常细胞组(PC3-normal)、空载对照组(PC3-000)、过表达组(PC3-SOCS6)中的蛋白表达水平;结果显示过表达组细胞株的SOCS6蛋白表达量相对于正常组细胞和空载对照组显著增高(P<0.05,见图2A、B)。同样,检测SOCS6在LNCaP正常细胞组(LNCaP-normal)、空载体对照组(LNCaP-000)、过表达组(LNCaP-SOCS6)中SOCS6蛋白的表达水平,结果显示过表达组细胞株的SOCS6蛋白表达量相对于正常组细胞和空载对照组显著增高(P<0.05),见图2C、D。由此可见两个细胞株构建成功。
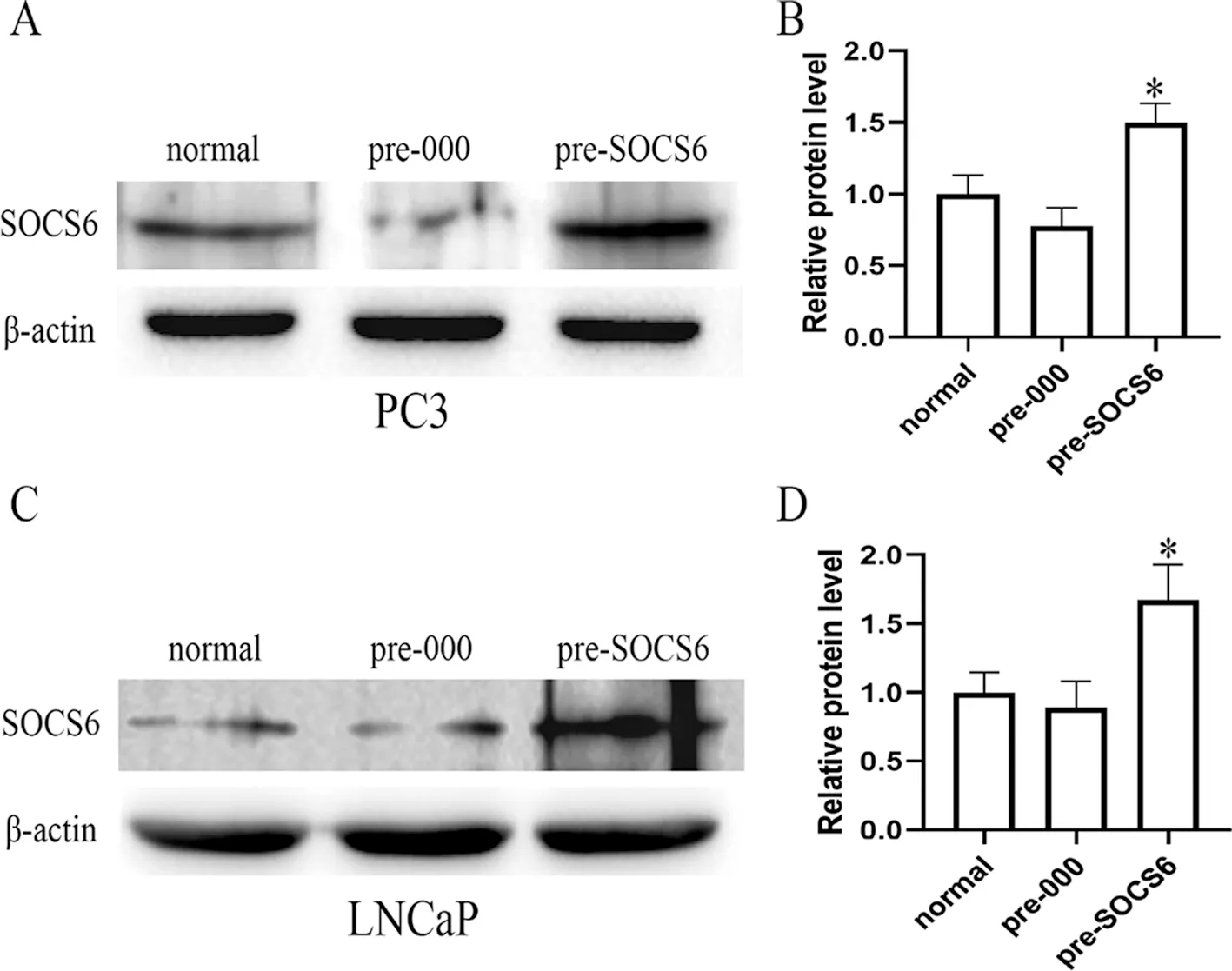
A、B:PC3细胞株SOCS6蛋白表达情况;C、D:LNCaP细胞株SOCS6蛋白表达情况;*:与正常和空载组细胞比较,P<0.05。图2 Western blot检测PC3/LNCaP细胞株中各组细胞SOCS6蛋白表达水平
2.3 裸鼠成瘤情况 PC3组细胞生长速度较快,接种27 d肿瘤已经扩散侵蚀了大部分的肾脏(见图3A)。LNCaP组细胞中LNCaP-pre-000在肾包膜内接种的3只裸鼠中,只有两只成瘤了(1号和2号),可能是操作失误导致其中一只没有细胞接种成功;LNCaP-pre-SCOS6在肾包膜内接种的3只裸鼠均长出大小不一的肿瘤(见图3B)。

图3 PC3、LNCaP SOCS6过表达组与空载组裸鼠成瘤情况
2.4 HE染色观察裸鼠肿瘤组织分化情况
2.4.1 SOCS6基因对PC3肿瘤细胞分化的影响 实验组(PC3-pre-SOCS6)与对照组(PC3-pre-000)肿瘤呈中分化或者低分化,特别是1号和3号小鼠的实验组分化较好,肿瘤内有较多的腺腔,部分肿瘤分化为腺体还不明显。肿瘤中有较多的间质生成,癌细胞形态与正常细胞还是有比较大的差异,部分肿瘤细胞呈高分化,细胞形态趋于正常化。实验结果见图4~6。
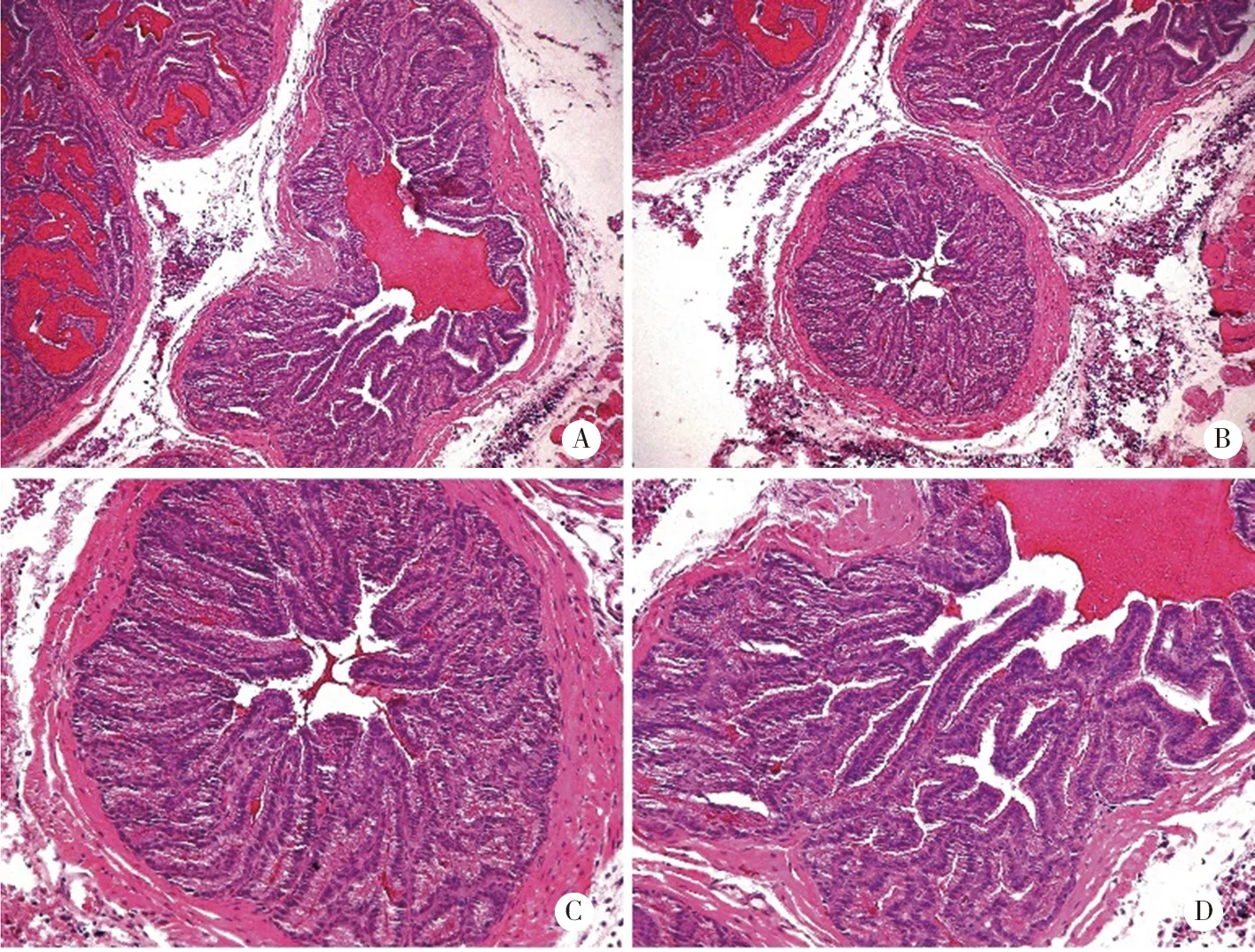
A、B:PC3-pre-SOCS6-1号,×100;C、D:PC3-pre-SOCS6-1号,×200。图4 PC3实验组1号小鼠肿瘤分化情况
A:PC3-Pre-SOCS6-2号,×100;B:PC3-Pre-SOCS6-2号,×200;C:PC3-Pre-SOCS6-3号,×100;D:PC3-Pre-SOCS6-3号,×200;PC3-Pre-SOCS6-2号:小鼠的肿瘤细胞分化较好,趋于正常细胞形态,无腺腔生成;PC3-pre-SOCS6-3号:小鼠的肿瘤有腺腔形成。图5 PC3实验组2号和3号小鼠肿瘤分化情况
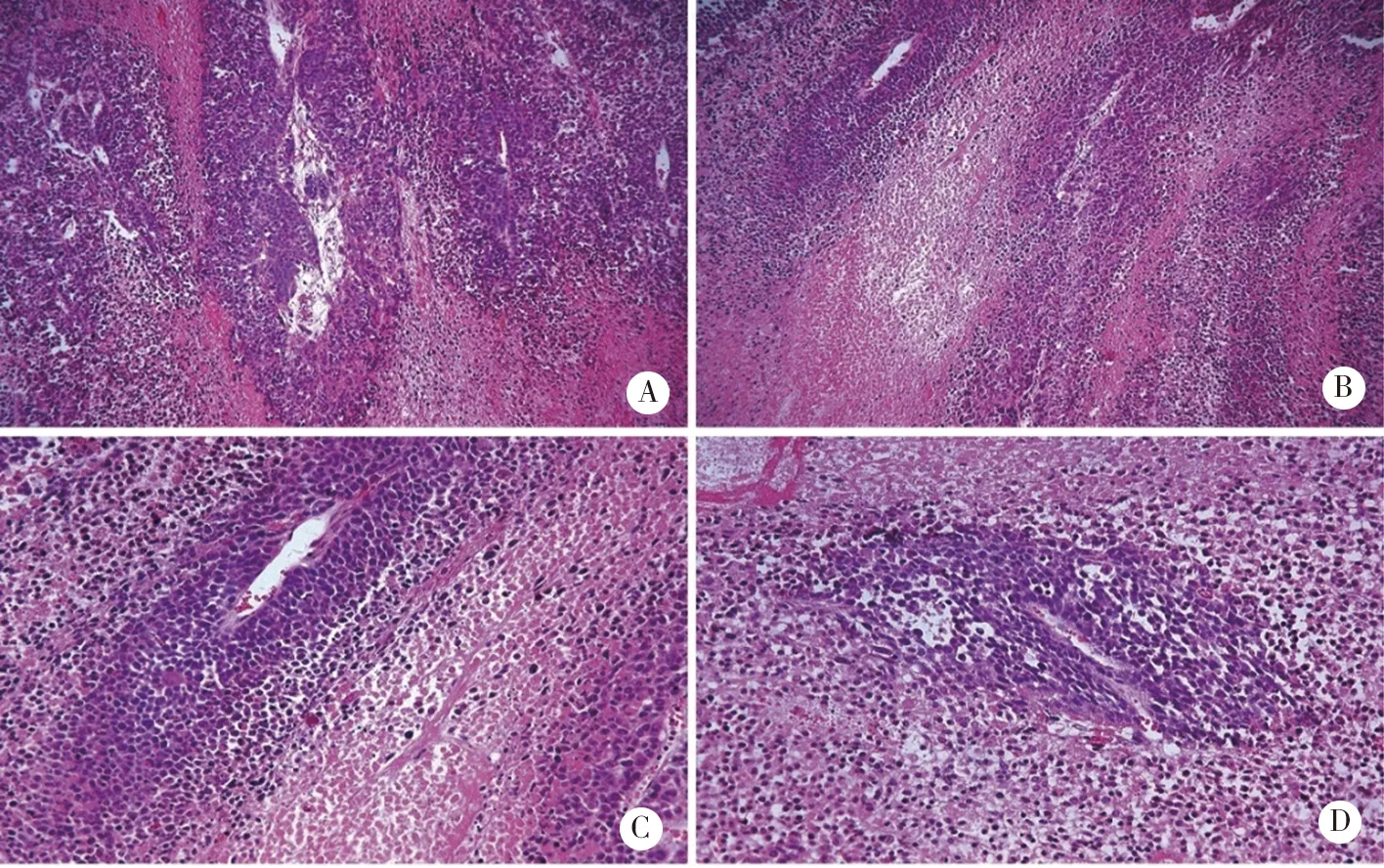
A、B:PC3-pre-000,×100;B、C:PC3-pre-000,×200。图6 PC3对照组小鼠肿瘤分化情况
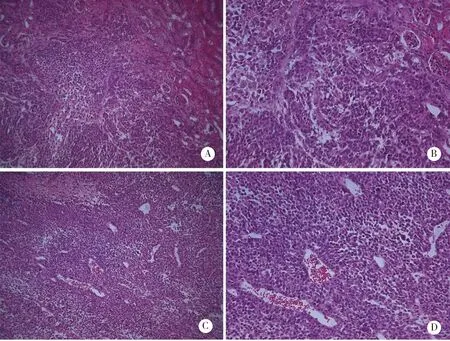
2.4.2 SOCS6基因对LNCaP肿瘤细胞分化的影响 实验组(LNCaP-pre-socs6)与对照组(LNCaP-pre-000)肿瘤均呈低分化,肿瘤均已影响到肾脏组织,肾小管上皮细胞水肿,上皮细胞细胞核出现分裂,实验组肾小管扩张严重,癌细胞已向肾脏蔓延,部分癌细胞浸润肾间质,肾小管及肾小球,肾小球炎症细胞浸润。实验组与对照组肿瘤多有坏死,肿瘤为实质性肿瘤,无腺腔,呈低分化实。实验结果如图7~8。

A:肿瘤呈低分化,向肾脏蔓延(LNCaP-pre-socs6 ×100);B:肾小管严重扩张(LNCaP-pre-socs6 ×100);C:肾小管,肾小球癌细胞浸(LNCaP-pre-socs6 ×200);D:肿瘤坏死,低分化(LNCaP-pre-socs6 ×200);E、F:癌细胞向肾间质蔓延,肾小管被肿瘤包裹,上皮细胞水样变,细胞核分裂(LNCaP-pre-socs6 ×400)。图7 LNCaP实验组小鼠肿瘤分化情况
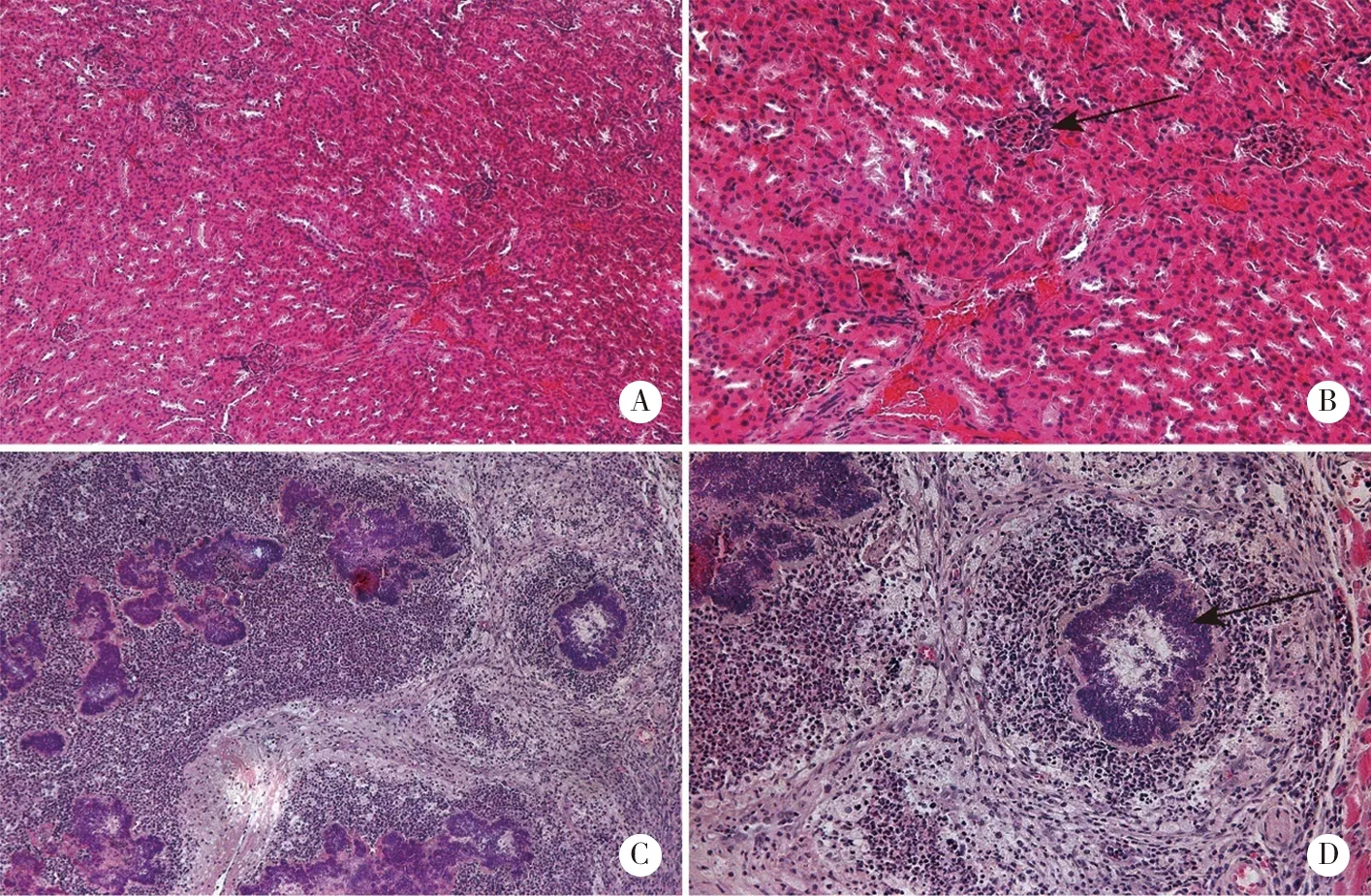
A:LNCaP-pre-000-1号×100;B:LNCaP-pre-000-1号×200;C:LNCaP-pre-000-2号×100;D:LNCaP-pre-000-2号×200;LNCaP-pre-000-1号:小鼠肾小球癌细胞浸润,部分肾间质也有癌细胞;LNCaP-pre-000-2号:小鼠肾小管上皮细胞多核,肿瘤组织发生坏死,肿瘤呈低分化。图8 LNCaP对照组小鼠肿瘤分化情况
3 讨论
肿瘤的生长速度、侵袭转移、预后等生物学特征与肿瘤的分化密切相关,肿瘤分化程度越低,恶性程度就越高。肿瘤的诱导分化治疗是治疗肿瘤的一个重要的方向,并且在一些疾病的治疗中得到了证实[12]。前列腺癌是一种惰性癌,其主要死因为恶性程度高的侵袭性癌转移到全身引起多器官衰竭,因此,促进前列腺癌的分化,降低其恶性程度是增加前列腺癌患者生存率的一个有前景的治疗方式。Geleson评分是目前国际上使用最广泛使用的前列腺癌的标准病理分级系统,现已成为前列腺癌诊断、制定治疗方案和评估预后的主要参考条件之一[13]。前期研究已证实,前列腺癌中SOCS6的表达水平与肿瘤Geleson评分具有显著相关性,其表达水平越高,则Geleson评分越低,反之越高。因此,推测SOCS6基因可能会影响前列腺癌的分化。
细胞因子信号抑制因子(SOCS)家族是一类由细胞分泌的负性调节因子,通过反馈阻断细胞因子诱导的细胞信号转导过程,主要作为JAK/STAT等多条信号通路的负性调控蛋白,它由8个成员组成,从SOCS1到SOCS7和CIS[14-15]。SOCS6广泛表达在许多组织,现有研究发现SOCS6不仅涉及细胞增殖、转化和凋亡的调节,还与众多肿瘤的发生、发展密切相关,在许多癌症中受miRNA的调控导致其下调,从而增加癌细胞的生长、迁移和侵袭能力[16-18]。
前列腺上皮由腔上皮细胞层和基底细胞层构成,干细胞长期以来一直与前列腺形成有关,基底细胞和管腔细胞属于同一谱系,并且源自共同的干细胞,且干细胞位于基底区室中[19]。在前列腺癌中,正常上皮谱系发生分化功能障碍,基底膜破坏、消失,连续基底细胞层丢失和管腔种群扩大[20]。前列腺癌发生雄激素剥夺和再生睾酮替代后干细胞会发生消退,再生研究表明,这些细胞存在于前列腺的近端导管和基底层[21]。本实验发现SOCS6 局限于前列腺基底细胞中表达。随后,应用慢病毒构建稳定过表达SOCS6的前列腺癌细胞株PC3和LNCaP。LNCaP是从人前列腺癌患者左锁骨上淋巴结细针穿刺的活体组织中分离建立的雄激素依赖的生长的细胞系,而PC3是从人前列腺癌骨转移中分离的雄激素非依赖性前列腺癌细胞系[22]。本实验在体外构建了动物移植瘤模型,通过HE染色发现:在PC3细胞株中肿瘤主要呈现低分化或中分化,通过上调SOCS6的表达水平可促进肿瘤分化,肿瘤组织内可见较多的腺腔,部分新生腺体的形成,肿瘤中有较多的间质生成,部分肿瘤细胞呈高分化,细胞形态趋于正常化。而在LNCaP细胞中肿瘤均已影响到肾脏组织,实验组与对照组肿瘤多有坏死,肿瘤为实质性肿瘤,无腺腔,呈低分化。因此,推测SOCS6可能促进雄激素非依赖性前列腺癌的分化。
在食管鳞状细胞癌中,SOCS6 可以通过 c-Kit 的泛素化和降解来促进癌细胞的放射敏感性并降低它们的干细胞性[23]。在肝脏肿瘤起始细胞中, SOCS6 的表达降低,而SOCS6 的过表达下调了肿瘤起始细胞的自我更新和致瘤能力[24]。在膀胱癌中,SOCS6的上调可以抑制癌细胞的恶性程度[25]。由此可见,在肿瘤中,SOCS6可促进肿瘤的分化,减少其恶性程度。杨林等证明miR24-3p过表达促进前列腺癌细胞增殖、侵袭和迁移,而miR-24-3p 是 SOCS6 的转录后负调节因子[26],因此根据本研究移植瘤的分化结果,猜测在前列腺癌中,miR-24-3p可能抑制了SOCS6的表达,使肿瘤的恶性程度增加,而过表达SOCS6会促进肿瘤的分化,降低其恶性程度,其具体机制还有待进一步研究。
综上所述,在前列腺癌中SOCS 6的表达与肿瘤分化、病理分期、预后密切相关。SOCS 6的表达水平越高,肿瘤分化程度越高,恶性程度越低,临床预后越好。因此,SOCS 6有望成为前列腺癌具有前景的治疗目标。

