牙髓干细胞外泌体对口腔鳞状细胞癌CAL-27增殖、迁移的影响及其机制的研究
岳杰 杨麒麟 孙翔宇 孙誉铭 麻响 陈东 静广平

1 材料与方法
1.1 主要仪器与试剂
人口腔鳞状细胞癌CAL-27细胞购自武汉普诺赛(Procell)生命科技有限公司;DMEM高糖培养基购自Hyclone公司;0.25%胰酶EDTA购自碧云天公司;胎牛血清购自Gibco公司;茜素红染液购自Cyage公司;STRO-1抗体购自Sigma公司;超速离心机购自Beckman公司;荧光相差显微镜及图像采集系统购自Olympus公司。
1.2 hDPSCs的分离培养与鉴定
经患者及家属知情同意后,收集16~28岁患者因阻生或正畸拔除的完整恒牙。采用组织块贴壁法培养,当细胞达到80%~90%融合时,按1∶3进行传代。取第3~5代细胞用于后续实验。矿化诱导21 d后进行茜素红染色;hDPSCs固定后,用基质细胞抗原STRO-1一抗稀释液(1∶200)4℃摇床孵育过夜,洗去一抗,二抗稀释液(1∶500)孵育30 min,在荧光显微镜下观察。
1.3 hDPSCs-exo的分离与鉴定
收集饥饿48 h后的hDPSCs上清液,超速离心法进行离心:300 ×g,10 min,收上清;3 000 ×g,30 min,收上清;10 000 ×g,60 min,收上清;0.22 μm无菌滤器过滤后加入超高速离心管中,120 000 ×g,70 min,弃上清,无菌PBS溶解沉淀,以上操作均在4℃进行,-80℃保存备用:(1)透射电镜(TEM)观察外泌体形态;(2)Nanosight NS300(NTA)分析外泌体的粒径;(3)Western blot检测外泌体蛋白标志物。
1.4 hDPSCs-exo对CAL-27细胞增殖能力的影响
取对数生长期的CAL-27细胞以5×103个/孔的密度接种于96孔板,细胞贴壁后,分别加入hDPSCs-exo(0、20、40、60、80 μg/mL),每组5个复孔。培养1、3、5 d后,每孔加入20 μL MTT溶液,避光孵育4 h后弃培养液,加入二甲基亚砜微震荡10 min,酶标仪测定490 nm处各孔吸光度值。
1.5 划痕实验
取对数生长期的CAL-27细胞以1×105个/孔的密度接种于6孔板,待细胞铺满后进行划痕,PBS冲洗2~3次。依分组(同上)加入相对应的无血清培养基,于0、24、48 h在显微镜下观察细胞迁移距离并拍照。
1.6 Transwell细胞迁移实验
取对数生长期的CAL-27细胞以1×105个/孔的密度接种于小室内,下室依分组(同上)加入500 μL相应的培养基。培养24 h后,4%多聚甲醛固定,结晶紫染色30 min,显微镜下随机选取5个视野拍照并统计。
1.7 Western blot检测PI3K、P-Akt和Akt的表达
经hDPSCs-exo(0、20、60、80 μg/mL)处理的CAL-27细胞,48 h后RIPA裂解液提取蛋白,BCA试剂盒检测蛋白浓度,调整蛋白上样量。将封闭后的PVDF膜分别与PI3K、P-Akt、Akt、GAPDH(均1∶1 000)的一抗于4℃摇床孵育过夜,二抗(1∶5 000)室温孵育1 h后进行成像、分析。
1.8 统计学分析
本实验数据采用GraphPad Prism 8软件进行方差分析。所有实验独立重复至少三次,计量数据以均数±标准差表示,组间比较采用单因素和多因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 hDPSCs分离培养与鉴定
采用组织块贴壁法培养牙髓组织,7~10 d可观察到细胞从组织周围爬出呈典型的长梭形,约2~3周细胞发生融合。矿化诱导21 d后,茜素红染色镜下可见红色的矿化结节。荧光显微镜下STRO-1呈阳性表达(图1)。
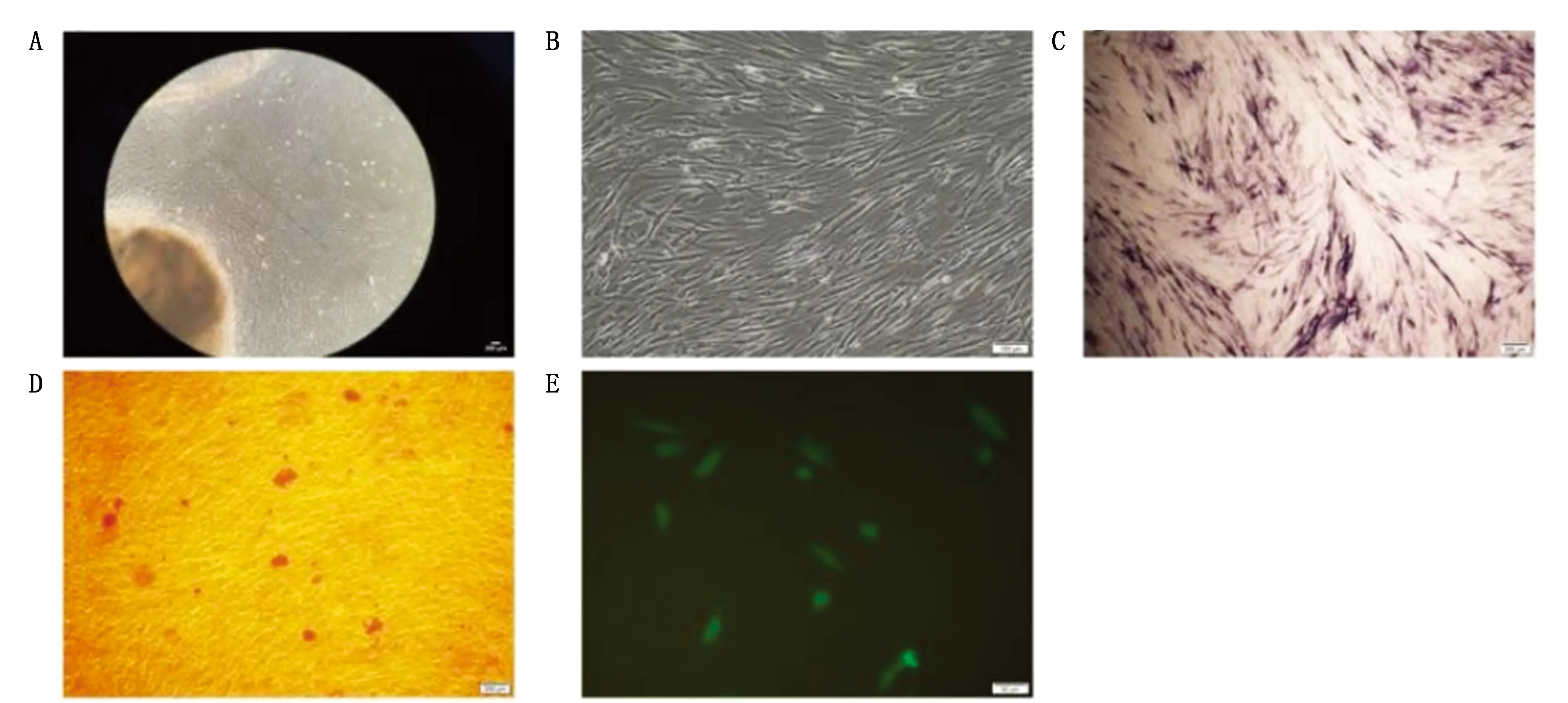
图1 hDPSCs的原代分离培养与鉴定
2.2 hDPSCs-exo的鉴定
TEM观察hDPSCs-exo呈典型的杯托状、囊泡状结构,Western blot显示外泌体特征性蛋白标志物CD9、HSP70、TSG101表达均呈阳性,NTA显示粒径集中分布在149.5 nm左右(图2)。
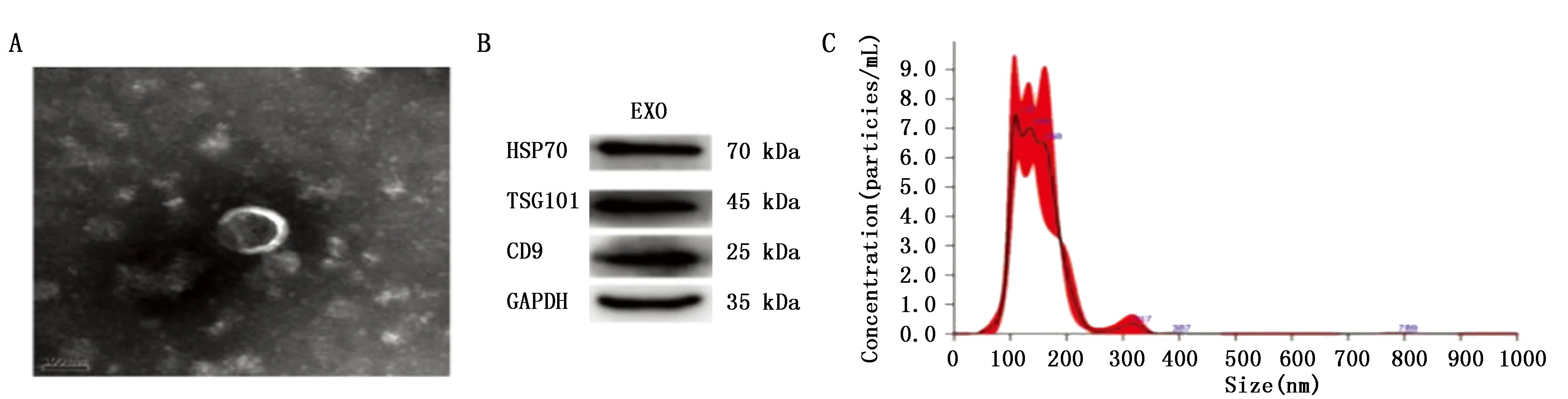
图2 hDPSCs-exo的鉴定
2.3 hDPSCs-exo对CAL-27细胞增殖能力的影响
MTT结果显示,与0 μg/mL组相比,仅80 μg/mL 组在第5 d对CAL-27细胞的增殖有抑制作用(P=0.002),其余各浓度组对CAL-27的增殖均没有显著影响(P>0.05)(图3)。
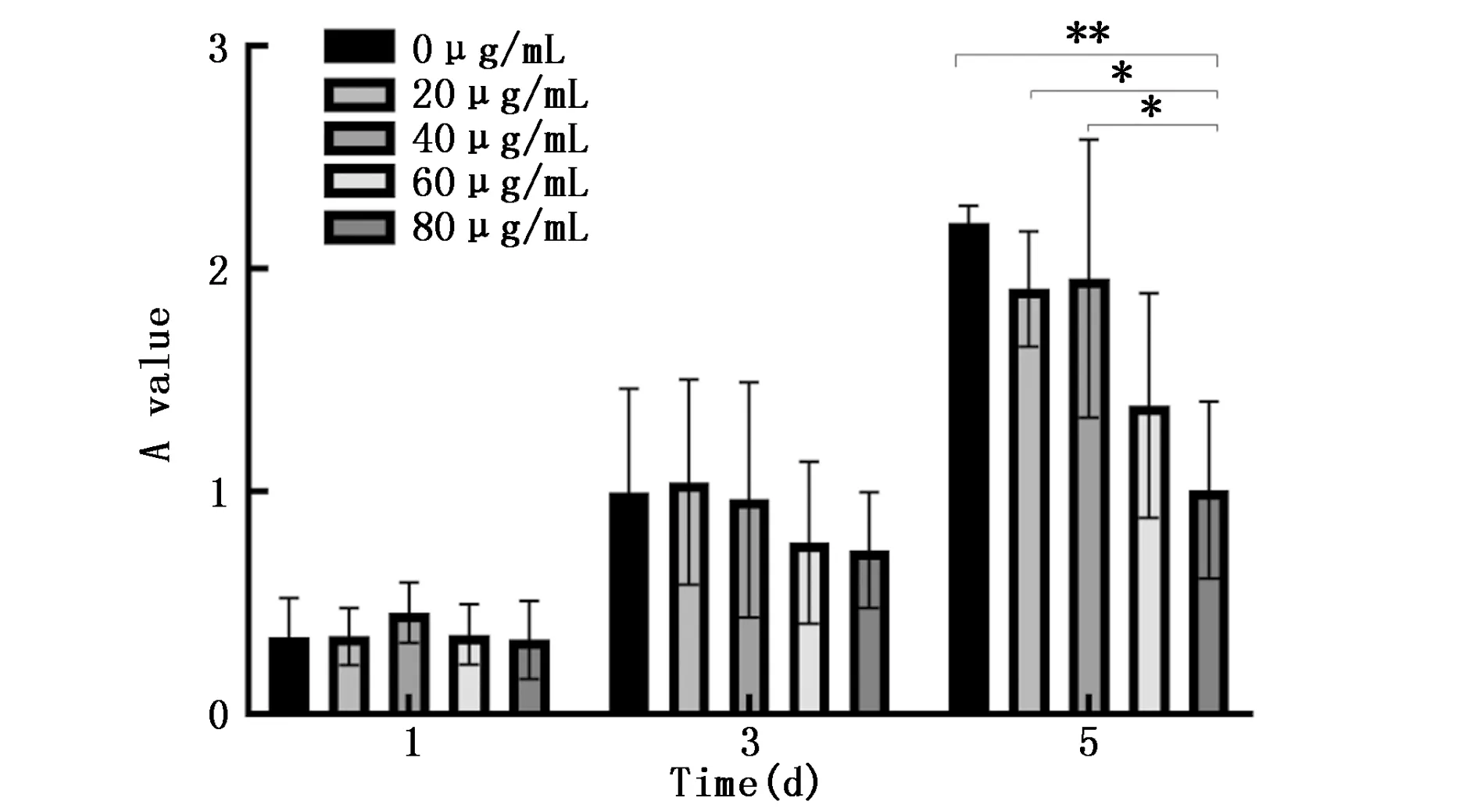
图3 不同浓度的hDPSCs-exo对CAL-27细胞增殖能力的影响
2.4 hDPSCs-exo对CAL-27迁移能力的影响
2.4.1 划痕实验结果 与0 μg/mL组相比,48 h时,划痕面积明显减小且部分区域已有融合,20、60、80 μg/mL组均能促进CAL-27的迁移能力(20、60、80 μg/mL组vs.0 μg/mL组:P=0.019、0.030、0.011),而40 μg/mL组对CAL-27的迁移能力无显著促进作用(P>0.05)(图4)。
2.4.2 Transwell细胞迁移实验结果 与0 μg/mL组相比,20、60、80 μg/mL组能显著促进CAL-27的迁移(20、60、80 μg/mL组vs.0 μg/mL组:P<0.001),40 μg/mL组对CAL-27的迁移无显著促进作用(P>0.05)(图5)。
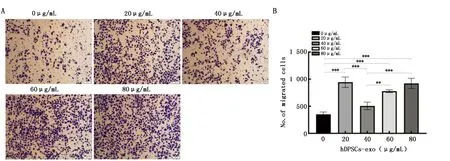
图5 Transwell实验检测hDPSCs-exo对CAL-27细胞迁移能力的影响
2.5 Western blot检测PI3K、P-Akt和Akt的表达
处理48 h后,与0 μg/mL组相比,80 μg/mL组PI3K的表达量升高(80 μg/mL组vs.0 μg/mL组:P=0.019),60、80 μg/mL组P-Akt表达上调(60 μg/mL、80 μg/mL 组vs.0 μg/mL组:P=0.001、0.002),而Akt蛋白表达无统计学差异(P>0.05)(图6)。

图6 Western Blot检测PI3K、P-Akt和Akt的表达
3 讨论
肿瘤微环境(Tumor microenvironment,TME)是指肿瘤产生和生存的环境,除了肿瘤细胞外,还包括炎症细胞、内皮细胞、免疫细胞以及细胞外基质成分等,其产生的细胞外基质和细胞因子能支持肿瘤细胞增殖、血管生成、逃避免疫以及促进侵袭和转移等[12]。TME是致癌的关键因素之一,组分的改变能影响肿瘤的生物学行为。Salo等[13]发现BM-MSCs通过影响TME来诱导与趋化因子、细胞运动和侵袭相关基因的表达从而达到降低口腔鳞状细胞癌的增殖,同时增强侵袭能力。外泌体作为TME的重要组成部分同样能调控肿瘤细胞生物学行为。研究表明,间充质干细胞来源的外泌体对肿瘤细胞增殖、迁移具有双向作用。Wang等[14-15]研究发现脂肪间充质干细胞来源的外泌体能促进乳腺癌细胞的增殖和迁移,抑制细胞凋亡。Gu等[16]研究表明间充质干细胞外泌体通过激活Akt通路从而促进胃癌细胞的生长和迁移。相反地,也有研究表明外泌体对肿瘤的生物学行为具有抑制作用。血源性间充质干细胞来源的外泌体能抑制口腔鳞状细胞癌的血管生成和肿瘤增殖的作用[17]。
近年来,外泌体作为一种细胞间通讯方式逐渐成为研究热点。已有大量研究表明外泌体有可能成为口腔癌早期诊断、治疗靶点的确定和预后判断的重要工具[18-20]。然而,目前关于hDPSCs-exo对肿瘤的相关作用尚不明确,因此本实验从外泌体角度出发,探讨hDPSCs-exo对CAL-27细胞增殖、迁移的影响及其潜在的分子机制。
本研究采用MTT实验评估了hDPSCs-exo对CAL-27细胞增殖能力的影响,结果显示,与0 μg/mL组相比,仅80 μg/mL hDPSCs-exo组在第5天对CAL-27细胞的增殖有抑制作用,其余各浓度组均无显著影响。目前关于外泌体浓度的选择暂无统一标准,有研究表明,外泌体浓度并不是越高作用效果就越佳,而是需要达到适宜浓度或时间点才能发挥其最佳作用,超过一定浓度会导致其作用下降[15,21]。因此,推测hDPSCs-exo在体外达到一定浓度时能抑制CAL-27细胞的增殖,这可能是hDPSCs-exo间接影响了TME或结合PI3K/Akt信号通路其他靶点,从而对CAL-27细胞发挥作用。
PI3K/Akt信号通路根据结构和底物不同将PI3K分为三类,Ⅰ类信号机制目前研究最为透彻且与癌症相关。该信号机制可能是由上游细胞表面受体激活的PI3K,与下游效应因子Akt结合使其磷酸化,从而调控细胞的生长、转移、凋亡以及血管生成等[22-23],在包括口腔鳞状细胞癌在内的多种肿瘤的发生发展中发挥着重要作用[24-25]。Sento等[26]研究表明口腔鳞状细胞癌细胞衍生的外泌体通过激活PI3K/Akt信号通路促进肿瘤细胞的增殖、迁移和侵袭并调节受体细胞的恶性转化。因此,本研究选择了PI3K/Akt信号通路进一步探讨可能的作用机制。Western blot结果显示,实验组(20 μg/mL、60 μg/mL、80 μg/mL组)与0 μg/mL组相比,PI3K和P-Akt的表达量明显升高,表明其作用机制可能与激活PI3K/Akt信号通路有关。
综上所述,hDPSCs-exo高浓度时抑制口腔鳞状细胞癌增殖,可能由于hDPSCs-exo结合了PI3K/Akt信号通路其他靶点、通过影响TME或者间接机制抑制口腔鳞状细胞癌增殖。因此,本研究设想能否将保持适宜浓度的hDPSCs-exo抑制增殖的同时再介入其他的药物或者PI3K/Akt信号通路的抑制剂来抑制癌细胞的迁移,从而抑制口腔鳞状细胞癌的生长来作为口腔鳞状细胞癌的一种新的治疗方式。当然,目前仍有诸多问题有待深入研究,例如是否有其他信号通路参与此生物学过程、在体内是否具有同样的作用等,从而为口腔鳞状细胞癌的治疗提供新的思路。

