多模态MRI评价ⅠB1-ⅡA2期宫颈癌宫旁浸润的应用研究
闵智乾 靳荣辉 陈丽宏 雷晓燕 张鑫 张彬 于娇 蔺莉莉 陈小龙
宫颈癌是妇科常见的恶性肿瘤之一,发病率在女性恶性肿瘤中居第4位,严重威胁女性的生命健康[1]。宫颈癌的预后与分期相关,其中宫旁浸润是决定治疗方式的最主要因素,经临床查体无宫旁浸润且FIGO分期为ⅠB1~ⅡA2期的患者常进行手术治疗。但由于FIGO分期为临床分期,术后病理亦可能发现存在宫旁浸润,因此术前准确判断分期,尤其是准确判断是否存在宫旁浸润非常重要。磁共振成像(MRI)具有软组织分辨力高、多方位及多序列成像的优点,近年来已成为宫颈癌术前评估的重要手段,其中常规平扫应用最为广泛,但其对宫旁浸润的判断存在一定局限性[2-3]。近年来功能磁共振检查技术在宫旁浸润应用逐渐增多,但以往的研究多是基于MRI平扫或者结合一种功能成像技术[4-5],包括扩散加权成像(Diffusion-weighted imaging,DWI)及动态增强MRI成像(Dynamic contrast enhanced MRI,DCE-MRI)在内的多模态MRI研究相对较少。本研究利用多模态MRI对宫颈癌进行检查,以期探讨多模态MRI检查在ⅠB1-ⅡA2期宫颈癌宫旁浸润中的应用价值。
1 资料与方法
1.1 一般资料
收集2015年8月—2021年4月来陕西省人民医院就诊的宫颈癌患者的多模态MRI检查及临床资料。纳入标准:(1)患者均接受根治性子宫切除术,多模态MRI 检查均于术前2周内进行;(2)术后均明确诊断为宫颈癌,且获得完整手术病理结果。排除标准:(1)MRI检查前行介入、放疗或者新辅助化疗;(2)MRI检查前行宫颈锥切、单纯宫颈切除术;(3)MRI图像不全或伪影较大,MRI检查与手术间隔在2周以上者。最终纳入106例患者,年龄23~78岁,平均年龄53.34±6.85岁。其中鳞癌92例,腺癌12例,腺鳞癌2例。术前FIGO临床分期ⅠB1 24例、ⅠB2 14例、ⅠB3 30例、ⅡA1 18例及ⅡA2 20例,术后均常规获取手术病理标本并均获病理结果证实。本研究方案获得了本院医学伦理委员会批准且所有患者在检查前均签署了MRI检查知情同意书。
1.2 MRI检查
采用Philips Ingenia 3.0TMRI扫描仪,使用盆腔相控阵线圈。平扫MRI序列包括矢状位T2WI、冠状位T2WI、轴位T2WI以及轴位T1WI,FOV范围为26 cm×32 cm;功能序列包括轴位DWI(b值分别取0 s/mm2及800 s/mm2)、轴位DCE-MRI和矢状及冠状位增强延迟扫描,扫描及重建层厚、层间距分别为4 mm及1 mm。扫描的主要参数为T2WI:TR/TE4420-4730 ms/70-90 ms;T1WI:TR/TE645 ms/17 ms;DWI:TR/TE 2750 ms/80 ms;DCE-MRI:TR/TE3.1 ms/1.5 ms。
1.3 分组方法及图像分析与判定标准
将MRI图像按照平扫及多模态检查进行分组,由两位研究方向为泌尿生殖影像的高年资放射科医师分别在不告知病理结果及临床相关资料的情况下盲法独立阅片,分期采用国际妇产联合会2018分期[5]。阅片分析内容包括肿瘤位置、大小等形态学特征以及各序列的信号特点、基质环及阴道壁的完整性以及有无宫旁浸润等。所有病理分期均以临床最终分期为参照标准,宫旁浸润以手术病理为标准。
1.4 统计学分析
使用SPSS 19.0软件进行统计分析,两名医师之间的一致性评价采用Kappa检验(κ值)进行分析。配对资料的比较使用配对卡方检验,两组之间判断宫旁浸润的敏感性、特异性、阳性预测值、阴性预测值、诊断准确率的比较采用χ2检验及Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌的MRI表现及宫旁浸润特点
正常宫颈T1WI呈稍低信号,T2WI宫颈由内向外分别显示为高信号粘液、较高信号的粘膜层、低信号基质环及中等信号肌层;而宫颈癌则表现为T1WI等信号,T2WI稍高信号;DCE-MRI早期,正常宫颈强化不明显或轻度强化,而宫颈癌则呈明显强化;增强扫描晚期,正常宫颈肌层明显强化,宫颈癌组织则呈弱强化;DWI(b值=800/mm2)及ADC图上正常宫颈为等低信号,宫颈粘膜DWI呈高信号,ADC呈稍高信号,而宫颈癌则表现为DWI高信号,ADC低信号。宫旁浸润表现为肿瘤组织突破宫颈侵入宫颈旁组织,局部可形成软组织肿块,平扫T2WI常表现为基质环连续性中断,周围脂肪间隙浸润及分界不清,DWI及DCE-MRI表现为与宫颈癌病灶类似的特征,而宫旁水肿或炎性反应则不具有类似特点(图1)。
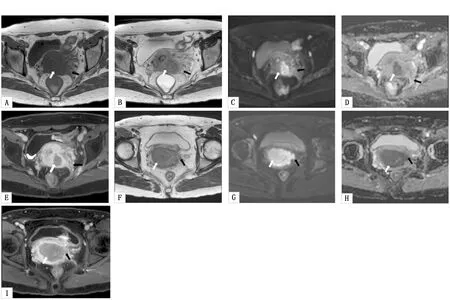
图1 ⅠB1期宫颈癌宫旁炎性反应患者及ⅡA2期宫颈癌宫旁浸润患者的多模态MRI图像
2.2 平扫及多模态MRI对宫颈癌患者宫旁浸润的诊断效果
医师1平扫MRI阳性率高于病理诊断阳性率(30.19%vs.26.42%,P=0.502),医师2平扫MRI阳性率高于病理诊断阳性率(33.02%vs.26.42%,P=0.230)(表1)。医师1多模态MRI阳性率低于病理诊断阳性率(23.58%vs.26.42%,P=0.800),医师2多模态MRI阳性率高于病理诊断阳性率(27.36%vs.26.42%,P=1.000)(表2)。

表1 平扫对宫颈癌患者宫旁浸润的诊断结果

表2 多模态对宫颈癌患者宫旁浸润的诊断结果
2.3 两名医师平扫MRI及多模态MRI判断宫旁浸润的效果比较
以手术病理标本是否存在宫旁浸润为金标准,其中106 例患者中经手术病理证实28例(26.4%)存在宫旁浸润。无论是敏感性、特异性及阳性预测值、阴性预测值及诊断准确率方面,多模态MRI均优于平扫MRI,其中在特异性、阳性预测值及诊断准确率方面有统计学差异(P<0.01);在两名医师之间对宫旁浸润的一致性评价方面,多模态MRI检查之间表现为高度的一致性(κ=0.790),而平扫MRI则表现为中等度的一致性(κ=0.410),多模态MRI在观察者一致性方面优于平扫MRI(表3)。

表3 两名医师平扫及多模态MRI评估宫旁浸润效果比较[n(%)]
3 讨论
宫颈癌扩散的主要途径为直接侵犯和淋巴结转移,其中直接侵犯导致的宫旁浸润是宫颈癌不良预后的重要危险因素之一[6]。无宫旁浸润的患者可行根治性手术切除,一旦有宫旁浸润,常需进行根治性放射治疗[7]。因此术前准确分期,尤其是宫旁浸润的判定对宫颈癌患者非常重要。2018年年底国际妇产联合会公布了FIGO2018新分期系统并随后对其进行了修订[5],因此本研究采用了最新的FIGO分期系统进行研究。由于宫颈癌FIGO分期为临床分期,其分期依赖于临床查体、病理学及影像学检查,其中影像学检查尤其是MRI检查已成为宫颈癌临床分期的重要参考[8-10]。
以往的研究表明,基于T2WI为主的常规平扫MRI检查在诊断宫旁浸润的敏感性为66.7%~80.0%,特异性为70.0%~88.7%[3,11-12]。本研究中两名医师基于常规平扫诊断宫颈癌宫旁浸润的敏感性与特异性与前述大多数研究结果类似。由于宫颈癌患者MRI检查前常有盆腔检查及宫颈活检史,其继发的炎性反应或组织水肿常致邻近结构及宫旁出现T2WI稍高信号,进而导致肿瘤组织与宫旁继发的稍高信号的非肿瘤组织区分困难,从而可能导致不同程度的误判,此外由于宫旁静脉丛呈高及稍高信号,平扫在评判宫旁静脉丛受侵上价值常常有限,因此平扫MRI检查在宫颈癌宫旁浸润的判定上存在一定的局限性,常需结合其它功能检查序列以增加宫旁浸润的诊断准确率[11,13-14]。近年来,以DWI和DCE-MRI为代表的功能检查序列开始应用于临床,其与常规平扫MRI检查联合应用较常规MRI检查具有较明显的优势。DWI通过观察水分子活动受限程度对肿瘤进行识别,进而可以清晰显示病变[15]。DCE-MRI通过快速注射对比剂后进行扫描,观察肿瘤与正常组织或不同病变组织之间的强化差异进而对肿瘤及非肿瘤性病变进行鉴别[16]。目前大多数研究表明DWI在宫旁浸润的诊断价值较高,而DCE-MRI的诊断价值相对有限[17]。但对于DCE-MRI在宫旁浸润的诊断价值以及与其它序列的联合应用价值,目前仍存在较多争议。张洁等[18]研究表明T2WI联合DWI、DCE-MRI或三者联合应用可以增加宫旁浸润的诊断效能,尤其是三者联合应用具有更高的诊断价值,此研究与宫颈癌MRI检查中国专家共识观点类似,表明增强扫描有助于鉴别瘤周水肿及静脉丛所致宫旁浸润的假象,但该研究未对不同医师之间的观察者一致性进行评价[19]。此外尚有其它研究认为三者之间对宫旁浸润的评价无明显差异,但其未对多个序列联合应用进行评价[20]。
本研究利用平扫、DWI及DCE-MRI在内的多模态MRI检查对ⅠB1-ⅡA2期宫颈癌宫旁浸润进行判定,明显提高了影像学检查对宫颈癌宫旁浸润的诊断效能,尤其是在特异性、阳性预测值及诊断准确率方面显示出了优势。观察者一方面可以通过形态学的观察对宫旁浸润进行初步判定,并对宫颈癌进行分期。另一方面可以通过获得DWI及DCE-MRI的量化参数进而对宫旁病变进行量化分析,通过与宫颈正常组织的相应参数进行比较,可以明确判定宫旁组织是否存在侵犯[21-23]。本研究一方面进行了平扫与多模态之间诊断差异性的比较,结果与前述张洁等[18]的研究结果类似,同时本研究在此基础上亦进行了医师之间一致性的评价,提示多模态MRI检查在观察者一致性方面优于平扫MRI检查。本研究发现,基于平扫、DWI及DCE-MRI的多模态MRI检查多个序列联合应用,可以扬长避短,发挥各自序列优势而规避其不足,进而显著提高了MRI对宫颈癌宫旁浸润的诊断能力[24]。
综上所述,多模态MRI检查可以对宫颈癌宫旁浸润做出明确诊断,较常规MRI平扫检查具有更大的优势与诊断准确率,因此在宫颈癌的术前评估中,应常规应用,进而更好地指导临床进行宫颈癌治疗方案的优化与选择。

