蓝藻生消对巢湖沉积物phoD碱性磷酸酶基因细菌群落结构的影响*
孙婷婷,黄 涛**,刘雨昕,孙庆业
(安徽大学资源与环境工程学院,湿地生态保护与修复安徽省重点实验室,合肥 230601)
水体富营养化及其引起的藻华严重危害了淡水资源与人类健康[1-2]. 研究表明,磷是湖泊富营养化乃至藻类生长的主要限制性营养物质之一[3]. 在外部污染排放得到控制的情况下,内源磷通过再循环向水体释放营养盐从而维持藻类的生长[4]. 一项长期调查结果表明,湖泊水体磷的释放及其浓度限制占湖泊富营养化成因的80%[5]. 沉积物向上覆水释放磷是富营养化湖泊磷循环的关键过程[6],目前的研究表明内源磷的释放机制主要为沉积物铁结合磷的还原释放以及有机质的矿化[7-8]. 在高藻量的富营养化湖泊中,酶解以及有机质矿化等代谢过程非常快速,进而可能促进水体的富营养化程度[9].
碱性磷酸酶可以有效驱动磷酸酯类酶解成生物可利用磷,由其介导的有机磷矿化是维持和加速湖泊富营养化的关键[10]. 碱性磷酸酶主要由水生细菌、浮游植物和浮游动物在应对“磷饥饿”困境时所分泌,典型代表就是藻细胞在水体面临磷限制时分泌酶来提高周围磷的可利用程度,从而延续自身的生长[11-12]. 细菌是碱性磷酸酶的主要来源之一,其编码碱性磷酸酶的基因主要有phoA、phoX和phoD;其中,水环境中phoD比phoA和phoX更为丰富[13],可以作为一种监测水生生态系统中编码碱性磷酸酶细菌的多样性和分布的方法. 目前关于湖泊细菌碱性磷酸酶的研究更多关注环境条件对于其胞外活性的影响[14-15],需对微生物矿化有机磷的关键驱动力-碱性磷酸酶编码基因进一步研究.
已有大量土壤和海洋生态系统中编码碱性磷酸酶基因的研究,主要包括施肥、土壤酸碱度以及盐度等对phoD基因群落多样性与分布的影响研究[16-19]. 淡水水生生态系统中已有关于持久性有机污染物对沉积物phoD基因群落的影响[20]、悬浮颗粒物中phoD碱性磷酸酶基因多样性[21]、phoD基因群落在不同季节间的变化[22]、太湖不同区域水体[23]和沉积物[24]phoX碱性磷酸酶基因丰度和多样性比较以及微囊藻水华分解过程中phoX碱性磷酸酶基因动态变化[25]的研究报道;但目前对淡水水生生态系统中编码碱性磷酸酶基因的了解远远不及海洋和土壤生态系统. 蓝藻的生长与消亡会显著影响沉积物-水界面环境变化以及水体磷平衡,从而诱发碱性磷酸酶的释放并参与介导有机质矿化分解、释放营养盐,加速蓝藻的持续暴发. 目前还缺乏对富营养化湖泊蓝藻完整生命周期内phoD基因细菌群落动态变化的研究,这有碍于更好地了解蓝藻的生长与消亡过程中沉积物有机磷矿化过程的微生物驱动机制.
富营养湖泊中有机磷的矿化分解为蓝藻提供营养物质进而支撑蓝藻持续的生长与暴发. 具有编码碱性磷酸酶基因的细菌类群是沉积物有机磷矿化的重要驱动力. 本研究以中国典型富营养化浅水湖泊巢湖为研究对象,分析了蓝藻生长与消亡引起的环境因子、沉积物碱性磷酸酶活性以及具有phoD的细菌群落结构的动态变化,并在此基础上研究了环境因子与沉积物碱性磷酸酶活性、phoD基因细菌群落之间的联系.

图1 巢湖沉积物采样点分布Fig.1 Sampling sites of sediments in Lake Chaohu
1 材料和方法
1.1 研究区概况
作为中国第五大淡水湖的巢湖(31°25′~31°43′N,117°16′~117°51′E)拥有近780 km2的湖泊面积[26],平均水深约3 m,整体水位变幅大[27]. 巢湖位于安徽省中部,随着流域内特别是合肥市人口的增加,城镇化与工农业发展迅速,导致大量生活污水、工业废水排入湖中,使湖水中营养物质浓度骤升从而演变成富营养湖泊[28]. 巢湖富营养化程度以及蓝藻水华呈现区域差异,主要表现为西湖区污染程度高于东湖区,这是由于湖泊外源污染负荷主要来源于西北部[29].
1.2 样品采集与预处理
在2020年11月(蓝藻衰亡期)、2021年1月(蓝藻潜伏期)、2021年4月(蓝藻生长初期)以及2021年7月(蓝藻暴发期)分别对巢湖的9个采样点(图1)进行了上覆水与表层沉积物(0~2 cm)的样品采集. 并在采样的同时现场测定水样的水温(WT)、溶解氧(DO)以及pH. 上覆水样品由有机玻璃采水器采集并用预先清洗过的聚乙烯瓶收集,采样时先测量样点水深,再据此采集沉积物以上约20 cm处水样;沉积物样品由Peterson取样器抓取并使用塑料刀片刮取表层0~2 cm收集到密封袋中. 所有样品立即储存在便携式保温箱中,当天运输至实验室. 一部分新鲜沉积物样品用于碱性磷酸酶的提取;用于DNA提取的沉积物样品在-20℃冷冻;剩余样品冷冻干燥后剔除贝壳及动植物残体,用玛瑙研钵充分研磨混匀过200目(74 μm)筛,编号放置干燥器中待分析. 水样经0.45 μm滤膜过滤后在1~2 d内完成分析.
1.3 样品分析
1.3.1 理化性质分析 巢湖水样pH、DO、WT、烧失量(LOI)、叶绿素a(Chl.a)以及上覆水溶解态无机磷(DIP)已在Sun等[30]报道. 利用分光光度法将对硝基苯磷酸二钠(PNPP)经培养产生的对硝基苯酚(PNP)指征沉积物碱性磷酸酶活性[31]. 沉积物各形态磷通过改进的SMT方法[32]提取,包括总磷(TP)、无机磷(IP)和有机磷(OP),其中OP=TP-IP.
1.3.2 沉积物中DNA的提取 沉积物中DNA的提取参考Zhou[33]的SDS高盐法,将0.5 g沉积物与600 μL DNA提取缓冲液混合,经细胞破碎仪破碎细胞后放入恒温振荡箱培育30 min(37℃、200转/min),加入20% SDS后水浴孵育30 min(65℃),向上清液加入等量的苯酚-氯仿-异戊醇,离心后上水相与PEG-NaCl充分混合后并在4℃下沉淀2 h后离心得DNA样品,将DNA样品与100 μL Tris-EDTA缓冲液混合,-20℃保存.
1.3.3 具有phoD基因细菌的高通量测序 以沉积物中提取的DNA为模板,利用引物ALPS-730F(5′-CAGTGGGACGACCACGAGGT-3′)和ALPS-1101R(5′-GAGGCCGATCGGCATGTCG-3′)[21,34]扩增phoD基因. 具体PCR反应条件为:95℃ 3 min;95℃变性30 s,54℃退火30 s,72℃延伸45 s共35个循环;72℃延伸10 min至温度降至10℃停止. PCR产物经2%琼脂糖凝胶电泳检测后,高通量测序在QIIME(版本1.9.1)(Majorbio Bio Pharm Technology Co.,Ltd, Shanghai, China)上进行. 将序列相似度大于97%的归属为操作分类单元(OTUs). 在nt_v20200604数据库的基础上,采用RDP Classifier (http://rdp.cme.msu.edu/)分析基因序列所对应的菌种类别[35].
1.3.4 数据处理与分析 采用Origin 2018软件对上覆水与沉积物中的理化指标含量作图. 利用SPSS 19.0软件对理化指标相关性进行Pearson相关性分析以及单因素方差分析(One-way ANOVA). 使用QIIME 1.9.1软件 (Majorbio Bio Pharm Technology Co., Ltd, Shanghai, China)对测序数据进行群落多样性、冗余分析(RDA)以及多级物种差异判别(LEfSe)等分析,其中Ace指数用来估算群落中OTU数目,Shannon指数用来估算样本中微生物多样性.
2 结果
2.1 蓝藻生消过程中水体和沉积物中理化指标变化
巢湖沉积物与上覆水各环境理化指标随着蓝藻的生长与消亡发生显著变化(图2). 其中,水体Chl.a浓度变化趋势主要为暴发期>生长初期>衰亡期>潜伏期;空间上,S1~S5点位Chl.a浓度显著高于S6~S9. 整个蓝藻生长与衰亡期,水体pH值呈现先升高后降低的变化趋势;蓝藻生长初期与暴发期水体DO浓度呈持续下降趋势,水体pH值和DO浓度空间变化趋势不显著. 巢湖沉积物LOI变化范围为2.76%~19.68%,表现为暴发期>潜伏期>生长初期>衰亡期;而在空间上主要表现为蓝藻暴发期在S1~S4点位高于S5~S9,其余生长阶段空间变化趋势不明显. 蓝藻生长初期上覆水体DIP浓度以及沉积物IP含量均显著降低而OP含量上升,暴发期DIP浓度以及沉积物IP含量回升,沉积物OP在S1~S3点位上升而在S4~S9点位下降. 空间趋势为S1~S3点位沉积物IP含量高于S4~S9,S6~S9点位沉积物OP含量高于S1~S5;生长初期S1~S5点位上覆水DIP浓度显著高于S6~S9,其余蓝藻生消阶段空间变化趋势不明显.

图2 蓝藻生消过程中巢湖水体和沉积物理化指标变化Fig.2 Variations of physicochemical indexes in overlying water and sediment during the growth and decline of cyanobacteria in Lake Chaohu
2.2 蓝藻生消过程沉积物碱性磷酸酶活性变化
巢湖蓝藻生长与消亡阶段沉积物碱性磷酸酶的活性变化显著(图3),蓝藻生长初期沉积物的APA((65.05±18.11) mg/(kg·h))显著高于潜伏期((31.81±15.51) mg/(kg·h)). 随着蓝藻进一步生长与暴发,APA在暴发期升至(70.71±14.38) mg/(kg·h)),并在蓝藻衰亡期达到最大值((73.62±13.99) mg/(kg·h)). 从空间上看,蓝藻潜伏期、生长初期以及暴发期S4~S9点位沉积物APA高于S1~S3,衰亡期APA空间异质性较强.

图3 巢湖蓝藻生消过程中沉积物APA的变化(图中横坐标上的N、J、A、J依次代表衰亡期、潜伏期、生长初期、暴发期)Fig.3 Variations of APA in sediment during the growth and decline of cyanobacteria in Lake Chaohu(The N, J, A, J on the horizontal coordinate in the graph represent the decline period, benthic period, initial growth period and outbreak period in turn)
2.3 蓝藻生消过程沉积物phoD基因细菌群落丰富度与物种多样性
从沉积物样品中共获得了1385473条phoD碱性磷酸酶基因序列. 基于Ace指数(指示物种丰富度)以及Shannon指数(指示物种多样性)的组间差异检验来评估比较蓝藻不同生命阶段中具有phoD细菌群落的α多样性. 蓝藻生消过程中phoD碱性磷酸酶基因的丰富度和物种多样性发生了显著的变化(图4). 总体上,蓝藻潜伏期的Ace丰富度指数、Shannon多样性指数与生长初期、暴发期差异显著. 其中Ace与Shannon指数分别在生长初期与暴发期达到最大值.
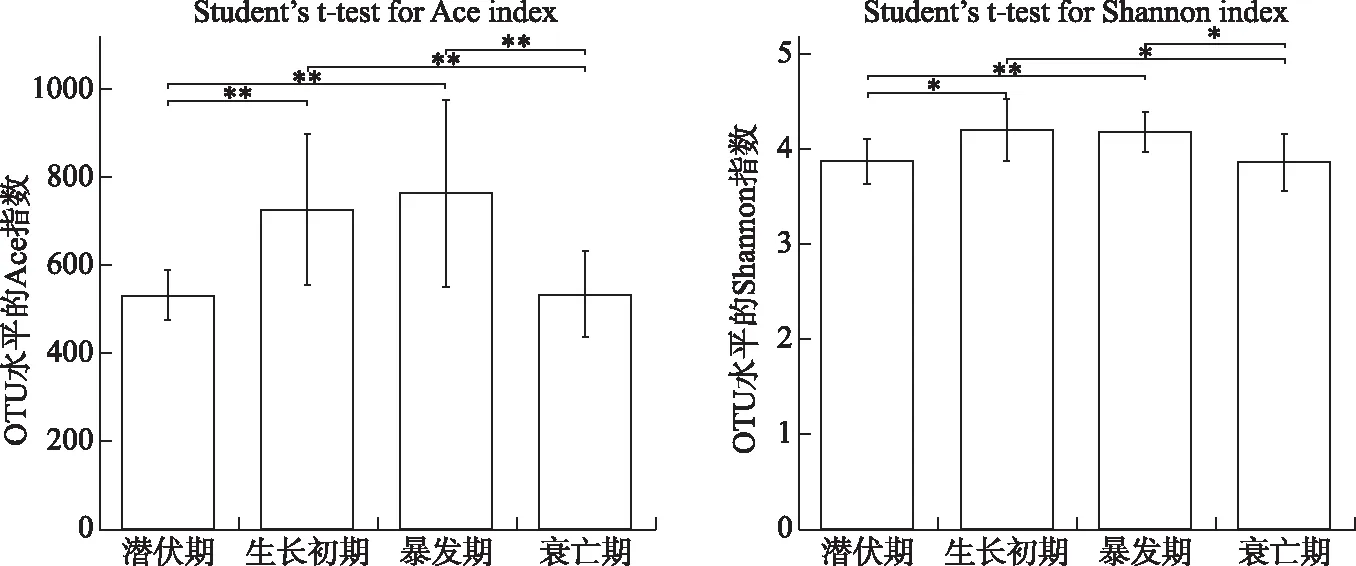
图4 蓝藻生消过程沉积物phoD基因细菌群落Ace与Shannon多样性指数变化(*表示P≤0.05,**表示 P≤0.01) Fig.4 Variations of Ace and Shannon diversity index of phoD-harboring bacterial community in sediment during the growth and decline of cyanobacteria(P≤0.05 is marked as*; P≤0.01 is marked as**)
2.4 蓝藻生消过程沉积物phoD基因细菌群落结构组成
测序结果在门和属水平上的分类结果如图5所示. 所有样品中,具有phoD细菌的群落在门水平上的优势菌门为放线菌门(Actinobacteria),占总序列的48%~94%;其次还有变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)以及芽单胞菌门(Gemmatimonadetes)(图5A). 在蓝藻生消过程中,所有样品中具有phoD基因的细菌群落组成在门水平上的分布具有一定的时空差异性,其中除了S9点位Actinobacteria在潜伏期有一个显著降低的趋势外,其余点位细菌群落分布相似且相对丰度变化差异不显著. 在属分类水平上,20个最丰富属的相对丰度如图5B所示. 其中Pseudonocardia、Friedmanniella、Actinoplanes以及Amycolatotopsis占phoD基因细菌群落比例较大. 且蓝藻生长与消亡期间,phoD基因细菌群落在属水平上的相对丰度变化显著. 相比于蓝藻潜伏期,Pseudonocardia相对丰度在生长初期与暴发期显著下降而后在衰亡期显著升高. 其中,生长初期各点位Pseudonocardia丰度均显著下降,而在生长初期至暴发期除S1、S2以及S3点位相对丰度升高外,其余点位均下降. 蓝藻生消过程中,Friedmanniella主要呈现先上升后降低的趋势. 除S3和S7点位外,其余点位Friedmanniella在潜伏期与衰亡期相对丰度极低,而在生长初期和暴发期显著升高. 相对丰度较低的菌属如Actinoplanes、Amycolatopsis和Bradyrhizobium等均在蓝藻不同生命周期阶段呈现显著的变化趋势,对于大多数点位,生长初期与暴发期Actinoplanes、Amycolatopsis和Bradyrhizobium的相对丰度显著高于潜伏期与衰亡期.

图5 蓝藻生消过程沉积物phoD基因细菌群落在门水平上(A)与属水平上(B)的相对丰度(图中横坐标上的N、J、A、J依次代表衰亡期、潜伏期、生长初期、暴发期)Fig.5 The relative abundance of phylum (A) and genus (B) of phoD-harboring bacterial community in sediment during the growth and decline of cyanobacteria(The N, J, A, J on the horizontal coordinate in the graph represent the decline period, benthic period, initial growth period and outbreak period in turn)
2.5 蓝藻生消过程沉积物碱性磷酸酶活性和phoD基因细菌群落与理化指标的关系
沉积物碱性磷酸酶活性与上覆水WT、pH以及沉积物OP含量呈显著正相关(P<0.01),而与上覆水DO、DIP含量以及沉积物中IP含量呈显著负相关(P<0.01)(图6).

图6 蓝藻生消过程中碱性磷酸酶活性与环境因子的相关性分析Fig.6 Pearson’s correlation coefficient of alkaline phosphatase activity and environmental factors during the growth and decline of cyanobacteria
基于测序得到的OTUs,在OTU水平上利用RDA分析了环境因子[30]与phoD基因细菌群落变化的内在联系,并利用蒙特卡罗排列检验显著性. RDA结果表明,RDA1与RDA2分别解释了phoD基因细菌群落变化的41.92%和22.03%(图7A). 其中,APA、DO、Chl.a、水温、TP以及IP是对沉积物中phoD基因细菌群落影响最显著的环境变量. 将属水平phoD基因细菌与环境因子进行RDA分析,结果表明RDA1与RDA2共解释属水平细菌丰度变化的51.61%. LEfSe分析表明蓝藻潜伏期、生长初期、暴发期以及衰亡期的主要功能菌属分别为Pseudonocardia、Friedmanniella、Gemmatirosa以及Rubrobacter.

图7 巢湖蓝藻生消过程中沉积物phoD基因细菌群落(属水平)(A)(CH_1_1~CH_1_9: 潜伏期样点1~9;CH_4_1~CH_4_9: 生长初期样点1~9;CH_7_1~CH_7_9: 暴发期样点1~9;CH_11_1~CH_11_9: 衰亡期样点1~9)以及phoD基因细菌(B)与环境因子(数据引自Sun等[30])的RDA分析(-C: 沉积物;-J: 间隙水)以及LEfSe分析(C)Fig.7 The RDA of phoD-harboring bacterial community (genus) (A) (CH_1_1-CH_1_9: sample sites 1-9 in benthic period;CH_4_1-CH_4_9: sample sites 1-9 in initial growth period;CH_7_1-CH_7_9: sample sites 1-9 in outbreak period;CH_11_1-CH_11_9: sample sites 1-9 in decline period)and phoD-harboring bacterias (B) with environmental factors (data from Sun et al. [30]) (-C: sediment;-J: pore water) and LEfSe analysis (C) in sediment during the growth and decline of cyanobacteria
3 讨论
3.1 蓝藻生消对沉积物-水界面理化因子和碱性磷酸酶活性的影响
以往对巢湖蓝藻水华情况的调查研究表明,巢湖水体蓝藻在3月开始复苏而在11月开始衰亡下沉,每年5月底-10月初是蓝藻水华的高发期[36-37]. 水温与营养物质是诱发蓝藻暴发的2个重要因素,本研究中随着水温上升,Chl.a浓度持续升高,直至11月初Chl.a浓度呈现降低趋势(图2),各季节Chl.a浓度均符合所对应的蓝藻生消阶段. 巢湖西部湖区富营养化程度高于东部湖区[37],S1~S5点位水体Chl.a浓度显著高于S6~S9;S1~S3点位靠近合肥市区,主要污染源为工业废水和生活污水,IP含量较高[38],而S6~S9点位污染源主要是农业面源污染,OP含量较高[39]. 蓝藻生长与消亡伴随着沉积物-上覆水界面各形态磷含量显著变化[30]. 蓝藻的生长消耗水体和沉积物中大量的磷酸盐[40-41],导致生长初期上覆水体DIP含量显著降低和沉积物中IP的释放,蓝藻沉降又导致沉积物中LOI和OP含量上升(图2). 而在暴发期,上覆水体DIP浓度上升以及沉积物中IP含量上升,OP在S4~S9点位含量下降(图2)而在S1~S3点位上升,指示暴发期巢湖S4~S9点位大量藻体碎屑的沉降导致磷沉积趋势大于释放趋势,且有机磷矿化明显,从而显著提高了水体中的可利用磷浓度,这与Bao等[42]研究结果一致,藻源有机质的矿化是支撑蓝藻进一步暴发的重要驱动力. 而S1~S3点位主要以硫酸盐还原生成硫化物所介导的化学铁还原造成的铁磷释放所主导[30];西部湖区水体Chl.a浓度高,暴发期蓝藻沉降导致S1~S4点位的LOI高于S5~S9. 巢湖蓝藻的生长与消亡显著改变了上覆水体中pH值与DO浓度(图2),蓝藻光合作用吸收水体溶解性CO2,致使pH值显著上升;而藻类衰亡时呼吸作用大于光合作用,释放的CO2以及有机酸是蓝藻衰亡期pH降低的主要原因. 上覆水DO浓度随蓝藻的生长与暴发而降低,主要由于蓝藻生长形成水华阻断复氧以及死亡分解消耗水体和沉积物中的O2.

3.2 巢湖蓝藻生消对沉积物phoD基因细菌群落的影响
尽管已有关于土壤中多种环境条件下phoD基因细菌群落的变化[48-49],但淡水湖泊沉积物中其随蓝藻的生长与消亡的动态变化仍不清楚. 随着水华的持续以及水温的升高,巢湖沉积物微生物群落的多样性显著提高[50]. 本研究中,蓝藻的生长与暴发显著提高了phoD基因细菌群落的α多样性,这一结果可能与升高的碱性磷酸酶活性有关. Zhang等[51]研究发现雨季南淝河沉积物细菌α多样性显著高于旱季. 本研究中蓝藻生长与暴发期处于雨季,降水伴随着附着细菌的外来颗粒物沉降在沉积物上,导致沉积物微生物多样性增加. 同时,研究表明细菌多样性与藻类密度呈比例增加[52]. 综上,蓝藻生长与暴发期间α多样性升高主要是由于春、夏季降水量与藻密度的增加.
蓝藻生长与暴发期沉积物phoD基因细菌群落结构发生显著变化(图5). 整体而言,Actinobacteria是门水平上最丰富的细菌类群,这与土壤以及湖泊沉积物中的结果一致[21,53]. 虽然蓝藻生消对Actinobacteria门的相对丰度影响不显著(图5),但对该门某些属如Pseudonocardia、Friedmanniella、Actinoplanes以及Amycolatotopsis的相对丰度有显著影响. Bao等[54]对巢湖沉积物中特定功能的微生物群落研究表明,在藻华的不同阶段,N、S、Fe、P相关微生物分布呈显著变化,主要归因于水温、DO、N、P等环境因子的联合作用. 本研究RDA分析表明APA、DO、Chl.a、水温、TP以及IP等对沉积物中phoD基因细菌群落的变化有正向贡献(图7a). 研究表明水温会影响浮游生物的数量及其群落结构[55],且水温升高会导致微生物活性增加[56]. 本研究中,与水温较低的蓝藻衰亡期与潜伏期相比,生长初期与暴发期phoD基因细菌各菌属相对丰度发生显著变化. DO是细菌尤其是需氧菌生长重要的环境因子之一,其浓度变化会显著影响细菌群落结构[21,57]. 本文RDA结果表明,指示藻类生物量的Chl.a同样是影响phoD基因细菌群落结构的主要因素,也有研究表明Chl.a是调节太湖细菌群落结构[58]以及悬浮颗粒物phoD基因细菌群落结构[21]的主要环境因子. 本研究沉积物TP含量与IP含量对phoD基因细菌群落结构影响显著,主要是因为水生细菌以及浮游动植物分泌碱性磷酸酶会受到环境中磷含量的影响[11-12]. 值得注意的是,APA是对于phoD基因细菌群落变化解释量最大的环境因子(图7A). 有研究表明,潜在的APA可能是由phoD基因细菌群落直接调控的[50]. 综上,蓝藻生消过程中APA、DO、Chl.a、水温、TP以及IP的变化影响了phoD基因细菌群落的结构.
Pseudonocardia为好氧菌属,受到DO浓度的显著影响[59]. 本研究中Pseudonocardia相对丰度在生长初期与暴发期显著降低(图5B),指示蓝藻生长与死亡致使生长初期与暴发期DO浓度显著降低从而限制了Pseudonocardia的生长. 大多数点位蓝藻生长期与暴发期Friedmanniella以及Actinoplanes相对丰度显著高于潜伏期与衰亡期,这些细菌主要受到 Chl.a浓度的影响(图7B),指示蓝藻的生长与暴发促使了Friedmanniella以及Actinoplanes丰度升高. LEfSe分析表明,蓝藻生长初期主要功能菌属为Friedmanniella(图7C). 其中Friedmanniella在蓝藻生长初期与暴发期丰度较高且与 Chl.a浓度呈显著正相关而与上覆水DIP浓度呈显著负相关(图7B),即生长初期蓝藻的生长显著诱发了Friedmanniella的活性继而释放碱性磷酸酶来缓解磷限制.
4 结论
巢湖蓝藻生消过程中沉积物APA呈显著动态变化. 蓝藻生长导致了水体DIP浓度显著下降以及pH的上升,并诱发碱性磷酸酶的活性. 微生物群落分析表明蓝藻生长过程中phoD基因细菌群落α多样性显著升高. 蓝藻衰亡期与潜伏期沉积物phoD基因优势菌属为Pseudonocardia,生长初期与暴发期Pseudonocardia丰度显著降低而Friedmanniella、Actinoplane和Bradyrhizobium丰度升高且优势菌属由Pseudonocardia和Friedmanniella构成. 蓝藻生消期间各phoD基因细菌菌属丰度变化显著,呈现了较高的时空异质性. RDA结果表明phoD基因细菌群落结构的变化主要受APA、DO、Chl.a、水温、TP以及IP的驱动,即蓝藻生消显著影响了理化因子的浓度进而驱动了phoD基因细菌群落结构的变化. 本研究加深了对富营养化湖泊蓝藻生消过程环境因子与APA和具有其编码基因的细菌群落的内在联系的认识.

