新型光触发一氧化氮供体的设计与合成*
易静雯,刘艾文,黄 甜,李贇贇,黄 佩,王 芹,李 玟,张晟瑞
(陕西理工大学化学与环境科学学院,陕西 汉中 723000)
一氧化氮(NO)是由NO聚合酶内源性的合成,广泛存在于哺乳动物组织和细胞中,它在心血管系统、中枢神经系统以及免疫系统中都不可或缺[1]。然而,任何事物都具有两面性,过量的NO会产生毒副作用,从而导致细胞死亡。因此NO的精准释放和量的控制对于实现其医学、药理作用非常重要[2]。NO供体是一种在生物体内经过简易酶解或其他作用后释放出NO的化合物,它在储存、运输NO的同时能有效地克服它寿命短、半衰期短等缺点,其能够自发地或是在施加合适的刺激(即温度、pH、光)时从特定的分子和大分子支架中释放NO。其中,光照是一种无创调控NO释放的手段,具有时空控制和照射波长/强度可调等优点[3]。目前,设计一个可以在活细胞中通过光触发来精准释放NO且具有高NO含量的供体仍然是一个巨大的挑战。
近年来,国内外有关课题组设计合成了多种NO供体。例如,Zhang等[4]开发了一种由上转换纳米粒子(UCNPs)作为光响应核,介孔二氧化硅作为光敏剂构建的纳米平台,由近红外光响应,按需释放NO治疗和光动力疗法,用于协同治疗难治性角膜炎。该供体在808 nm的近红外光照射后,核壳结构的纳米平台将近红外光子转换为紫外光,以触发基于7-氨基-4-甲基香豆素的NO供体释放NO。Shen等[5]开发了一种可以在体外根除铜绿假单胞菌生物膜,并在体内治疗皮肤脓肿的NO供体。该供体以香豆素为荧光团,在钯(II)四苯基四苯并卟啉的存在下,可以在630或700 nm的深红光照射下激活328 nm处具有最大吸光度的NO供体,从而通过光解催化并以8%的光解量子产率释放NO。Sortino等[6]报道了一种通过可见蓝光激活的NO供体。该供体以氨基硝基苯并呋喃为显色骨架,在溶液中以0.15的量子产率释放NO,释放前后发色部分的荧光发射的对比大于10,容易实时且定量的释放NO。Parisi等[7]设计并合成了一种靶向DNA释放NO的供体。该供体将吖啶橙通过烷基间隔基与N-亚硝基苯胺衍生物共价连接。仅在绿光刺激下释放NO,在黑暗中停止,并在绿光再次打开时重新开始。其中,吖啶橙部分的通过外部和部分插入方式与DNA结合,这种与生物聚合物的双模结合作用允许NO在DNA附近以以自由分子类似的效率生成。Shen等[8]合成了一种水溶性的荧光NO供体。568 nm处红色荧光随着525 nm的照射而增加,该供体以罗丹明作为荧光团,引入N-亚硝基作为NO释放单元,亲水吗啉基团不仅提高了NO供体的水溶性,还作为定位基团可靶向定位溶酶体。这为了解溶酶体中NO的生物学效应提供了良好的平台。
氨基喹啉因为具有独特的共轭结构以及光学特性,使得大部分氨基喹啉类衍生物的溶液都能表现出比较强的荧光。同时含有氨基和三氟甲基的喹啉具有强的分子内电荷转移荧光,并具有大的斯托克斯位移。基于以上,本文以7-氨基-4-(对甲苯基)-2-(三氟甲基)喹啉为荧光团,设计合成了N-亚硝基化的新型NO供体TQ-NO。
1 实 验
1.1 试剂与仪器
荧光分光光度计(F-4600),日本日立公司;紫外分光光度计(UV-2600),日本岛津公司;型手持紫外检测灯(F-7A),上海光豪分析仪器有限公司;核磁共振波谱仪(600 MHz),德国布鲁克公司;质谱仪(micrOTOF-QⅡ型),德国布鲁克公司。
4,4,4-三氟-1-(4-甲苯基)-1,3-丁二酮(5 g),阿拉丁公司,其它化学试剂均为AR试剂。
1.2 供体TQ-NO的合成

图1 TQ-NO的合成路线Fig.1 Synthesis route of TQ-NO
荧光团AQ的合成[9]:合成路线如图1所示,取间苯二胺(0.5 g,4.63 mmol)、4,4,4-三氟-1-(4-甲苯基)-1,3-丁二酮(1.0 g,4.63 mmol)溶于15 mL的CHCl3中,80 ℃下冷凝回流36 h后蒸发浓缩得到粗品。用氯仿重结晶后,用石油醚:乙酸乙酯:甲醇=20:1:1为洗脱剂柱层析分离纯化得到黄绿色固体AQ。1H NMR (600 MHz, CDCl3)δ(ppm) 8.04 (d,J=8.0 Hz, 2H), 7.93~7.91 (m, 1H), 7.86 (s, 1H), 7.35~7.33 (m, 3H), 7.06~7.04 (m, 1H), 4.16 (s, 2H), 2.43 (s, 3H). HRMS:m/zcalcd for C17H13F3N2[M+H]+: 303.11017; found: 303.11036。
TQ的合成[10]:合成路线如图1所示,取AQ(0.64 g,2.12 mmol)、K2CO3(0.4 g)和NaI(0.04 g)溶于20 mL的无水乙腈中,常温搅拌15 min后加入7 mL溴乙酸叔丁酯,82 ℃下冷凝回流54 h后使用60 mL乙酸乙酯、水进行萃取/反萃取3次,以石油醚:乙酸乙酯:甲醇=20:1:1为洗脱剂,柱层析法分离纯化得到亮黄色固体TQ。1H NMR(600 MHz, CDCl3)δ(ppm)8.04(d,J=8.0 Hz, 2H), 7.90(d,J=9.0 Hz, 1H), 7.84 (s, 1H), 7.34(d,J=7.9 Hz, 2H), 7.16 (s, 1H), 7.04~7.06(m, 1H), 4.84(s, 1H), 3.97(d,J=4.5 Hz, 2H), 2.44(s, 3H), 1.53 (s, 9H). HRMS:m/zcalcd for C23H23F3N2O2[M+H]+: 417.17847; found: 417.17844。
TQ-NO的合成[11]:合成路线如图1,取TQ(0.5 g,1.2 mmol)溶于25 mL乙酸中,避光条件下少量多次加入NaNO2固体。在冰水浴中搅拌6 h后加入15 mL蒸馏水,避光条件下抽滤并将沉淀用水洗涤三次,以石油醚:乙酸乙酯:甲醇=100:1:1为洗脱剂,柱层析法分离纯化得到亮黄色固体TQ-NO。1H NMR (600 MHz, CDCl3)δ(ppm) 8.24 (d,J=9.11, 1.4 Hz, H), 8.19~8.15 (m, 2H), 8.13~8.07 (m, 3H), 7.41~7.34 (m, 2H), 4.75 (s, 2H), 2.46 (s, 3H), 1.47 (s, 9H). HRMS:m/zcalcd for C23H22F3N3O3[M+H]+: 445.16477; found: 446.16556。
1.3 实验方法
将一定量的TQ-NO溶于二甲基亚砜中作储备液(1 mmol/L)。在10 mL比色管中依次加入500 μL的磷酸盐缓冲溶液(pH=7.4)、100 μL储备液,用水定容至5 mL,摇匀后取部分于比色皿中测定其紫外吸收及荧光发射(激发波长为360 nm)。然后用365 nm的便携式紫外灯照射比色皿,间隔一定时间测量数次。激发/发射狭缝为5.0 nm/5.0 nm。
2 结果与讨论
2.1 荧光光谱的变化
光控NO供体经光触发后裂解,释放出NO,荧光恢复。图2是TQ-NO释放NO的路径示意图。图3为光诱导TQ-NO释放NO的荧光发射谱图。照射前,荧光信号十分弱,在365 nm紫外灯照射后,431 nm处的荧光信号随着照射时间增加而逐渐升高(图3a),在40 min后趋于稳定(图3b)。
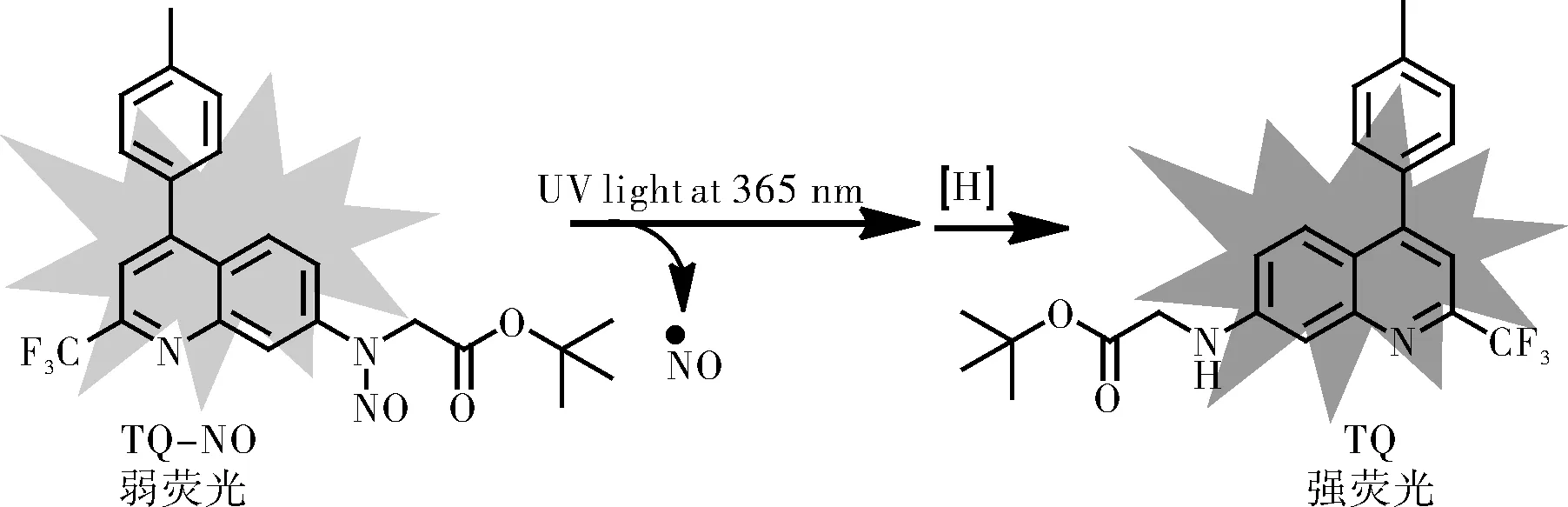
图2 TQ-NO释放NO的示意图Fig.2 Schematic diagram of NO release from TQ-NO
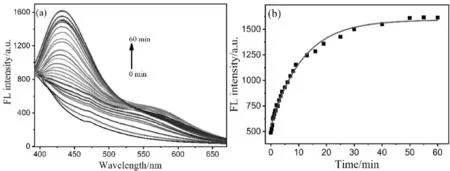
图3 365 nm 紫外光照射后TQ-NO的荧光发射(a)及动力学(b)谱图Fig.3 Fluorescence emission (a) and kinetic(b) spectra of TQ-NO after UV irradiation at 365 nm
2.2 吸收光谱的变化
图4为TQ-NO释放NO的紫外吸收谱。供体TQ-NO的最大吸收在285 nm处,随着365 nm紫外光持续照射,285 nm以及366 nm处的吸收值都逐渐降低(图4a),在40 min左右达到稳定(图4b),与荧光发射光谱所得到的结果一致。
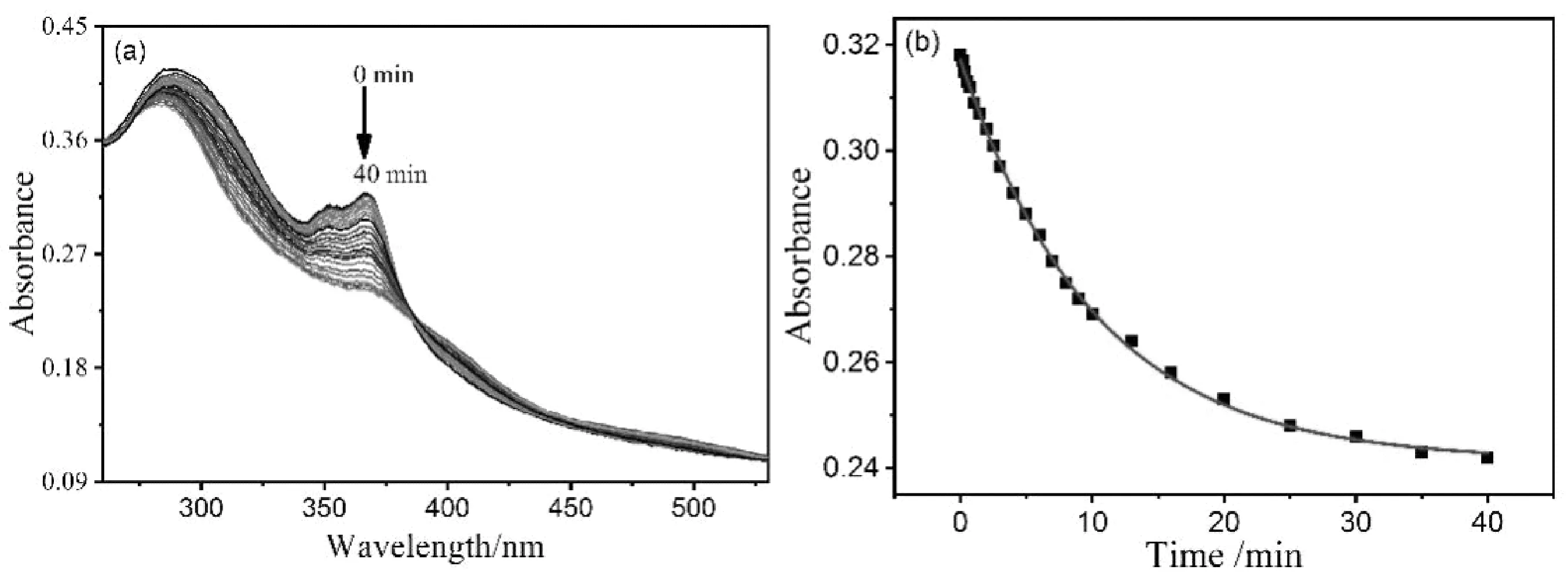
图4 365 nm 紫外光照射后TQ-NO的吸收(a)及动力学(b)谱图Fig.4 Absorption (a) and kinetic(b) spectra of TQ-NO after UV irradiation at 365 nm
2.3 干扰性能测试
供体TQ-NO溶液中加入不同干扰离子后,荧光强度随时间的变化,如图5所示(测量时干扰离子浓度均为0.25 mmol/L)。结果表明,一些还原性物质可以加快供体释放NO的速率,其中,加入亚硫酸钠和亚硫酸氢钠后最为明显。
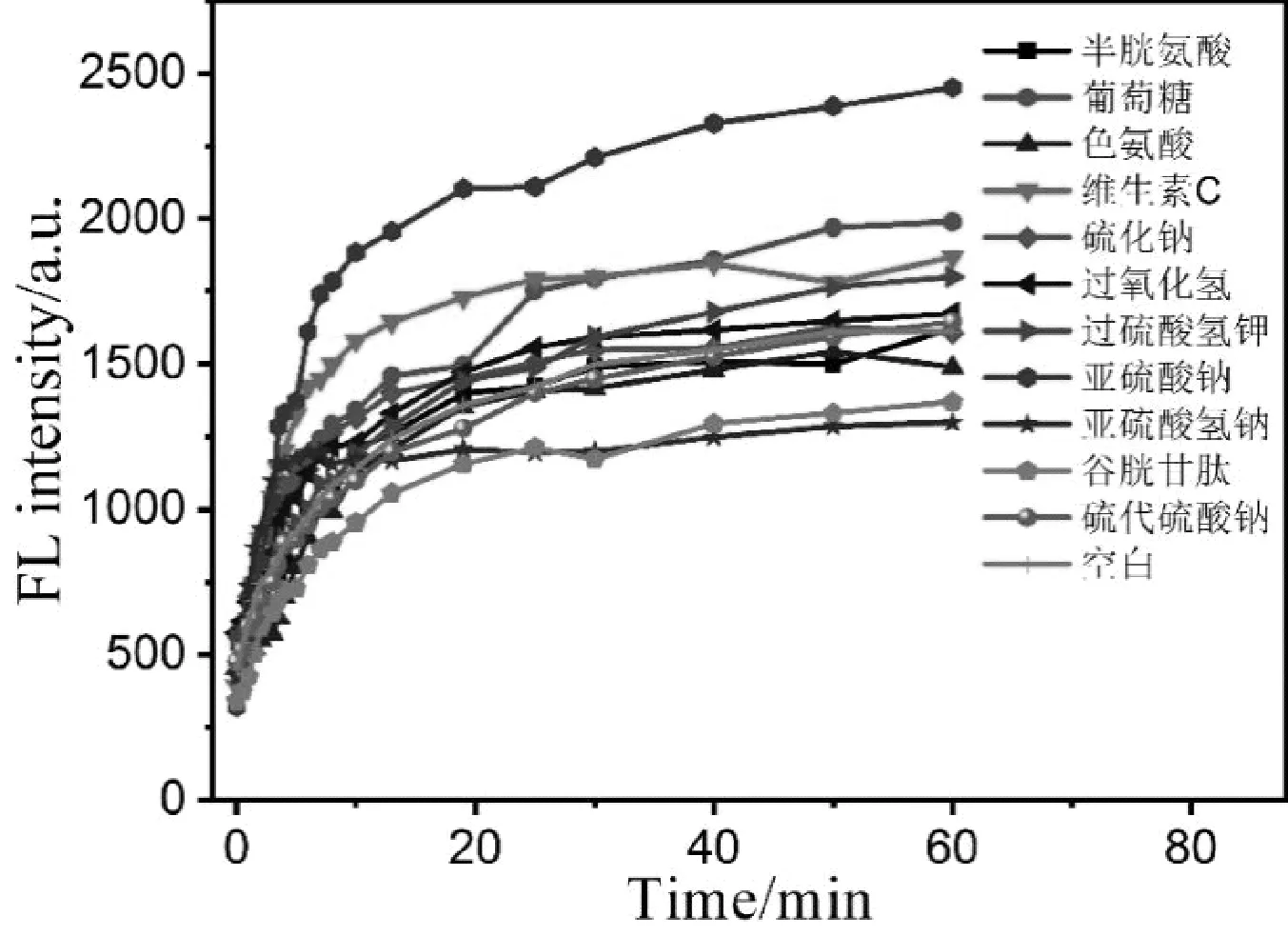
图5 加入不同离子后溶液荧光强度变化图Fig.5 Fluorescence intensity change diagram of solution with different ions
3 结 论
本文设计合成了一个新型光控NO供体TQ-NO。该供体由7-氨基-4-(对甲苯基)-2-(三氟甲基)喹啉为荧光团,具有良好的荧光性能。TQ-NO本身无荧光信号,在365 nm的紫外光照射下快速释放出NO,同时荧光信号增强,可通过荧光信号的变化去实时监测NO的释放量。与已有的NO供体相比,TQ-NO具有良好的光控性和抗干扰性等优点。

