5个品种白羽肉鸡大肠杆菌耐药差异分析
周倩,唐梦君,张小燕,陆俊贤,唐修君,高玉时
(江苏省家禽科学研究所,江苏扬州 225125)
0 引言
【研究意义】大肠杆菌(Escherichia coli)又称大肠埃希菌,属于革兰氏阴性菌,作为人类和动物的主要共生菌无处不在。大肠杆菌血清型复杂,交叉免疫保护力低,兽医临床表现为大肠杆菌性败血症、输卵管炎症及腹水征等多种病型(李迎晓等,2020);人类感染发病通常表现为恶心呕吐和腹痛腹泻等,严重者可导致水电解质紊乱,甚至休克(Poolman and Wacker,2016)。抗生素在治疗传染性疫病时发挥着重要作用,但随着治疗抗生素种类的增加及临床不合理使用抗菌药物,促使大肠杆菌耐药程度及多重耐药问题日益突出,导致其防治效果不容乐观(Christaki et al.,2020;陈良等,2021)。因此,开展大肠杆菌流行病学及耐药性监测,对指导动物健康养殖和人类公共卫生安全均具有重要意义。【前人研究进展】大肠杆菌耐药性与其分离宿主关系密切,禽源和猪源大肠杆菌的耐药性通常高于牛源大肠杆菌(de Jong et al.,2009;Ewers et al.,2009);耐药性与不同国家或地区的抗生素使用情况也有关,如美国禁用氟喹诺酮类抗生素,大肠杆菌耐药率低于5%,而中国、欧盟和巴西大肠杆菌对氟喹诺酮类药物的耐药率超过40%(Nataliya et al.,2019)。大肠杆菌的耐药机理包括广谱β-内酰胺酶编码β-内酰胺类抗生素耐药、碳青霉烯酶编码碳青霉烯类抗生素耐药、16S rRNA甲基化酶编码氨基糖苷类抗生素耐药、质粒介导的喹诺酮类耐药及mcr基因编码多黏菌素耐药性等(Poirel et al.,2018);大肠杆菌广谱耐药性的发生可能是由耐药基因转移介导,如blaCMY-2和blaSHV-12可通过Inc1/ST12质粒进行基因水平传播(Castellanos et al.,2017)。此外,大肠杆菌获得外源耐药基因的方式可通过捕获游离DNA进行转化、通过噬菌体DNA进行转导或由一些位于转座子、质粒或整合子上的抗性基因介导水平或垂直传播(da Silva and Mendonça,2012)。金文杰(2006)对江苏省5个不同地区家禽病料进行分离共获得500株大肠杆菌,且19种抗生素的药敏检测结果显示有89.3%大肠杆菌分离株能耐受8种以上的抗生素;Johnson等(2010)对美国大肠杆菌分离株耐药性进行调查,结果显示约有70.0%大肠杆菌对氟喹诺酮类药物产生耐药性,且55.0%大肠杆菌同时对氟喹诺酮类和磺胺类产生耐药性;董向磊(2014)对江苏大肠杆菌分离株的耐药性进行检测,结果发现大肠杆菌多重耐药问题日趋严重,尤其是南通、常州和泰州等地的分离株多重耐药率高达100%;胡林(2015)对华东部分地区的禽源大肠杆菌分离株进行耐药性测定,发现对β-内酰胺类氨苄西林及磺胺类药物的耐药率较高,分别为93.5%和81.8%,对氨基糖胺类药物阿米卡星的耐药率最低,仅为23.4%;Tong等(2018)对我国18个省份的大肠杆菌耐药性测定结果表明,分离株对头孢噻呋和丁胺卡那的耐药率较低,而对四环素、多西环素和氟苯尼考的耐药率超78.0%;李蕴玉等(2019)发现秦皇岛地区和唐山市鸡源大肠杆菌分离株对β-内酰胺类药物的耐药率高达100%。可见,动物源大肠杆菌耐药性的增强已对公共卫生产生严重威胁,亟待加强动物源细菌耐药性监测。【本研究切入点】白羽肉鸡属于快大型肉鸡品种,具有生长速度快、料肉比低等特点,在家禽产业中占据重要地位(黎寿丰等,2017;黄洪武,2020)。治疗肉鸡细菌性疾病的常用抗菌药物包括β-内酰胺类、氨基糖苷类、氟喹诺酮类、大环内酯类和四环素类等,耐药性监测工作对防治细菌耐药性的产生,以及保障社会公共安全和食品安全均具有重要意义,但现有研究主要是针对养殖过程中的耐药性监测,品种差异是否存在耐药性差异鲜见文献报道。【拟解决的关键问题】对5个品种白羽肉鸡[3个为我国自主选育配套系(广明2号、圣泽901和WOD168),2个为江苏养殖量较大的国外引进品种(科宝肉鸡和AA+)]开展养殖过程中大肠杆菌流行病学研究及耐药性差异情况调查,旨在了解不同品种肉鸡大肠杆菌耐药现状及其差异,获得针对性的防治措施,为科学指导肉鸡相关疾病诊治和兽药监管提供参考依据。
1 材料与方法
1.1 试验动物与饲养管理
饲养地点设在国家家禽生产性能测定中心(扬州)。试验前对鸡舍进行全面杀菌消毒,各种器具设备如饲料桶和拌料设备使用前后清洁消毒。选用5个品种白羽肉鸡作为研究对象,分别为广明2号(A)、科宝肉鸡(B)、圣泽901(C)、AA+(D)、WOD168(E)。每个品种360羽,2个重复(G1和G2),各180羽。饲养方式:0~14日龄为四层立式笼养,饲养密度15~35羽/m2;15~42日龄采取网上平养,饲养密度6羽/m2。根据鸡饲养标准(NY/T 33-2004)进行常规饲喂和疫苗防疫,全程未给药。
1.2 主要试验试剂及仪器设备
麦康凯琼脂、LB琼脂和LB肉汤购自青岛海博生物技术有限公司;20×PBS和50×TAE购自北京索来宝科技有限公司;75%医用消毒酒精购自德州名德消毒科技有限公司;Speed STARTMHS DNA聚合酶和DL2000 DNA Marker购自宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒购自生工生物工程(上海)股份有限公司;药敏纸片购自英国Oxoid公司。主要仪器设备:生化培养箱(HPS-150,太仓市华美生化仪器厂)、高压灭菌锅(SANYO MLS-3750,日本)、离心机(XT15R,日本HITACHI)、超纯水分离系统(Mliili-Q Advantage A10,美国Millipore公司)、超低温冰箱(DW-86L828,海尔集团)、恒温磁力搅拌器(HJ-3,江苏金坛市环宇科学仪器厂)、涡旋混匀器(VTX-3000L,比利时LMS公司)、PCR仪(Eppendorf,德国)、电泳仪(DYY-12型,北京市六一仪器厂)、微波炉(M3L239C,美的集团股份有限公司)、凝胶成像系统(G:BOX F3,基因有限公司)。
1.3 质控菌株
大肠杆菌质控菌株ATCC25922由农业农村部家禽品质监督检验测试中心(扬州)保存提供。
1.4 引物设计与合成
参照本课题组前期的研究成果设计大肠杆菌鉴定引物(周倩等,2020),具体引物序列为F:5′-AT GAAACGAGTTATTACCCTGTT-3′和R:5′-CGCCA ATAATCGATTGCACATT-3′,扩增片段大小为883 bp,引物委托生工生物工程(上海)股份有限公司合成。
1.5 样品采集
采集5个品种白羽肉鸡0日龄胎粪样品,每组各15份;然后分别在4、8、12、16、20、24、28、32、36和40日龄时采集鸡泄殖腔棉拭子,每组各10份。胎粪样品保存于PBS中,泄殖腔样品保存于Cary-Blair半固体运输培养基中,所有样品12 h内低温运回实验室。样品以PBS适当稀释后涂板。
1.6 大肠杆菌分离鉴定
从运输培养基中取出棉拭子,置于含1 mL灭菌PBS的指形管中充分浸透,1∶100倍稀释后取100μL稀释液涂布于麦康凯培养基上,37℃微需氧培养18~24 h后挑取可疑菌落接种至麦康凯培养基上进行纯化培养,得到单一纯培养菌落;挑取单一菌落接种至LB培养基上培养18 h,再挑取单一菌落接种于10μL的PBS中,采用PCR进行鉴定。PCR反应体系25.0μL:Speed STARTMHS DNA聚合酶12.5μL,上、下游引物(10μmol/L)各1.0μL,DNA模板1.0μL,ddH2O 9.5μL。扩增程序:95℃预变性1 min;95℃30 s,55℃30 s,72℃1 min,进行35个循环;72℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测,阳性菌株接种于LB肉汤中,37℃下摇至菌液浑浊后保存于含40%甘油的BHI培养基(1∶1,v/v)中,-20℃冷冻保存。
1.7 DNA提取及菌株保存
吸取1 mL LB肉汤培养菌液,离心去除上清液,根据细菌基因组DNA提取试剂盒说明提取细菌总DNA,将大肠杆菌分离株收集于含40%甘油的BHI培养基(1∶1,v/v)中,-20℃冷冻保存。
1.8 药敏试验
综合养殖场用药情况及对公共卫生的影响,选择七大类14种抗生素,采用世界卫生组织(WHO)推荐的Kirby-Bauer(K-B)法,根据美国临床实验室标准化协会(CLSI)的标准进行药敏试验。将菌液稀释至0.5麦氏浓度后,根据药敏纸片说明进行测试,36℃微需氧培养18~24 h后以直尺测定抑菌圈直径(mm),以质控菌株ATCC25922为对照。耐药菌株数量超过60%的药物判定为优势耐药。药敏纸片名称、含量及判断标准见表1。

表1 抗生素名称及判定标准Table 1 Drugs and determination criteria of antibiotics
1.9 统计分析
试验数据采用Excel 2018进行整理,并以SAS 9.2进行卡方检验和成组t检验。
2 结果与分析
2.1 大肠杆菌的菌落形态特征
在麦康凯培养基上,大肠杆菌菌落呈微红色或鲜桃红色,中心呈深桃红色,圆形扁平,边缘整齐且表面光滑湿润(图1)。PCR扩增产物经1.0%琼脂糖凝胶电泳检测,可获得预期的特异性目的条带(883 bp),部分大肠杆菌的PCR鉴定结果如图2所示。
2.2 5个品种白羽肉鸡大肠杆菌分离情况
从1075份样品中共分离获得978株大肠杆菌,总分离率为91.0%。5个品种不同日龄采集的样品分离率详见表2。其中,胎粪样品均能分离到大肠杆菌,分离率在60.0%~80.0%。5个品种的总分离率排序为A品种=C品种>D品种>B品种>E品种,以A品种和C品种分离获得的菌株较多,分离率均为93.0%,E品种分离获得的菌株最少,分离率为88.4%。卡方检验分析结果表明,5个品种白羽肉鸡的胎粪样品分离率、G1和G2的分离率、5个品种白羽肉鸡大肠杆菌总分离率及不同日龄的分离率均无显著差异(P>0.05,下同)。

表2 5个品种白羽肉鸡大肠杆菌分离情况(%)Table 2 Isolation of E.coli in 5 varieties of white-feathered broilers(%)
2.3 5个品种白羽肉鸡大肠杆菌对抗生素的耐药性
2.3.1 A品种肉鸡大肠杆菌对抗生素的耐药表型200株A品种肉鸡大肠杆菌分离株对14种抗生素存在不同程度的耐药性(表3),但不同日龄分离株的耐药情况无显著变化。大多数分离株对氨苄西林、阿莫西林、环丙沙星、红霉素、四环素和氯霉素已产生耐药性,耐药率均超过60.0%,尤其以对红霉素的耐药率最高(92.5%);对阿米卡星和磷霉素的耐药率相对较低,其中对磷霉素最敏感,耐药率为0。A品种肉鸡大肠杆菌的优势耐药谱为AMP-AML-CIP-ETE-C。

表3 A品种肉鸡大肠杆菌分离株对14种抗生素的药敏试验结果Table 3 Drug sensitivity test results of E.coli isolated from variety A of white-feathered broilers to 14 antibiotics
2.3.2 B品种肉鸡大肠杆菌对抗生素的耐药表型192株B品种肉鸡大肠杆菌分离株对14种抗生素存在不同程度的耐药性(表4),但不同日龄分离株的耐药情况无显著变化。大多数分离株对氨苄西林、阿莫西林、头孢噻肟、头孢曲松、庆大霉素、妥布霉素、红霉素、四环素、氯霉素和氟苯尼考已产生耐药性,耐药率均超过60.0%,尤其以对氟苯尼考的耐药率最高(94.3%);对阿奇霉素和磷霉素的耐药率较低,均为16.7%。B品种肉鸡大肠杆菌的优势耐药谱为AMP-AML-CTX-CRO-CN-TOB-E-TE-C-FF。

表4 B品种肉鸡大肠杆菌分离株对14种抗生素的药敏试验结果Table 4 Drug sensitivity test results of E.coli isolated from variety B of white-feathered broilers to 14 antibiotics
2.3.3 C品种肉鸡大肠杆菌对抗生素的耐药表型200株C品种肉鸡大肠大肠杆菌分离株对14种抗生素存在不同程度的耐药性(表5),但不同日龄分离株的耐药情况无显著变化。大多数分离株对氨苄西林、阿莫西林、环丙沙星、红霉素、四环素和氯霉素已产生耐药性,耐药率均超过60.0%,尤其以对氨苄西林和氯霉素的耐药率最高,均为77.5%;对阿米卡星和磷霉素的耐药率最低,均为0。C品种肉鸡大肠杆菌的优势耐药谱为AMP-AML-CIP-E-TE-C。

表5 C品种肉鸡大肠杆菌分离株对14种抗生素的药敏试验结果Table 5 Drug sensitivity test results of E.coli isolated from variety C of white-feathered broilers to 14 antibiotics
2.3.4 D品种肉鸡大肠杆菌对抗生素的耐药表型196株D品种肉鸡大肠杆菌分离株对14种抗生素存在不同程度的耐药性(表6),但不同日龄分离株的耐药情况无显著变化。大多数分离株对氨苄西林、阿莫西林、红霉素、四环素、氯霉素和氟苯尼考已产生耐药性,耐药率均超过70.0%,尤其以对氟苯尼考的耐药率最高(80.1%);对磷霉素的耐药率低,仅为1.5%。D品种肉鸡大肠杆菌的优势耐药谱为AMPAML-E-TE-C-FF。

表6 D品种肉鸡大肠杆菌分离株对14种抗生素的药敏试验结果Table 6 Drug sensitivity test results of E.coli isolated from variety D of white-feathered broilers to 14 antibiotics
2.3.5 E品种肉鸡大肠杆菌对抗生素的耐药表型190株E品种肉鸡大肠杆菌分离株对14种抗生素存在不同程度的耐药性(表7),但不同日龄分离株的耐药情况无显著变化。大多数分离株对氨苄西林、阿莫西林、庆大霉素、环丙沙星、红霉素、四环素、氯霉素和氟苯尼考已产生耐药性,耐药率均超过60.0%,尤其以对氨苄西林和红霉素的耐药率较高,分别为81.6%和82.1%;对阿米卡星和磷霉素的耐药率低,均为0。E品种肉鸡大肠杆菌的优势耐药谱为AMPAML-CN-CIP-E-TE-C-FF。
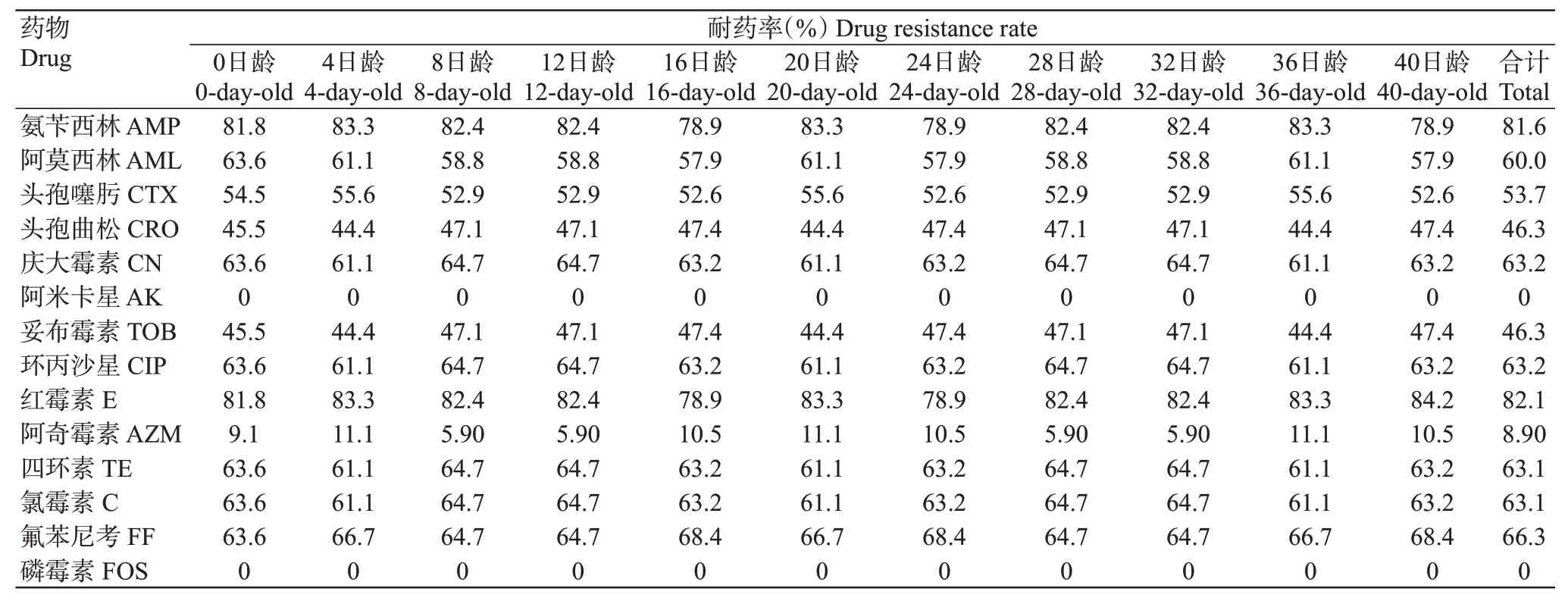
表7 E品种肉鸡大肠杆菌分离株对14种抗生素的药敏试验结果Table 7 Drug sensitivity test results of E.coli isolated from variety E of white-feathered broilers to 14 antibiotics
2.4 5个品种白羽肉鸡大肠杆菌的耐药差异分析结果
A品种~E品种肉鸡大肠杆菌分离株对14种抗生素的耐药情况如表8所示。5个品种白羽肉鸡大肠杆菌分离株均表现出对氨苄西林、阿莫西林、红霉素、四环素和氯霉素已产生耐药性,且耐药率均超过60.0%;而对阿米卡星、阿奇霉素和磷霉素的耐药率较低,尤其以对磷霉素的耐药率最低。

表8 5个品种白羽肉鸡大肠杆菌分离株对14种抗生素的耐药率比较Table 8 Comparison of E.coli isolate drug resistance rate of 5 varieties of white-feathered broilers to 14 antibiotics
3 讨论
由于公众对细菌耐药性认知程度较低,畜禽养殖过程中用药不规范导致的细菌耐药形势日趋严重,耐药细菌的流行和传播已对食品质量安全及公共卫生造成极大威胁(Qiao et al.,2018),因此长期以来动物源细菌的耐药性问题一直受到广泛关注。大肠杆菌作为典型的革兰氏阴性菌,在温血动物肠道中占有极高的数量,且作为条件致病菌能在一定条件下引起人类和动物发生胃肠道或尿道等组织感染(殷泽禄和万虎,2019),抗生素滥用导致的大肠杆菌耐药问题也成为制约畜牧业健康发展的瓶颈。
本研究从5个品种白羽肉鸡群体采集的1075份样品中分离出978株大肠杆菌,总分离率为91.0%,其中,广明2号(A)和圣泽901(C)的大肠杆菌分离率最高,均为93.0%,WOD168(E)的分离率最低,为88.4%。肉鸡胎粪样品均能分离获得大肠杆菌,分离率在60.0%~80.0%。运用SAS 9.2对5个品种白羽肉鸡大肠杆菌的污染水平进行分析,结果发现5个品种白羽肉鸡的胎粪样品分离率、G1和G2的分离率、5个品种白羽肉鸡大肠杆菌总分离率及不同日龄的分离率均无显著差异,说明不同品种白羽肉鸡在相同饲养环境下其肠道内大肠杆菌带菌情况相似。这与本课题组前期对氟苯尼考干预下大肠杆菌耐药性变化的研究结果(周倩等,2020)相似,与吕红林(2020)、张海龙(2021)针对鸡源大肠杆菌的研究结果也基本一致,但分离率高于鹅源、狐源和猪源大肠杆菌(高丽等,2021;刘少杰,2021;唐标等,2021)。
从5个品种白羽肉鸡大肠杆菌对七大类14种抗生素的耐药状况来看,对氨苄西林、阿莫西林、红霉素、四环素和氯霉素已产生较强的耐药性,对阿米卡星、磷霉素、阿奇霉素和头孢曲松仍然较敏感,与湖南省部分地区和河北省的大肠杆菌耐药性调查结果相近,但对头孢曲松的耐药率正呈逐年递增的变化趋势(唐标等,2021;张海龙,2021)。此外,5个品种白羽肉鸡大肠杆菌分离株产生明显的多重耐药,但不同肉鸡大肠杆菌的优势耐药谱有所差异,广明2号(A)大肠杆菌的优势耐药谱为AMP-AML-CIP-ETE-C,科宝肉鸡(B)大肠杆菌的优势耐药谱为AMPAML-CTX-CRO-CN-TOB-E-TE-C-FF,圣泽901(C)大肠杆菌的优势耐药谱为AMP-AML-CIP-E-TE-C,AA+(D)大肠杆菌的优势耐药谱为AMP-AML-ETE-C-FF,WOD168(E)大肠杆菌的优势耐药谱为AMP-AML-CN-CIP-E-TE-C-FF。其中,广明2号(A)和圣泽901(C)的大肠杆菌分离率及耐药谱相同,说明动物源大肠杆菌多重耐药性具有一定的遗传稳定性。
4 结论
不同品种白羽肉鸡大肠杆菌耐药情况受用药习惯、饲养方式及条件状况等环境因素的多重影响,但其多重耐药性具有一定的遗传稳定性。因此,在实际生产中应从动物饲养的源头抓起,鼓励和发展集约化养殖,加强饲料安全检测,改善饲养和防疫条件,严格进行合理规范用药,减少同一药物的使用频率,降低细菌耐药性,有效保障动物产品安全及维护人类健康。

