基于Rock2信号通路探讨黄芩苷对阿尔茨海默病小鼠学习记忆功能的影响
黄 燕,骆飞飞,唐 卉,周 嫱,徐朝义
阿尔茨海默病(Alzheimer′s disease,AD)是一种发病隐匿、病情缓慢渐进加剧的神经退行性疾病。有统计显示,2010年全球AD病人达3 600万例,且预计2030年将达到6 570万例[1]。AD特征性的病理改变为β-淀粉样蛋白(β-amyloidprotein,Aβ)积聚形成斑块沉淀、Tau蛋白过度磷酸化形成神经纤维缠结。临床表现为学习能力逐渐降低,记忆力逐渐衰退,伴随逐渐加重的思维、语言、精神障碍,病人最终丧失生活自理能力[2-3]。这些不仅严重降低了病人生活质量,而且给家庭与社会带来了沉重负担。临床常见的AD多为散发性,与遗传基因突变关系较少[4],因此,发病机制尚不明确,且无特效治疗药。
现阶段AD临床治疗常用药物为乙酰胆碱酯酶(acetyl cholinesterase,AchE)抑制剂和N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂,然而这些药物对部分病人有效,且无法改善痴呆样症状[5]。寻找疗效显著且具有预防作用的治疗药物是今后AD的研究方向。中药黄芩及主要成分黄芩苷在相关研究中发挥了神经保护作用,相关机制包括抗氧化、抗炎、抗谷氨酸兴奋性毒性和促进神经元再生[6]。现阶段关于黄芩苷治疗AD的研究较少。本研究构建AD模型淀粉样前体蛋白(amyloid precursor protein,APP)及早老素-1(presenilin-1,PS1)双转基因小鼠,探究黄芩苷对AD小鼠学习记忆功能和Aβ蛋白的沉积的影响。
1 材料与方法
1.1 实验材料 黄芩苷(baicalin,BA,西安开来生物公司);溶血磷脂酸(lysobisphosphatidic acids,LPA,美国Sigma公司);生理盐水(四川科伦医药公司);DMEM培养基(美国Gibco生物公司);孕马血清、胎牛血清(内蒙古金源康生物工程有限公司);噻唑蓝(北京索莱宝生物公司);兔源Anti-Aβ多克隆抗体、鼠源Anti-Rock2单克隆抗体、兔源(美国CST公司);鼠源Anti-Caspase-3单克隆抗体、鼠源Anti-Bcl-2单克隆抗体、兔源Anti-Bax多克隆抗体,兔源Anti-β-actin多克隆抗体(美国Proteintech公司);碱性磷酸酶标记的山羊抗兔IgG(H+L)、Alexa Fluor标记的山羊抗鼠IgG(H+L)、HRP标记山羊抗兔/鼠IgG(H+L)(美国CST公司)。
1.2 实验动物与分组 8月龄APP/PS1双转基因C57BL/6雄性小鼠(16只)与8月龄野生型C57BL/6雄性小鼠(8只),无特定病原体(SPF)级,体质量(33±2)g,由成都达硕实验动物有限公司提供。所有动物饲养条件为正常且充足的摄食饮水,12 h/12 h昼夜循环光照,温度(24±1)℃,相对湿度(65±5)%。将APP/PS1小鼠分为模型组与黄芩苷组,将野生型C57BL/6小鼠作为对照组。所有动物分笼后适应环境喂养1周。黄芩苷组小鼠连续28 d灌胃给药黄芩苷溶液,剂量为60mg/kg,每日1次,另外两组给予相同体积生理盐水灌胃。
1.3 水迷宫实验检测小鼠学习记忆能力 水迷宫系统分为测试水箱、摄像头、电脑分析系统。测试水箱为一个高0.6 m、直径1.2 m圆柱体,水箱中注入高约0.4 m自来水,设置水迷宫恒温系统控制水温为(24±1)℃。摄像头记录水面,电脑分析系统将水面分为4个象限、靶象限、对侧象限。左侧象限和右侧象限。靶象限中设置一个低于水面约1 cm的圆形平台,供小鼠逃生使用,水箱四周贴有不同形状的图形,提供小鼠记忆空间信息。整个实验分为训练阶段与测试阶段,训练阶段共5 d,每日自各个象限丢入水中,记录小鼠120 s内寻找并登上平台时间。若小鼠120 s内无法登上平台,引导至平台并记录逃避潜伏期为120 s。测试期间,撤去逃生平台,将小鼠自对侧象限丢入水中,自由寻找平台,记录小鼠首次达到平台象限所用时间、穿越平台次数与靶象限停留时间。
1.4 电生理长时程电位记录 小鼠麻醉后,脑部固定于立体定位仪上。顶部备皮消毒,打开皮肤,暴露颅骨,以前囟为零点,确定刺激电极,记录电极位置。刺激电极:前囟后2.8 mm,中线左侧旁开0.4 mm,深度2.5 mm。记录电极:前囟后2.8 mm,中线右侧旁开0.4 mm,深度2.5 mm。插入电极后,每10 s给予1次的脉冲刺激,调整刺激电极和记录电极的位置和深度,直到出现最佳的场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)波形,固定刺激电极和记录电极。不断改变刺激强度,以引起最大反应50%~70%的电流强度为最佳刺激强度。每10 s给予1次单脉冲刺激并记录基线,基线稳定记录10 min后,使用高频刺激诱发长时程增强(long time potentiation,LTP),连续20串高频脉冲,每串包含200个脉冲,频率为200 Hz,波宽200 μs,串间隔30 s,高频刺激连续记录1 h。
1.5 免疫组化检测Aβ沉积 将小鼠置于通风橱内,打开胸腔,暴露心脏,自左心室插入注射针头,注入生理盐水,剪开右心耳冲出血液,待冲出液体无血色,序贯4%多聚甲醛固定液,结束后取全脑置于4%多聚甲醛溶液中固定过夜。次日取全脑组织置入梯度乙醇溶液中脱水,待全脑表面乙醇挥发,使用二甲苯乙醇溶液透化,再使用石蜡包埋后切片,厚度约40 μm。将海马区较完整的脑片取出,100 ℃烘箱中烘烤15 min修复抗原,再将脑片置于4%胎牛血清封闭液中封闭2 h,清洗切片,加入兔源Anti-Aβ抗体稀释液,4 ℃孵育过夜。隔日取出切片,PBST清洗并加入碱性磷酸酶标记的山羊抗兔IgG(H+L)抗体稀释液,4 ℃条件下避光孵育2 h。反应结束后,磷酸缓冲盐溶液(PBS)清洗二抗稀释液,DAB显色30 s,冲洗DAB后再次使用苏木精复染20 s,蒸馏水分化,在不同梯度乙醇中脱水,二甲苯透化样品,中性树脂封片,显微镜下观察拍片。
1.6 细胞培养与分组给药 PC12细胞株购自南京科佰生物技术公司,使用培养体系为DMEM高糖培养基加入10%孕马血清、5%胎牛血清、100 U/mL青霉素和100 U/mL链霉素。培养温度为37 ℃,通入5%CO2混合气体。待细胞瓶中细胞生长至80%融合时,使用0.25胰蛋白酶消化1 min,吹下细胞,加入6孔板、24孔板或96孔板中。将细胞分为对照组、模型组、黄芩苷组和黄芩苷+溶血磷酸酯组(黄芩苷+LPA组)。待96孔板中细胞生长至80%融合,吸出培养基后PBS清洗,各组预加入含198 μL培养基、200 μmol/L黄芩苷或200 μmol/L黄芩苷+40 μmol/L LPA。培养箱中培养2 h后,各组(除对照组)加入2 μL 3 mmol/L Aβ25-35(终浓度为30 μmol/L)。细胞继续培养24 h后,进行噻唑蓝(thiazolylblue,MTT)测试或其他实验研究。
1.7 免疫荧光实验检测Rock2表达 各组PC12细胞接种于24孔板中,待生长至80%融合,给药孵育24 h。使用4%正常胎牛血清封闭2 h。PBST洗去封闭液,加入鼠源Anti-Rock2抗体(1∶100),4 ℃条件,湿盒中孵育过夜。次日,PBST洗去封闭液,加入Alexa Fluor标记的山羊抗鼠IgG(H+L)溶液(1∶100),4 ℃条件下孵育2 h。PBST洗去二抗溶液,加入DAPI稀释液染核,再加入抗荧光猝灭剂封片,荧光显微镜下观察并拍片。
1.8 蛋白免疫印迹法(Western Blot)
1.8.1 小鼠脑组织蛋白提取 各组小鼠迅速断头取脑,镊子取出海马组织,加入组织蛋白裂解液,研磨成细胞悬液。4 ℃冰箱中静置20 min使蛋白完全裂解,12 000 r/min条件下离心20 min。检测上清液蛋白浓度,使用组织蛋白裂解液稀释到相同浓度,加入上样缓冲液。
1.8.2 PC12细胞蛋白提取 各组PC12细胞接种于6孔板中,待生长至80%融合,给药孵育24 h。各组样品孔中细胞采用胰酶消化并用PBS洗涤3遍,加入100 μL组织蛋白裂解液,震荡混悬20 min,静置20 min,全程维持4 ℃环境温度。吸取上清液检测蛋白浓度,各组加入不同体积组织蛋白裂解液稀释至相同浓度,并加入上样缓冲液。
1.8.3 十二烷基硫酸钠(SDS)凝胶电泳 配制不同浓度的分离胶与浓缩胶,拔出上样梳,每个载样孔中加入10 μL样品。设置电泳电压:60 V,30 min;120 V,60 min,整个电泳过程以上样缓冲液达到底部为终点。根据分子质量标记物截取目标蛋白条带,使用湿法转膜法将凝胶上蛋白转移至聚偏二氟乙烯(PVDF)膜上,设置转膜电流为恒流:2 mA,60 min,以上所有过程保持冰浴。取出PVDF膜,以4%胎牛血清封闭,采用目的蛋白一抗稀释液孵育PVDF膜过夜。次日,取出PVDF膜,洗净一抗稀释液,使用二抗稀释液避光孵育2 h。洗净二抗后,将超敏发光液滴加于PVDF膜上,显影仪下显影获得目的蛋白条带。所有条带以β-actin条带表达灰度值进行量化统计。
2 结 果
2.1 黄芩苷对APP/PS1小鼠学习与记忆功能的影响 采用Morris水迷宫观察黄芩苷对APP/PS1小鼠学习与记忆功能的影响。训练首日,多数小鼠无法在测试时间内登上逃生平台,表现为在水中漫无目的的游动状态,各组间逃避潜伏期比较,差异无统计学意义(P>0.05)。训练第2天,由于小鼠基因类型不同,与野生型小鼠比较,模型组和黄芩苷组小鼠逃避潜伏期延长(P<0.05)。训练第3天开始,由于黄芩苷长期的干预,黄芩苷组小鼠逃避潜伏期缩短(P<0.05)。水迷宫测试阶段,与模型组比较,黄芩苷组缩短了APP/PS1小鼠逃避潜伏期(P<0.05),增加了小鼠穿越平台次数与靶象限停留时间(P<0.05)。详见图1、表1和表2。

图1 各组小鼠水迷宫训练期间逃避潜伏期
表1 各组小鼠水迷宫训练期间逃避潜伏期比较(±s) 单位:s
表2 各组小鼠水迷宫测试期间相关指标比较(±s)
2.2 黄芩苷对APP/PS1小鼠脑中长时程电位的影响 检测海马组织电生理兴奋性突触后电位明确黄芩苷对APP/PS1小鼠长时程电位的影响。与对照组比较,APP/PS1双转基因小鼠长时程电位抑制(P<0.05);与模型组比较,黄芩苷长期给药提高了APP/PS1双转基因小鼠长时程电位(P<0.05)。详见图2。

与对照组比较,#P<0.05;与模型组比较,*P<0.05。
2.3 黄芩苷对APP/PS1小鼠海马组织Aβ沉积的影响 采用免疫组化测定黄芩苷对APP/PS1小鼠海马区Aβ沉积的影响。对照组未检测出Aβ沉积斑块。模型组小鼠可检测出颜色较深、面积较大的Aβ沉积斑块。与模型组比较,黄芩苷长期给药有效减小了小鼠海马组织中Aβ沉积斑块面积,且Aβ沉积斑块染色较浅。详见图3。
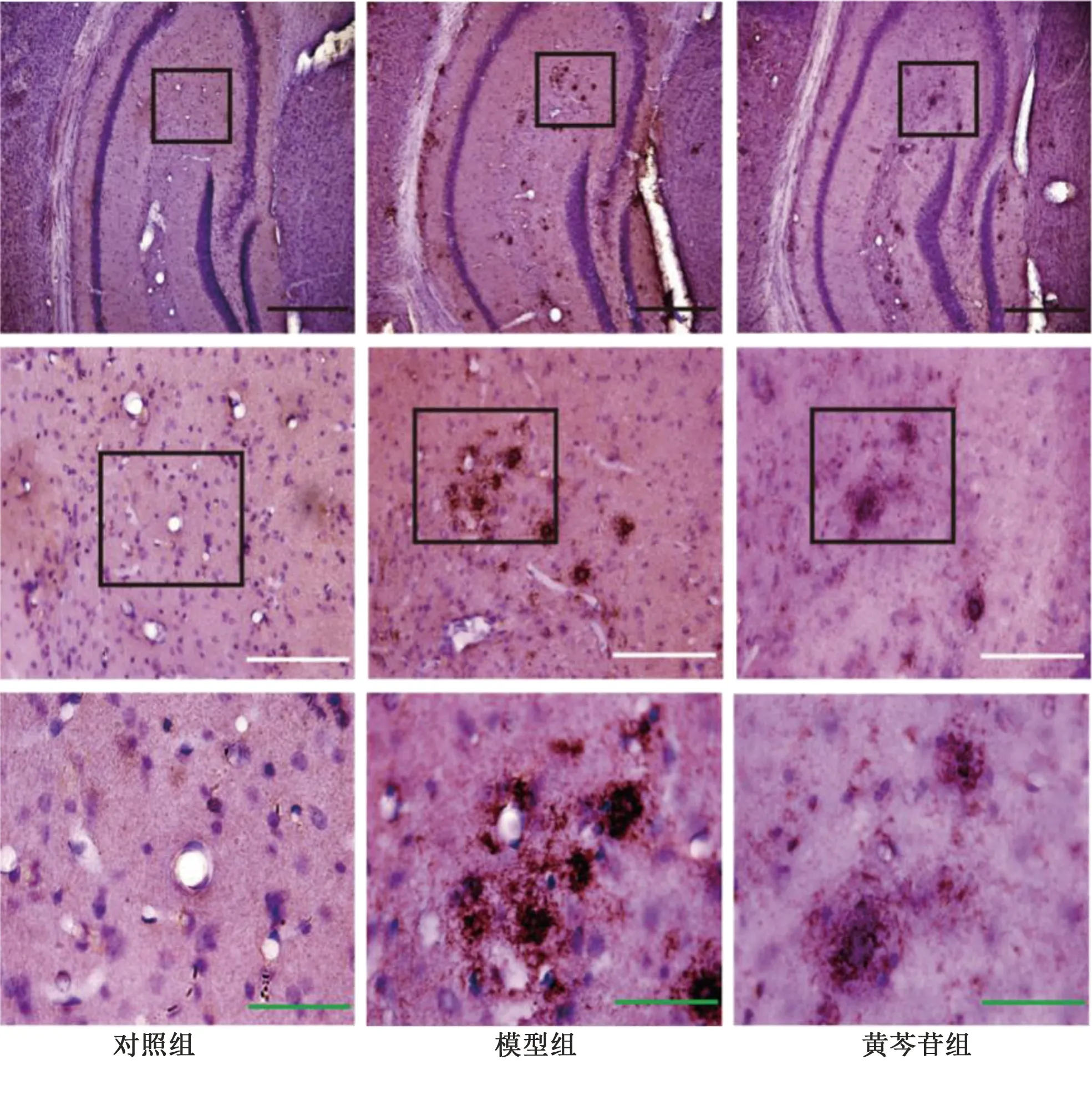
图3 各组小鼠海马区Aβ斑块免疫组化图像
2.4 黄芩苷对APP/PS1小鼠海马组织Rock2、Caspase-3、Bcl-2与Bax的影响 采用Western Blot检测了黄芩苷对小鼠海马组织各蛋白的影响。野生型小鼠海马组织Rock2与Cleaved-Caspase-3低表达,且Bcl-2/Bax表达比例较高。与对照组比较,APP/PS1小鼠脑组织Rock2与Cleaved-Caspase-3表达增加(P<0.05),Bcl-2/Bax表达比例降低(P<0.05)。黄芩苷长期给药降低了小鼠海马组织Rock2与Cleaved-Caspase-3表达水平(P<0.05),升高Bcl-2/Bax表达比例(P<0.05)。详见图4。
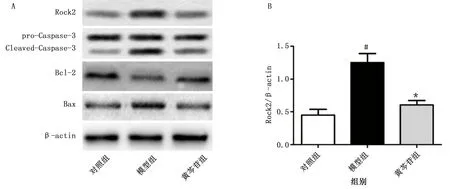
与对照组比较,#P<0.05;与模型组比较,*P<0.05。
2.5 黄芩苷对Aβ25-35诱导PC12细胞凋亡的影响 体外实验首先观察不同浓度Aβ25-35对PC12细胞存活率的影响。不同浓度Aβ25-35呈剂量依赖性降低PC12细胞存活率。Aβ25-35剂量达到30 μmol/L时,细胞存活率下降至约70%;Aβ25-35剂量达到40 μmol/L时,细胞存活率下降至约40%。考虑到细胞状态恢复需要一定活率基础,本研究使用Aβ25-35剂量为30 μmol/L。详见图5。黄芩苷干预下,PC12细胞存活率呈剂量依赖性升高,与模型组比较,黄芩苷200 μmol/L介导PC12细胞存活率增加(P<0.05)。黄芩苷与Rock2激动剂LPA共同干预降低了PC12细胞存活率(P<0.05)。详见图6。

与对照组比较,#P<0.05。

与对照组比较,#P<0.05;与模型组比较,*P<0.05。
2.6 黄芩苷对Aβ25-35诱导PC12细胞中Rock2表达的影响 免疫荧光实验样品处理中,PC12细胞使用黄芩苷200 μmol/L或黄芩苷200 μmol/L +LPA 40 μmol/L预干预,2 h后,各组再加入Aβ25-3530 μmol/L造模。与对照组比较,PC12细胞中Rock2表达增加(P<0.05);与模型组比较,黄芩苷降低了PC12细胞中Rock2表达(P<0.05)。黄芩苷与LPA联合使用,PC12细胞中Rock2表达再次增加。详见图7。

与对照组比较,#P<0.05;与模型组比较,*P<0.05。
2.7 黄芩苷对Aβ25-35诱导PC12细胞中Caspase-3、Bcl-2和Bax表达的影响 与对照组比较,模型组PC12细胞中Cleaved-Caspase-3表达增加(P<0.05),Bcl-2/Bax表达比例降低(P<0.05)。与模型组比较,黄芩苷干预降低了Cleaved-Caspase-3表达水平(P<0.05),升高了Bcl-2/Bax表达比例(P<0.05)。LPA共同干预逆转了黄芩苷介导的Cleaved-Caspase-3表达降低,Bcl-2/Bax表达比例提高。详见图8。

与对照组比较,#P<0.05;与模型组比较,*P<0.05。
3 讨 论
AD是一种好发于老年人群的中枢神经系统退行性疾病,常伴有痴呆样症状。本研究使用动物为APP/PS1双转基因小鼠,是将外源性APP/PS1基因通过基因重组技术整合到小鼠基因组中构建双转基因小鼠模型[7]。该品系小鼠脑组织较早出现与AD病理相似的Aβ蛋白沉积,Aβ是造成大脑神经毒性的主要原因,引起小鼠脑内炎症和学习记忆能力下降,因此,该品系小鼠常作为AD模型用于研究。Morris水迷宫是现阶段常用于测定学习、记忆等认知功能的手段,原理是通过逃避潜伏期的缩短程度判断实验动物学习能力,穿越平台次数与靶象限停留时间反映大鼠空间记忆能力[8]。神经系统中的兴奋传递是通过神经元之间突触建立的,在神经退行性疾病发生时突触兴奋传递效率降低。LTP是神经元之间兴奋性突触后电位的斜率变化,可准确反映突触之间兴奋传递的效率,是判断突触可塑性与机体学习与记忆能力的指标之一。有研究显示,神经退行性疾病造成的痴呆样症状伴有LTP抑制的现象[9]。本研究中综合水迷宫和LTP电位检测显示,APP/PS1小鼠出现了痴呆样症状,学习记忆能力降低,突触之间兴奋传递与突触可塑性降低。黄芩苷长期干预能显著逆转小鼠痴呆样症状。
大鼠嗜铬细胞瘤细胞系PC12细胞是一种类神经元细胞,现阶段广泛应用于体外神经系统的研究。Aβ作为AD脑组织中毒性肽之一,是AD病人病情加剧的重要病理标志物[10]。研究报道显示,脑室注射Aβ25-35造成小鼠出现类似AD痴呆样、学习记忆功能障碍、突触传递抑制等症状,同时导致海马组织内神经炎症与神经元凋亡[11]。体外研究中,应用Aβ25-35干预神经元细胞可诱导细胞凋亡[12]。本研究体内实验显示,APP/PS1小鼠脑组织中出现大量Aβ蛋白沉积,且凋亡相关蛋白Cleaved-Caspase-3与Bax表达增加,抗凋亡蛋白Bcl-2表达降低。体外实验中,Aβ25-35作用于PC12细胞系造成神经元凋亡,Aβ25-35剂量越高,细胞毒性越大,细胞存活率越低。Aβ25-35导致凋亡相关蛋白Cleaved-Caspase-3表达增加,而Bcl-2/Bax表达降低。本研究结果提示,体外实验中APP/PS1小鼠出现了与临床相似的痴呆样、学习记忆功能障碍症状。体外实验中,Aβ25-35诱导PC12细胞凋亡反映了小鼠脑组织中Aβ沉积造成的神经元死亡,即本研究中体内、体外AD模型建模成功。
黄芩苷是从黄芩根茎中提取分离出的一种黄酮类化合物。中医学认为黄芩性苦、味寒,可清热解郁、调节情志,是中医治疗气血不畅的常用药物之一。现代研究认为,黄芩苷具有抗炎、抗氧化的生物活性,可穿过血脑屏障发挥神经保护作用[13]。在缺血性脑卒中的研究中,黄芩苷预给药通过增加血管周围Claudin-5蛋白表达,保护血脑屏障完整性,降低水通道蛋白1(AQP1)核酸含量,从而减轻缺血性脑水肿程度,改善脑缺血再灌注造成的神经功能损伤[14]。在抑郁症的研究中,黄芩苷长期给药通过抑制Toll样受体4(TLR4)蛋白表达,抑制脑组织炎性细胞因子释放,改善海马组织微环境,提高神经元再生,从而逆转长期慢性不可预知性应激造成的抑郁样行为[15]。Rock在各种疾病(包括中枢神经系统疾病)的治疗中发挥着重要作用[16]。Rock有2个同种型,即Rock1和Rock2。Rock2主要在大脑和肌肉中表达,是中枢神经系统中轴突变性、神经元死亡和轴突再生的主要调节剂。本研究体内实验结果显示,黄芩苷通过抑制Rock2蛋白表达,降低Cleaved-Caspase-3表达,逆转APP/PS1双转基因小鼠脑组织中Aβ蛋白沉积,提高小鼠长时程电位,改善小鼠学习与记忆功能。体外实验中,黄芩苷干预通过抑制Rock2表达,提高了Aβ25-35诱导的PC12细胞存活率。LPA是Rock2激动剂,造成小鼠海马组织出现神经炎症反应,介导神经元凋亡。本研究中,LPA与黄芩苷共同干预上调了Rock2表达,逆转了黄芩苷对Aβ25-35诱导PC12细胞存活率的改善作用。提示黄芩苷通过抑制Rock2相关信号通路改善神经元凋亡。
综合本研究结果,黄芩苷在AD的预防和治疗中具有显著疗效。基于黄芩苷低毒性质,高发AD的老年人群可尝试饮用黄芩作为AD预防方式。黄芩苷治疗AD的作用机制为抑制Rock2相关信号通路表达,减少神经元凋亡,抑制Aβ蛋白沉积并提高长时程电位水平,最终发挥改善学习与记忆功能。

