快骨骼肌亚型肌钙蛋白Ⅰ对鸡前脂肪细胞增殖的影响
孔令喆,李金炜,张新宇,旦增晋美,孙泽,孙婴宁
快骨骼肌亚型肌钙蛋白Ⅰ对鸡前脂肪细胞增殖的影响
孔令喆,李金炜,张新宇,旦增晋美,孙泽,孙婴宁
(齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006)
实验室前期研究发现,KLF7促进鸡前脂肪细胞增殖,且调控基因的表达,但是TNNI2在鸡前脂肪细胞增殖过程中的作用还不清楚.为此,探讨基因对鸡前脂肪细胞增殖的影响.qRT-PCR检测永生化鸡前脂肪细胞系(immortalized chicken preadipocyte cell line,ICP1)增殖过程中基因的表达情况;将TNNI2过表达载体pCMV-HA-转染至ICP1细胞,利用Western blot实验检测过表达效果.采用CCK-8,EdU法检测过表达TNNI2对细胞增殖的影响,qRT-PCR检测增殖标志基因的表达.基因在ICP1细胞增殖过程中呈先下降后逐渐升高的趋势;Western blot实验结果表明,基因过表达成功;CCK-8结果表明,过表达TNNI2后ICP1细胞在450 nm处的吸光值显著上升(<0.05);EdU结果显示,过表达TNNI2后实验组EdU掺入的细胞数占细胞总数的百分比显著高于对照组(<0.01);qRT-PCR结果显示,增殖标志基因表达水平有上调趋势,但是差异并不显著(>0.05).基因对鸡前脂肪细胞的增殖具有促进作用.
鸡;前脂肪细胞;过表达;TNNI2;增殖
体脂率过高是肉鸡生长发育过程中的一个关键问题.过度的脂肪堆积会降低种鸡的产蛋率,鸡蛋的孵化率和受精率[1],也会影响饲料的转化率,因此减少鸡脂肪的过度沉积是肉鸡行业急需解决的问题[2].脂肪沉积是一个受多因素影响的过程,从细胞水平上看,脂肪细胞数目变多和体积增大都会引起脂肪沉积[3].
快骨骼肌亚型肌钙蛋白I(fast skeletal muscle troponin I,TNNI2)的编码基因是脊椎动物肌钙蛋白I(Troponin I,TnI)基因的一种亚型[4].作为决定动物肉质特征的潜在候选基因,的表达会影响肌肉纤维的组成,从而影响肉质的特征[5].最初的研究认为只在肌肉中表达并调节肌肉收缩[6],但随着研究的深入,TNNI2更多的功能被发现.当在软骨组织中表达时,TNNI2蛋白会抑制软骨组织的发育[7],在乳腺癌细胞中,该基因作为雌激素受体相关受体的活化物来发挥功能,TNNI2在胰腺癌细胞中可以改变SIRT1的表达从而促进胰腺癌的发展[8].另外,研究发现遗传性骨病的病因包括基因的突变[9],说明TNNI2在哺乳动物的骨骼发育过程中也发挥重要作用.在小鼠体内基因突变会阻碍小鼠的骨骼发育[10],基因的缺失或错译是导致远端关节病的重要原因[11]等.近期研究发现,在猪、牛和鸡的脂肪组织中表达,表明该基因在脂肪发育过程中也发挥作用[12].实验室前期研究发现,TNNI2抑制鸡前脂肪细胞分化,但是TNNI2在鸡前脂肪细胞增殖中的作用还不清楚.因为天生胰岛素抵抗,鸡是研究脂肪组织发育的理想模型[13-15].本文以永生化鸡前脂肪细胞系(immortalized chicken preadipocyte cell line,ICP1)为实验材料,探究TNNI2对ICP1细胞增殖的影响.研究结果为深入研究肉鸡脂肪过度沉积提供了依据,同时也为揭示肥胖发生的分子机制提供参考.
1 材料与方法
1.1 材料
ICP1细胞系(东北农业大学农业农村部鸡遗传育种重点实验室);pCMV-HA质粒(美国Clontech公司);pCMV-HA-[16](齐齐哈尔大学基因功能研究实验室).
1.2 方法
ICP1细胞系使用添加10%胎牛血清和1%青霉素-链霉素溶液的DMEM/12培养基在37 ℃ 5% CO2培养箱中培养.
1.2.1细胞转染使用Lipo8000转染试剂(Beyotime)进行转染,质粒(µg)∶Lipo8000转染试剂(µL)=1∶1.6.以6孔板为例,将细胞接种至6孔板,待细胞汇合度至70%~75%时进行转染.125 µL无血清DMEM细胞培养基稀释2.5 µg质粒,用移液器轻轻混匀,再加入4 µL Lipo8000转染试剂,用移液器轻轻混匀后,立即均匀滴加至6孔板中,摇匀后置于37 ℃ 5% CO2细胞培养箱中继续培养.转染4~6 h后更换1次细胞培养基.于转染后24,48,72 h分别收集细胞,用于提取细胞总RNA.
1.2.2CCK-8检测细胞活力将细胞接种至96孔板并培养至完全贴壁,转染pCMV-HA或pCMV-HA-载体,培养6 h后更换新鲜的培养基,放到37℃ 5%CO2培养箱中继续培养24,48,72h后,向孔中加入10%培养基体积的CCK-8溶液,放入培养箱继续孵育,2h后酶标仪测定450nm处吸光值.
1.2.3EdU检测细胞增殖将细胞接种至6孔板中,在细胞生长到汇合度约为70%~90%时转染pCMV-HA或pCMV-HA-载体,6 h后更换新鲜的培养基,于37 ℃ 5% CO2培养箱中继续培养24 h后进行EdU孵育Hoschst染色,并于荧光显微镜下观察[17].
1.2.4Western blot验证过表达效果将鸡前脂肪细胞接种至6孔板,分别转染pCMV-HA-TNNI2以及pCMV-HA质粒,转染48 h后,使用RIPA裂解液(含1% PMSF)(Beyotime)提取细胞中的总蛋白,4 ℃ 12 000 r/min离心5 min,上清即为总蛋白,加入5×蛋白上样缓冲液(Beyotime)煮沸5 min后进行SDS-PAGE电泳,电泳结束后将蛋白样品转移至PVDF膜(Millipore),室温封闭1 h,anti-HA标签抗体孵育1 h,二抗孵育1 h.采用Odyssey双红外激光成像系统检测TNNI2蛋白表达水平.拍照完成后,采用一抗二抗洗脱液(Beyotime)洗脱1 h,采用内参抗体anti--actin孵育1 h,二抗孵育1 h,检测内参蛋白-actin的表达水平.
1.2.5RNA提取及qRT-PCR待ICP1细胞生长汇合度80%~90%提取RNA,向培养基中加入适量的RNAiso Plus后混匀,冰上静置5 min后,12 000 r/min离心5 min,转移至新1.5 mL离心管中,加入适量体积的三氯甲烷,涡旋振荡至溶液呈乳白色,将上清液转移至新的离心管中,再加入等体积的异丙醇并混合均匀,冰上静置10 min后,12 000 r/min离心10 min,加入适量75%乙醇,晃动离心管并7 500 r/min离心5 min,去上清液保留沉淀,待离心管干燥后,加入30 µL DEPC水溶解RNA,即可作为模板进行反转录.反转录按照HiScript®II Q Select RT SuperMix for qPCR(+gDNA wiper)(Vazyme)说明书进行操作.首先去除基因组的DNA,反应体系为:总RNA 0.5 μg,4×DNA wipe Mix 2 μL,加入RNase free ddH2O,总体系为8 μL.体系用移液器轻轻吹打混匀,42 ℃ 2 min.反转录时向体系中加入5×HiScript®II qRT SuperMix II 2 μL,用移液器吹打均匀,25 ℃ 10 min,50 ℃ 30 min,85 ℃ 5 min,置于-20 ℃冰箱中保存.qRT-PCR反应按照ChamQTMSYBR®qPCR Master Mix(Without ROX)(Vazyme)说明书进行操作.反应体系:2×ChamQ SYBR qPCR Master Mix 5 µL,cDNA模板 1 µL,上、下游引物(10 µmol/L)各0.2 µL,ddH2O 3.6 µL.反应程序:95℃预变性30s,95 ℃变性10s,55 ℃复性延伸30s,共40个循环.每个样品设置3个重复.以无POU域八聚体结合蛋白(non-POU doman containing octamer-binding protein,NONO)为内参照基因.利用2-ΔΔCt算法将原始Ct值转换为基因相对表达量.所用引物序列见表1.

表1 qRT-PCR引物
1.2.6统计分析使用SPSS22.0(IBM Corporation.,Armonk,NY;USA)对实验数据进行统计分析,使用Graphpad Prism 7.0(Graphpad Software Inc.,San Diego,CA,USA)软件进行图形绘制.使用检验比较组间差异,<0.05为显著性差异,<0.01为极显著性差异,具有统计学意义.
2 实验结果
2.1 ICP1细胞正常增殖过程中TNNI2基因的表达
复苏ICP1细胞并分别传代至6孔板上,待细胞完全贴壁记为0 h,分别于24,48,72 h提取总RNA,采用qRT-PCR法检测基因在ICP1细胞增殖过程中的表达量变化(见图1).由图1可见,在24,48,72 h均有表达且呈现出先下降后上升的趋势(差异不显著).表明TNNI2可能对ICP1细胞的增殖起到一定作用.

图1 ICP1细胞增殖过程中TNNI2 mRNA的表达
2.2 TNNI2过表达效果验证
利用anti-HA标签抗体进行Western blot检测转染过表达载体pCMV-HA-及空载体pCMV-HA细胞中HA蛋白的表达情况.结果表明,在转染了pCMV-HA-质粒的ICP1细胞表达出一条约23 kD的特异蛋白条带,而转染pCMV-HA质粒的细胞没有表达出23 kD的特异带(见图2),表明真核表达载体pCMV-HA-能在ICP1细胞中成功表达HA-TNNI2蛋白.

图2 western blot分析ICP1细胞中TNNI2蛋白的表达
2.3 过表达TNNI2对鸡前脂肪细胞增殖的影响
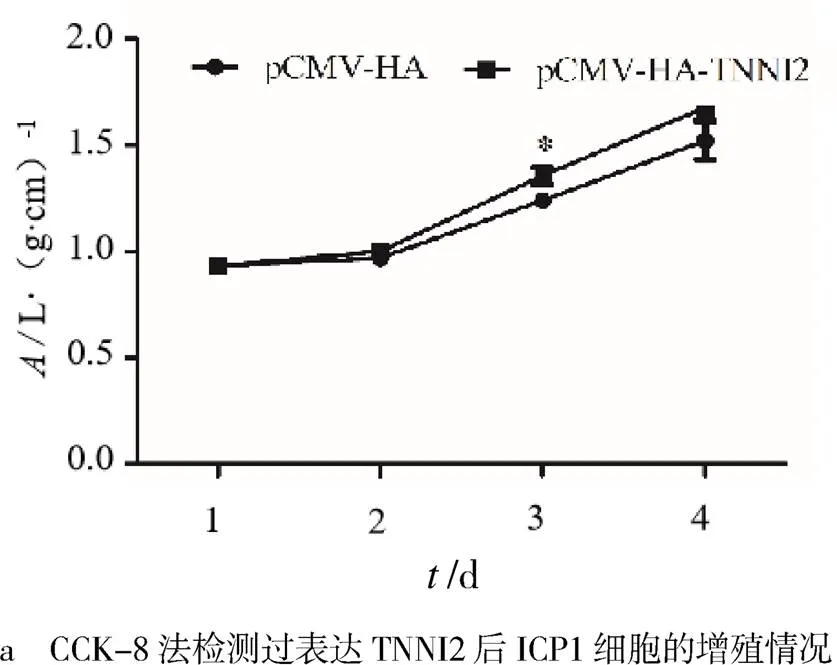
CCK-8实验结果表明,与转染pCMV-HA的细胞相比,转染pCMV-HA-的细胞在450 nm处的吸光值明显上升,48 h差异显著(<0.05,见图3a).EdU实验结果表明,与转染pCMV-HA质粒的细胞相比,转染pCMV-HA-质粒的细胞EdU掺入的细胞数明显上升(<0.01,见图3b).qRT-PCR实验结果表明,转染了pCMV-HA-质粒后,ICP1细胞的增殖标志因子,,,的mRNA水平虽有上升,但均无显著变化(>0.05,见图3c).实验结果表明,过表达TNNI2对鸡前脂肪细胞的增殖有促进作用.
3 结论与讨论
肌钙蛋白I(TnI)是一种可以在肌钙蛋白复合物横纹肌细纤维中起到抑制作用的亚基,并且在钙调节的肌肉收缩和松弛中起核心作用.脊椎动物TnI分为3个亚型,TNNI1(编码慢骨骼肌)、TNNI2(编码快骨骼肌)、TNNI3(编码心肌),目前TNNI2在畜类动物肌肉组织中的作用已被证实,但其在禽类脂肪组织形成过程的功能还不清楚.
KLF7是脂肪细胞分化的负调控因子,实验室前期以鸡前脂肪细胞为研究对象,进行染色质免疫共沉淀结合测序(ChIP-seq)分析,并首次发现在基因5′侧翼区存在一个KLF7结合位点,提示可能是KLF7的一个潜在靶基因[18],KLF7促进哺乳动物和禽类前脂肪细胞增殖,所以推测TNNI2对细胞增殖具有促进作用.本研究首先检测了基因的本底表达水平,结果显示,48 h前的表达量呈逐渐降低的趋势,这可能是细胞刚刚复苏状态不佳,未达到理想的增殖状态所导致,48 h后的表达水平逐步上升,提示TNNI2可能对鸡前脂肪细胞的增殖有促进作用.为了验证这一假设,在ICP1细胞中进行了过表达实验,并在蛋白质水平验证了过表达效果,结果表明,TNNI2过表达载体构建成功.进一步采用CCK-8和EdU实验检测细胞增殖,实验结果显示,过表达组的细胞增殖水平都显著高于空白对照组,这些结果说明TNNI2促进鸡前脂肪细胞增殖.合成了3条干扰片段,但是没有成功干扰TNNI2基因的表达.今后有必要利用Crispr cas9技术在体内和体外开展TNNI2在鸡前脂肪细胞中功能的研究.
鸡前脂肪细胞增殖会直接影响到鸡脂肪细胞的数量,过多的脂肪细胞会导致脂肪组织过度蓄积,鸡体内脂肪过度蓄积会影响鸡的产蛋率、受精率等一系列问题.前脂肪细胞增殖受复杂的转录因子网络调控.BMP4作为前脂肪细胞增殖的正调控因子通过促进G1/S的转化来促进前脂肪细胞增殖,另外PPAR[19],RB1[20],HOPX[21],TCF21[22]等因子对前脂肪细胞增殖起到负调控作用.然而,本研究在过表达TNNI2之后,检测增殖标志基因的表达发现,等增殖标志基因的表达量略有升高,但均无显著性,这可能是由于转染效率不高或基因并不通过这些标志基因来影响细胞增殖所导致.有研究发现,编码的fsTnI蛋白的亚细胞定位于细胞核.也有研究认为,在哺乳动物体内fsTnI蛋白可以于核内与雌激素受体相关受体a(estrogen receptor related receptor a,ERRa)结合,以共激活剂的形式增强其在乳腺细胞中的交互作用[23].因此,本研究推测TNNI2可能作为转录因子在核内对ICP1细胞的增殖起到促进作用.基因在鸡体内脂肪组织发育中的作用仍有待研究,在后续的研究中有必要开展基因干扰实验以及流式细胞术检测细胞周期以确定TNNI2以何种方式促进ICP1增殖,继续验证TNNI2在体内和体外的功能.
综上所述,过表达基因可以有效促进ICP1细胞增殖.
致谢:感谢东北农业大学农业农村部鸡遗传育种重点实验室王宁教授提供永生化鸡前脂肪细胞系.
[1] 樊红平,侯水生.家禽体内脂肪沉积调控的研究进展[J].动物营养学报,2004(4):1-6,12.
[2] 李云雷,孙研研,陈继兰.脂肪沉积对家禽繁殖性状影响的研究进展[J].中国家禽,2016,38(13):36-41.
[3] 鞠大鹏,詹丽杏.脂肪细胞分化及其调控的研究进展[J].中国细胞生物学学报,2010,32(5):690-695.
[4] SHENG J J,JIN J P.TNNI1,TNNI2 and TNNI3:Evolution,regulation,and protein structure-function relationships[J].Gene,2016,576(1 Pt 3):385-394.
[5] 李伯江,李平华,吴望军,等.骨骼肌肌纤维形成机制的研究进展[J].中国农业科学,2014,47(6):1200-1207.
[6] BERSON G,SAMUEL J L,SWYNGHEDAUW B.A comparative study of the cardiac troponin inhibitory factor(TNI)from mammalians[J].Pflugers Arch,1978,374(3):277-283.
[7] MOSES M A,WIEDERSCHAIN D,WU I,et al.Troponin I is present in human cartilage and inhibits angiogenesis[J].Proc Natl Acad Sci U S A,1999,96(6):2645-2650.
[8] FU Z,LIANG X,SHI L,et al.SYT8 promotes pancreatic cancer progression via the TNNI2/ERRalpha/SIRT1 signaling pathway[J].Cell Death Discov,2021,7(1):390.
[9] 郑昭璟,傅启华.应用全外显子组测序技术进行遗传性骨病分子缺陷机制的研究[D].上海:上海交通大学,2014.
[10] ZHU X,WANG F,ZHAO Y,et al.A gain-of-function mutation in Tnni2 impeded bone development through increasing Hif3a expression in DA2B mice[J].PLoS Genet,2014,10(10):e1004589.
[11] WANG B,ZHENG Z,WANG Z,et al.A novel missense mutation of TNNI2 in a Chinese family cause distal arthrogryposis type 1[J].Am J Med Genet A,2016,170A(1):135-141.
[12] PARK B S,OH Y K,KIM M J,et al.Skeletal Muscle Troponin I(TnI)in Animal Fat Tissues to Be Used as Biomarker for the Identification of Fat Adulteration[J].Korean J Food Sci Anim Resour,2014,34(6):822-828.
[13] DUPONT J,METAYER-COUSTARD S,JI B,et al.Characterization of major elements of insulin signaling cascade in chicken adipose tissue:apparent insulin refractoriness[J].Gen Comp Endocrinol,2012,176(1):86-93.
[14] JI B,ERNEST B,GOODING J R,et al.Transcriptomic and metabolomic profiling of chicken adipose tissue in response to insulin neutralization and fasting[J].BMC Genomics,2012,13(441):1-16.
[15] MELLOUK N,RAME C,BARBE A,et al.Chicken Is a Useful Model to Investigate the Role of Adipokines in Metabolic and Reproductive Diseases[J].Int J Endocrinol,2018,19:1-19.
[16] 李金炜,史洪岩,谭茗,等.鸡基因的真核表达载体构建及功能生物信息学分析[J].云南农业大学学报:自然科学,2021,36(3):430-437.
[17] 靳文姣,翟彬,苑鹏涛,等.miR-215-5p通过靶向NCOA3基因抑制固始鸡腹部前脂肪细胞的增殖和分化[J].畜牧与兽医,2021,53(7):69-77.
[18] 孙婴宁.KLF7 在鸡前脂肪细胞中的靶基因筛选和鉴定[D].哈尔滨:东北农业大学,2016.
[19] WANG L,NA W,WANG Y X,et al.Characterization of chicken PPARgamma expression and its impact on adipocyte proliferation and differentiation[J].Yi Chuan,2012,34(4):454-464.
[20] 张琦,黄娇娇,杨彩侠,等.CRISPR/Cas9介导基因敲除及其在鸡前脂肪细胞分化、增殖中的功能研究[J].畜牧兽医学报,2016,47(9):1775-1784.
[21] SHI H Y,QI H E,CHENG M,et al.Effect of HOPX Gene Overexpression on Chicken Preadipocyte Proliferation[J].Scientia Agricultura Sinica,2015,48:1624-1631.
[22] ZHANG X,CHENG B,LIU C,et al.A Novel Regulator of Preadipocyte Differentiation,Transcription Factor TCF21,Functions Partially Through Promoting LPL Expression[J].Front Physiol,2019,10:458.
[23] LI Y,CHEN B,CHEN J,et al.Fast skeletal muscle troponin I is a co-activator of estrogen receptor-related receptor alpha[J].Biochem Biophys Res Commun,2008,369(4):1034-1040.
Effects of fast skeletal muscle troponinⅠon proliferation of chicken preadipocytes
KONG Lingzhe,LI Jinwei,ZHANG Xinyu,DANZENG Jinmei,SUN Ze,SUN Yingning
(School of Life Sciences,Agriculture and Forestry,Qiqihar University,Qiqihar 161006,China)
Our previous studies showed that KLF7 promotes the proliferation of chicken preadipocytes and regulates the expression ofgene,but the role of TNNI2 in proliferation of preadipocytes remains unclear.Hence,the present study investigated the effect ofon the proliferation of chicken preadipocytes.The expression ofgene during the proliferation of immortalized chicken preadipocytes(ICP1)was detected by qRT-PCR.TNNI2 overexpression vector PCMV-HA-was transfected into ICP1 cells.Western blot assay was used to detect the overexpression effect.Cell proliferation was detected by CCK-8 and EdU methods.The expression of proliferation marker gene was detected by qRT-PCR.Thegene decreased first and then increased gradually during ICP1 cells proliferation.Western blot results showed thatgene was overexpressed successfully.CCK-8 results showed that the absorbance value of ICP1 cells at 450 nm increased significantly after TNNI2 overexpression(<0.05).EdU results showed that after TNNI2 overexpression,the percentage of EdU incorporation in the total number of cells in the experimental group was significantly higher than that in the control group(<0.01).qRT-PCR results showed that the expression levels of proliferative marker genes were up-regulated but the difference was not significant(>0.05).gene can promote the proliferation of chicken preadipocytes.
chicken;preadipocyte;overpression;TNNI2;proliferation
1007-9831(2022)10-0048-06
Q955
A
10.3969/j.issn.1007-9831.2022.10.010
2022-05-23
国家自然科学基金项目(31402061);2022年度黑龙江省省属高等学校基本科研业务费科研项目(145109211);齐齐哈尔大学创新创业训练计划项目(202220232304)
孔令喆(1999-),男,黑龙江大庆人,在读硕士研究生,从事动物分子遗传研究.E-mail:konglz121@126.com
孙婴宁(1981-),女,辽宁抚顺人,教授,博士,从事肥胖及脂肪组织发育相关研究.E-mail:yingningsun@163.com

