黄芪膜分离小分子成分对CTX、HC诱导的免疫抑制模型血清代谢组学比较研究
李泽红,任海琴,郭亚菲
(1山西省药品检查中心,太原 030031;2山西中医药大学中药与食品工程学院;*通讯作者,E-mail:zhongguolizehong@163.com)
免疫抑制(immunosuppression)是指机体存在免疫功能障碍导致免疫力下降,进而更容易受到细菌、病毒、真菌等病原体侵害从而诱发多种疾病,严重危害人类健康[1,2]。因此,为了消除或改善机体的免疫抑制状态,寻求有效、低毒副作用的药物,是目前急需研究的课题。黄芪为豆科植物蒙古黄芪Astragalus membranaceus var. Mongholicus(Bunge) P.K.Hsiao或膜荚黄芪Astragalus membranaceus(Fisch.) Bunge的干燥根,具有健脾补中、升阳举陷、益卫固表、利尿、托毒生肌等功效,主治脾肺气虚、自汗、气血亏虚、痈疽不溃或溃久不敛等症[3,4]。以黄芪为君药的中医经典方剂数目众多,疗效确切,临床应用广泛,如补中益气汤、当归补血汤等经典补益类方剂,充分体现了黄芪良好的补益功效。现代药理研究表明,黄芪具有增强免疫功能、抗肿瘤、抗炎等药理作用,此类作用与黄芪的补益功效相契合[5]。
现代中药化学研究结果表明,黄芪中所含有的黄芪皂苷、黄酮类成分是其发挥增强免疫功能、抗肿瘤、抗炎等药理作用的药效物质基础[6]。利用膜分离技术可实现对黄芪药效部位的分离[7,8]。本研究选用环磷酰胺(cyclophosphamide,CTX)和氢化可的松(hydrocortisone,HC)两种药物分别诱导免疫抑制大鼠模型,采用血清代谢组学方法分析黄芪膜分离小分子成分对模型动物内源性代谢物的影响,对差异代谢物及相关代谢通路进行比较,探究膜分离获得的黄芪小分子部位的免疫调节作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD大鼠50只,体质量(200±20)g,雌雄各半,购自中国食品药品检定研究院(许可证号:SCXK(京)2017-0005)。动物饲养于山西中医药大学实验动物中心,保持环境温度25 ℃,湿度60%,昼夜节律比1 ∶1。本次实验经山西中医药大学伦理委员会批准(批准号:2019LL140)。
1.1.2 药材与试剂 黄芪膜分离小分子部位(实验室自制)。环磷酰胺(CTX,批号:SLBC0666V,美国SIGMA公司);氢化可的松(HC,批号:SLBL4101V,美国Sigma公司);生理盐水(批号:20180609,石家庄四药有限公司);甲酸(质谱纯,批号:207035,美国Thermo Fisher Scientific公司);乙腈(质谱纯,批号:194036,美国Thermo Fisher Scientific公司);超纯水(Milli-Q系统,美国Millipore公司)。
1.1.3 仪器 LC-20AD超高效液相色谱仪(日本Shimadzu公司)、5600+Q-TOF高分辨质谱(美国ABScie公司);Neofuge 13R Heal Force高速冷冻离心机(上海力申科学仪器有限公司);MX-S赛洛捷克混匀仪,美国SCILOGEX公司);Concentrator plus真空离心浓缩仪(德国Eppendorf公司);雷磁PHS-3C型pH计(上海仪电仪器股份有限公司);Milli-Q超纯水仪(美国Millipore公司)。
1.1.4 软件与数据库 Thermo Compound Discoverer 3.3;SIMCA 14.1;人类代谢组数据库(human metabolome database,HMDB,http://www.hmdb.ca/);Mass Bank数据库(http://www.massbank.jp/);MetaboAnalyst 5.0在线分析平台(https://www.metaboanalyst.ca/faces/home.xhtml);京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG,https://www.genome.jp/kegg/)。
1.2 方法
1.2.1 试药的制备 本研究所用试药黄芪膜分离成分由实验室自制。称取适量干燥的黄芪饮片,加10倍量蒸馏水浸泡30 min,煎煮提取2次,每次40 min,合并两次滤液,离心(2 500 r/min,5 min),收集上清液。使用聚醚砜膜(30 kD)对所得黄芪药液进行预处理,收集透过液Ⅰ;使用聚醚砜膜(10 kD)对透过液Ⅰ进行处理,严格控制操作参数(液料比25 ∶1,药液pH 4.85,压力8.5 MPa,时间9 min),收集透过液Ⅱ;采用聚酰胺膜(2.5 kD)对透过液Ⅱ进行处理,严格控制操作参数(压力8.5 MPa,时间8 min),收集透过液Ⅲ;使用聚酰胺膜(600 D)对分级处理所得透过液Ⅲ进行浓缩,浓缩液经冷冻干燥后制成冻干粉,即得,简称M4部位。
1.2.2 动物分组、造模及给药 动物适应性喂养1周后,按体质量随机分为5组:空白组、CTX组、CTX+M4组、HC组、HC+M4组,6只/组。CTX组与CTX+M4组大鼠腹腔注射CTX(40 mg/kg,1次/d,14 d),造模第4天开始,CTX+M4组以灌胃方式给予M4水溶液(50 mg/kg,1次/d,10 d);HC组与HC+M4组腹腔注射HC(50 mg/kg,1次/d,14 d),造模第4天开始,HC+M4组以灌胃方式给予M4水溶液(50 mg/kg,1次/d,10 d);空白组大鼠腹腔注射等体积生理盐水作对照,造模第4天开始,空白组、CTX组及HC组灌胃等体积蒸馏水作对照。
1.2.3 动物样本的采集与处理 末次给药前1 d,所有动物禁食不禁水,给药1 h后,动物经水合氯醛(400 mg/kg)麻醉后解剖,腹主动脉采血,血液静置30 min后离心(3 500 r/min,10 min),取上清,于-80 ℃条件下储存备用。
1.2.4 血清样本前处理 分取血清样品450 μl,加入2倍体积预冷甲醇,涡旋1 min使充分混匀,-20 ℃条件下孵育20 min后离心(4 ℃,13 000 r/min,20 min),取上清液1 ml,于氮气流中浓缩至干。80%甲醇100 μl复溶,涡旋3 min,离心(4 ℃,13 000 r/min,10 min),取上清,用于液相色谱-质谱联用(LC-MS)分析。
1.2.5 色谱条件 ACQUITY UPLC®HSS T3柱(2.1 mm×150 mm,1.8 μm),柱温50 ℃,流动相:A为0.1% HCOOH+H2O,B为CH3CN。梯度洗脱条件:0~1 min,2% B;1~3 min,2%~50% B;3~14 min,50%~60% B;14~18 min,60%~90% B;18~19 min,90%~100% B;19~20 min,100% B。流速0.35 ml/min,进样量5 μl。
1.2.6 质谱条件 离子源:ESI源;扫描模式:全扫描;毛细管电压:+5 500 V/-4 500 V;离子源温度:450 ℃;辅助气:N2;气帘气(CUR)、雾化气(GS1)及辅助气(GS2)压力分别为:30,55,55 psi;去簇电压(DP):60 V/-60 V;碰撞能量(CE):40 eV/-40 eV。飞行时间质谱扫描范围(m/z):100~1 500;模式:数据依赖性采集(IDA);选择响应值超过100 cps的10个最高峰进行二级质谱扫描;Product Ion扫描范围(m/z):50~1 500;开启动态背景扣除(DBS)以减少干扰。
1.2.7 数据处理及分析 将采集所得的LC-MS/MS数据原始数据文件通过Compound Discoverer软件进行色谱峰对齐及归一化预处理。将处理后的峰面积数据导入SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)及正交偏最小二乘法-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),根据变量重要性投影值(variable importance plot,VIP)>1、P<0.05等约束调节筛选差异代谢物。利用代谢组学数据分析智慧云平台(ONE-MAP)将差异代谢物的质谱信息与可能的化学式信息进行匹配分析,在一级质谱信息成功匹配的前提下,结合人类代谢组数据库(HMDB,https://hmdb.ca)、Mass Bank数据库(http://www.massbank.jp/)及化合物裂解规律比对二级碎片信息,对所得差异代谢物进一步确认。运用MetaboAnalyst 5.0在线分析平台对差异代谢物进行通路富集分析,并结合KEGG数据库对相关代谢通路进行初步探讨。
2 结果
2.1 主成分(PCA)分析结果
将UPLC-Q-TOF-MS/MS原始数据按照正离子、负离子两种模式分别进行处理,并对得到的峰面积数据矩阵进行PCA分析,结果见图1,2。
在CTX诱导的免疫抑制模型中,空白组、CTX组及CTX+M4组血清代谢组学数据PCA分析结果见图1,ESI+、ESI-分别表示正离子、负离子扫描模式下的分析结果,t[1]、t[2]分别对应第一、第二主成分得分,散点与组别相对应。正、负离子模式下,CTX组与空白组区分明显,CTX+M4组与CTX组区分不明显,但从总体看,CTX+M4组存在向空白组靠拢的趋势。
在HC诱导的免疫抑制模型中,空白组、HC组及HC+M4组血清代谢组学数据PCA分析结果见图2。正、负离子模式下,HC组与空白组区分度较高,HC+M4组与HC组基本可以分开,且HC+M4组向空白组靠近趋势明显。
无监督模式的PCA分析中,将两组结果进行对比,模型组与空白组分离明显,可知CTX、HC均可使免疫抑制大鼠的血清代谢轮廓发生改变。而给药组与模型组分离趋势存在差异,提示黄芪M4部位对两种免疫抑制模型代谢轮廓改变的响应不同。
2.2 正交偏最小二乘判别(OPLS-DA)分析结果
为了消除组内样本个体差异带来的影响及样本生物多样性带来的误差,进一步通过OPLS-DA对两种造模方法对应的各组样本数据进行判别分析,使用Permutations置换检验对OPLS-DA预测模型进行验证,设置重复次数为200,并结合S-plot反映潜在生物标志物,结果见图3,4。
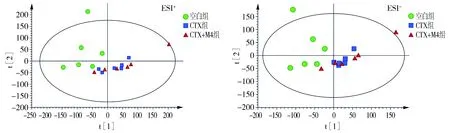
图1 正、负离子模式下CTX造模对应PCA得分散点图Figure 1 PCA scores of rat serum in CTX-induced immunosuppressive model under different ion modes
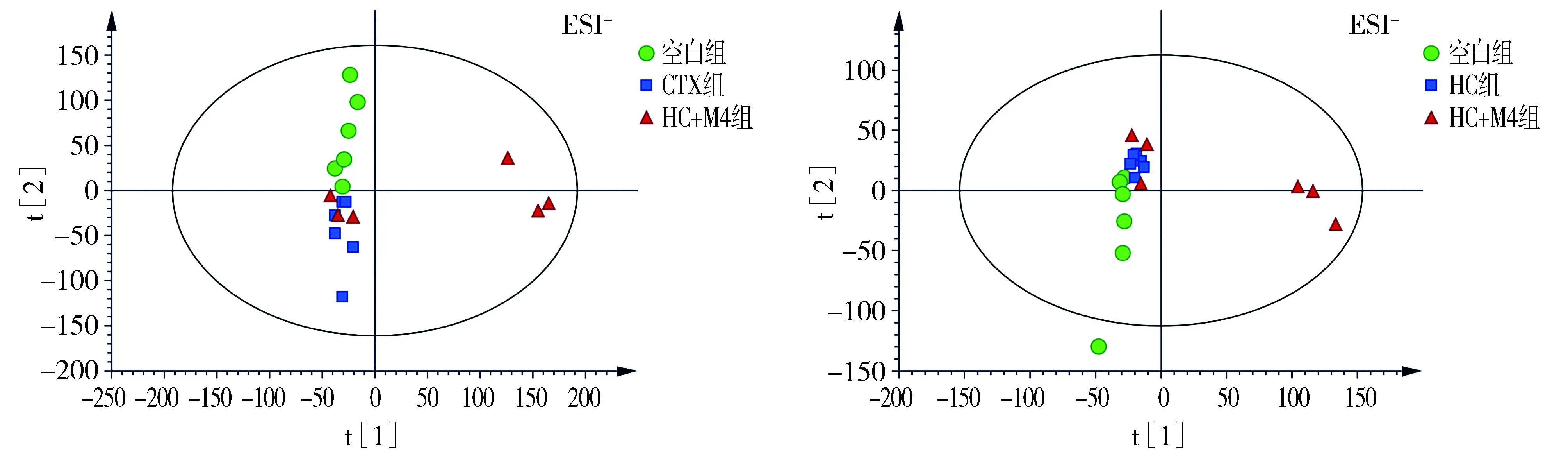
图2 正、负离子模式下HC造模对应PCA得分散点图Figure 2 PCA scores of rat serum in each group in HC-induced immunosuppressive model under different ion modes

散点的不同颜色代表相关系数,越接近红色代表正相关越强,越接近蓝色代表负相关越强C. CTX造模对应的S-plot图图3 正、负离子模式下CTX造模对应空白组与CTX组正交偏最小二乘判别分析Figure 3 Orthogonal partial least squares discriminant analysis of rat serum in control group and CTX group in CTX-induced immunosuppressive model under different ion modes
由图3A可知,正离子模式下,模型参数R2Y=0.997,Q2=0.728;负离子模式下,模型参数R2Y=0.992,Q2=0.751。两种模式下R2Y、Q2均大于0.5,表明模型具有较好的解释率及预测能力。图3B所示,Permutations置换检验结果显示,正、负离子模式下,左边R2点与Q2点均低于右边R2、Q2原始值,且Q2点回归线与纵轴相交于原点之下,表明模型验证通过,未产生过拟合。S-plot图反映了CTX诱导的免疫抑制模型潜在的差异代谢物(见图3C)。
由图4A可知,正离子模式下,模型参数R2Y=0.974,Q2=0.642;负离子模式下,模型参数R2Y=0.989,Q2=0.698。两种模式下R2Y均接近1且Q2均大于0.5,表明模型具有较好的解释率及预测能力。Permutations置换检验结果显示,正、负离子模式下,左边R2点与Q2点低于右边R2、Q2原始值,且Q2点回归线与纵轴相交于原点之下(见图4B),表明模型验证通过,未产生过拟合。S-plot图反映了HC诱导的免疫抑制模型潜在的差异代谢物(见图4C)。

散点的不同颜色代表相关系数,越接近红色代表正相关越强,越接近蓝色代表负相关越强。C. HC造模对应的S-plot图图4 正、负离子模式下HC造模对应空白组与HC组正交偏最小二乘判别分析Figure 4 Orthogonal partial least squares discriminant analysis of rat serum in control group and HC group in HC-induced immunosuppressive model under different ion modes
2.3 差异代谢物鉴定
分别对模型组与空白组、给药组与模型组之间进行单变量统计t检验,参考上述S-plot散点图,根据VIP值(VIP>1)、t检验(P<0.05)约束条件筛选免疫抑制差异代谢物,结果见表1、表2。

表1 CTX诱导的免疫抑制模型大鼠血清中的内源性差异代谢物Table 1 Differential endogenous metabolites in serum of CTX-induced immunosuppressive model rats
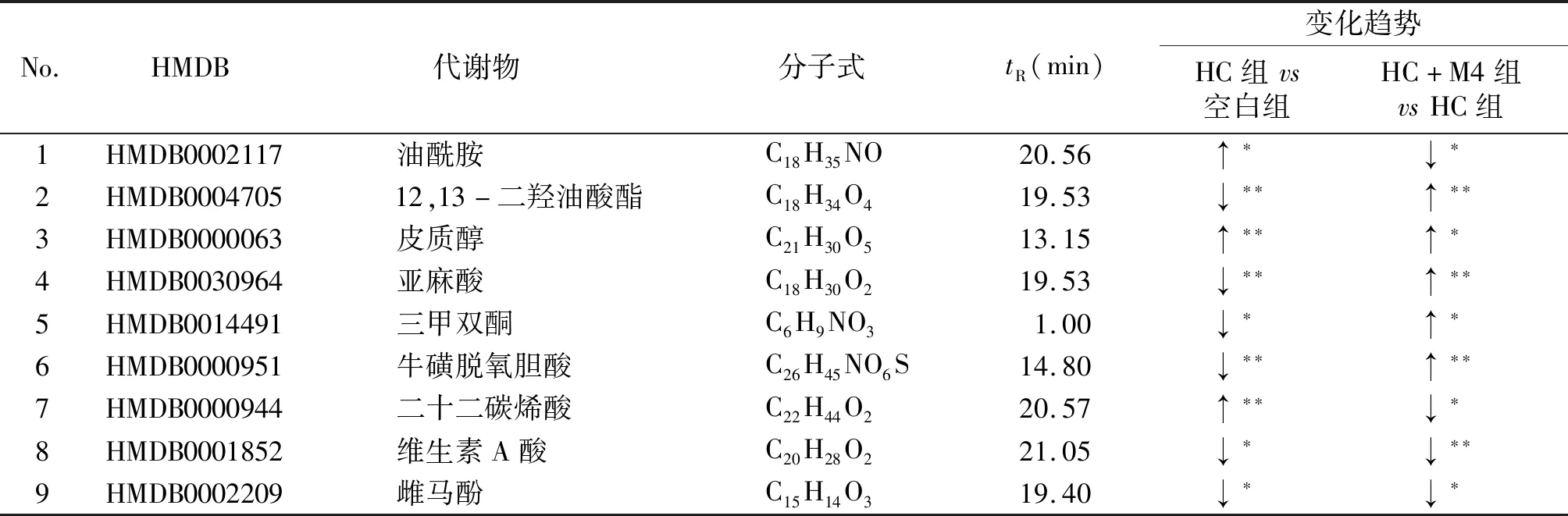
表2 HC诱导的免疫抑制模型大鼠血清中的内源性差异代谢物Table 2 Differential endogenous metabolites in serum of HC-induced immunosuppressive model rats
2.4 黄芪M4部位对CTX、HC免疫抑制模型大鼠差异代谢物的影响
将CTX、HC诱导的免疫抑制模型对应空白组、模型组及给药组大鼠血清差异代谢物归一化后的数据进行可视化聚类热图分析。结果见图5,6。
与空白组相比,CTX组大鼠血清中有22个差异代谢物水平显著下调,如前列腺素B1、12,13-二羟油酸酯、α-亚麻烯基乙醇酰胺、胞苷等;4个差异代谢物水平显著上调,如苯丙氨酸、2-甲基丁酰肉碱、亮氨酰脯氨酸等。与CTX组比较,CTX+M4组大鼠血清差异代谢物水平均显著回调,与空白组水平相接近。提示黄芪M4部位可逆转CTX诱导的免疫抑制大鼠血清差异代谢物水平改变。
如图6所示,与空白组相比,HC组大鼠血清中有6个差异代谢物水平显著下调,如12,13-二羟油酸酯、亚麻酸、牛磺脱氧胆酸等;油酰胺、皮质醇、二十二碳烯酸3个差异代谢物水平显著上调。与HC组比较,HC+M4组大鼠血清中6个差异代谢物水平均显著回调。提示黄芪M4部位可逆转HC诱导的免疫抑制大鼠血清差异代谢物水平改变。
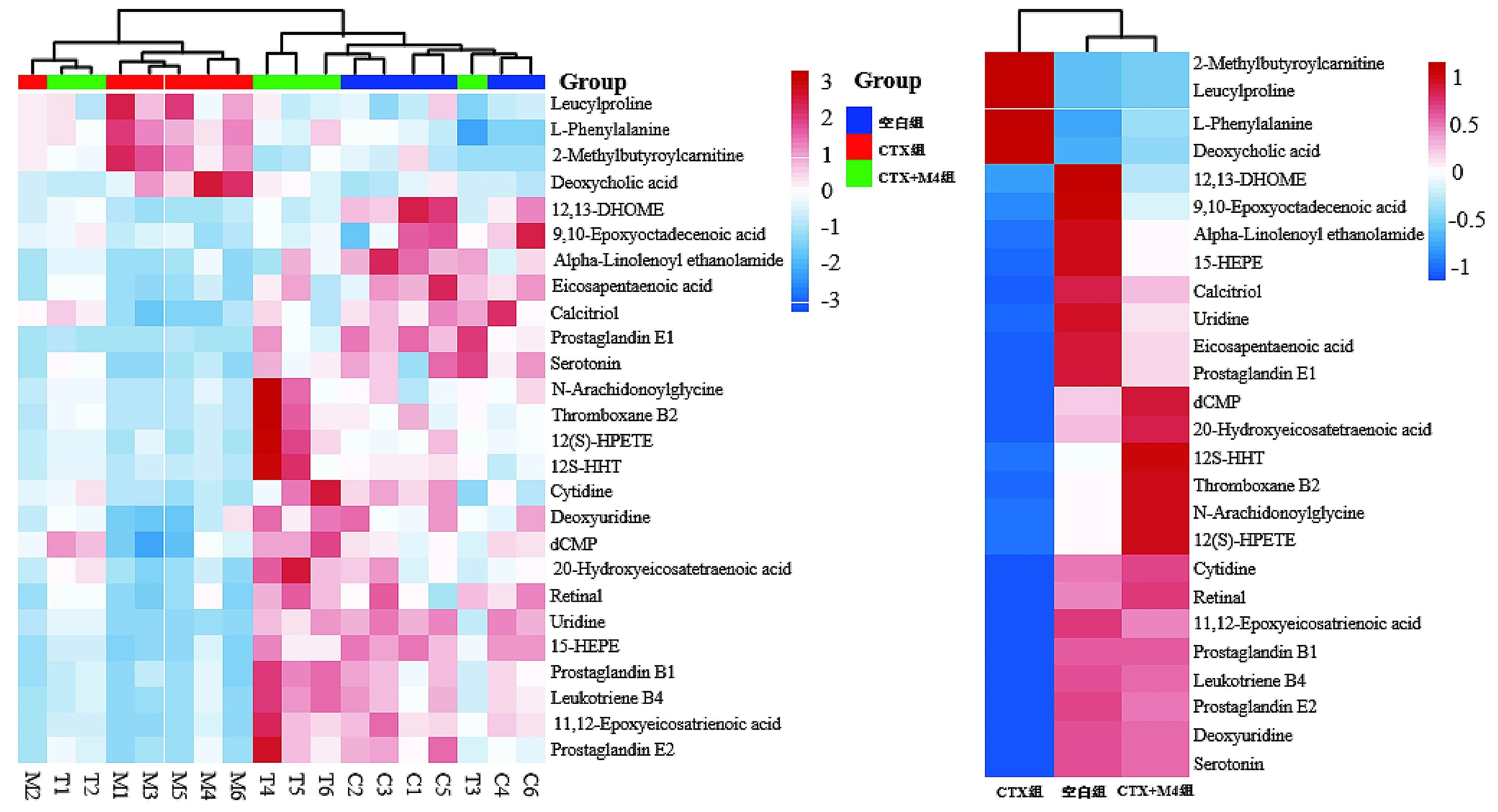
A.各组所有样本的差异代谢物聚类热图分析 B.各组均值差异代谢物聚类热图分析横轴为样本或组别,纵轴为差异代谢物,颜色深浅反映差异代谢物水平变化:红色表示上调,蓝色表示下调图5 黄芪M4部位对CTX诱导的免疫抑制模型大鼠差异代谢物影响的聚类热图分析Figure 5 Cluster heat map analysis of the effects of M4 part of Astragaluson on differential metabolites in CTX-induced immunosuppressive model rats
2.5 差异代谢物代谢通路富集分析
将筛选得到的差异代谢物(表1、表2)分别导入MetaboAnalyst 5.0在线分析平台(https://www.metaboanalyst.ca/),进行代谢通路富集分析,以通路影响因子为横坐标,P值为纵坐标绘制气泡图,结果见图7。
以Impact≥0.01为条件筛选潜在代谢通路。CTX诱导的免疫抑制模型大鼠血清共分析得到6条代谢通路,分别为苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙氨酸代谢,视黄醇代谢,嘧啶代谢、色氨酸代谢及花生四烯酸代谢(见图7A)。HC诱导的免疫抑制模型大鼠血清共分析得到2条代谢通路,分别为视黄醇代谢,类固醇激素生物合成(见图7B)。表明黄芪M4部位可通过影响差异代谢物表达而调控上述代谢通路,进而发挥对机体的免疫调节作用。
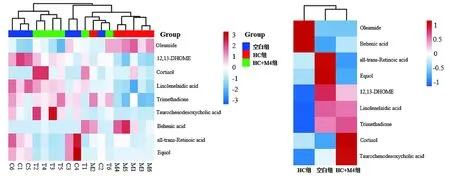
A.各组所有样本的差异代谢物聚类热图分析B.各组均值差异代谢物聚类热图分析横轴为样本或组别,纵轴为差异代谢物,颜色深浅反映差异代谢物水平变化:红色表示上调,蓝色表示下调图6 黄芪M4部位对HC免疫抑制模型差异代谢物影响的聚类热图分析Figure 6 Cluster heat map analysis of the effects of M4 part of Astragaluson on differential metabolites in HC-induced immunosuppressive model rats

A.CTX免疫抑制模型大鼠血清代谢通路富集分析B.HC免疫抑制模型大鼠血清代谢通路富集分析图7 免疫抑制模型大鼠血清中内源性差异代谢物代谢通路富集分析Figure 7 Enrichment analysis of metabolic pathways of differential metabolites in serum of immunosuppressive rats
3 讨论
代谢组学是继基因组学、蛋白质组学之后的一个新兴学科。通过分析生物样本的总体代谢状况,找出生物体应对外界刺激的内源性生物标记物和相关代谢通路,以期揭示疾病的发病机制和药物作用机制[9]。UPLC-Q-TOF-MS技术在筛选复杂成分和未知化合物方面有其独特优势,为进一步探讨中药多组分协同作用和药物在分子水平上的药效机理奠定了基础[10]。本研究分别采用了CTX和HC两种药物诱导免疫抑制大鼠模型,通过UPLC-Q-TOF-MS/MS技术与代谢组学方法筛选并鉴定两种模型对应的组间差异代谢物,进一步对差异代谢物所涉及的代谢通路进行分析。通过比较两组模型对应的差异代谢物及相关代谢通路,共同揭示黄芪M4部位调节机体免疫功能的作用机制。
CTX是一种常用的免疫抑制剂,主要用于慢性类风湿性关节炎、全身性红斑狼疮或儿童肾病综合征等自身免疫性疾病等的治疗[11-13]。其进入机体后被肝脏或肿瘤内存在的过量磷酰胺酶或磷酸酶水解,进一步生成磷酰胺氮芥,进而对免疫细胞发挥较强的免疫抑制作用[14]。HC又称皮质醇,是从肾上腺皮质中提取出的对糖类代谢具有最强作用的肾上腺皮质激素,可抑制细胞介导的免疫反应,减少T细胞、单核细胞和嗜酸粒细胞数量,削弱免疫球蛋白与细胞表面受体的结合能力,抑制白介素的合成和释放,从而减轻机体的免疫应答[15-17]。基于上述药效和机制,CTX、HC常用于诱导免疫抑制动物模型及免疫调节类药物的筛选和评价[18,19]。
从CTX诱导的免疫抑制模型中共筛选得到26种差异代谢物,涉及苯丙氨酸、酪氨酸和色氨酸生物合成,以及苯丙氨酸、视黄醇、嘧啶、色氨酸及花生四烯酸等6条代谢通路,且黄芪M4部位对这26种差异代谢物均表现出显著回调作用;从HC诱导的免疫抑制模型中共筛选得到9种差异代谢物,涉及视黄醇代谢和类固醇激素生物合成2条代谢通路,黄芪M4部位对其中6种差异代谢物表现出显著回调作用。由黄芪M4部位对免疫抑制生物标志物的调节趋势可知,其可通过上述多种代谢途径发挥增强免疫功能的作用,其中两种免疫抑制模型中共有的代谢通路为视黄醇代谢。视黄醇是维生素A的亚型,是机体必需的微量元素,对维持视力、调节免疫功能、促进生长发育都起着重要作用。研究发现,维生素A能增强机体抵御疾病的能力。大剂量时可促进胸腺的增生,增强机体免疫功能,并增加血液中白细胞的数目[20]。本研究结果表明,视黄醇代谢是黄芪M4部位调节免疫的作用途径之一。
此外,本研究从CTX诱导的免疫抑制模型中筛选得到了Prostaglandin B1、Prostaglandin E1及Prostaglandin E2等前列腺素和Leukotriene B4等白三烯类差异生物代谢物,且黄芪M4部位均可显著上调这几种差异生物代谢物水平。前者是由花生四烯酸在环氧酶催化作用下生成,可通过细胞免疫、体液免疫等多种途径调节机体免疫功能,具体表现为通过正、负两种反馈调节作用纠正机体免疫异常状态。后者是由花生四烯酸在5-脂氧酶催化作用下生成,该类物质在慢性支气管炎、过敏性哮喘等多种炎症性疾病的发生发展过程中起着重要作用[21]。
黄芪M4部位对CTX、HC两种免疫抑制模型大鼠的血清代谢轮廓具有较好的回调作用,黄芪M4部位的免疫调节作用与视黄醇代谢、花生四烯酸代谢等代谢通路密切相关。已有研究表明,黄芪注射液可通过激活PI3K/Akt信号通路降低细胞凋亡及自噬,进而增强机体免疫功能,减轻机体炎症反应[22];在联合TP化疗下,黄芪注射液可改善中晚期肺癌患者免疫功能,其机制与下调CYFRA21-1、CK19-2G2等肿瘤生物标志物水平有关[23];黄芪注射液亦可增加白细胞减少症模型小鼠免疫细胞计数,其机制与亚油酸代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成及苯丙氨酸代谢等途径有关[24]。此外,黄芪多糖表现出双向的免疫调节药效作用,如Li等[25]发现黄芪多糖APS-Ⅱ(1.02×104D)和APS-Ⅲ(286 D)能不同程度地增加小鼠血清中免疫细胞数量,修复其免疫器官损伤,发挥促进免疫作用,其机制可能涉及苯丙氨酸代谢、半胱氨酸和蛋氨酸代谢、三羧酸循环(TCA循环)及精氨酸和脯氨酸代谢的调节。范信晖等[26]发现APS-Ⅰ主要通过调控精氨酸生物合成、精氨酸和脯氨酸代谢、三羧酸循环、半胱氨酸和甲硫氨酸代谢、色氨酸代谢和嘧啶代谢发挥免疫抑制作用。
综上,黄芪在固护机体正气、提高机体免疫力、抵御外邪入侵等方面具有积极的预防和治疗作用,本研究结果为黄芪免疫调节作用的进一步深入研究提供了参考。

