齐墩果酸聚乙二醇修饰自组装及其对白血病细胞K562的增殖抑制作用
赵彬男,毛 晶,葛堂栋,张鹏霞,王迪迪†,朴金花*
(1佳木斯大学基础医学院生物化学与分子生物学教研室,佳木斯 154007;2滨州医学院烟台附属医院医学美容科;#共同第一作者;*通讯作者,E-mail:piaojinhua@jmsu.edu.cn;†共同通讯作者,E-mail:wangdidi@jmsu.edu.cn)
齐墩果酸(oleanolic acid,OA),五环三萜类化合物[1],是一种天然的植物提取物,迄今为止,齐墩果酸已经被发现以游离酸或糖苷的形式广泛存在于1 600多种药用或食用植物之中[1,2],具有药用价值高、药物来源广等特点。其药用范围非常广泛,具有护肾[3,4]、护肝[5]、保护皮肤[6]、抗肿瘤[7,8]、降血脂[9]、抗血小板聚集及抗动脉粥样硬化[10]、降血糖[11,12]、抗炎[13-15]、抗氧化[16]、抗病毒[17,18]等作用,但齐墩果酸水溶性较低,在水中溶出速度较慢,脂水分布系数不良,不能很好地被人体吸收,体内生物利用度较低,如何提高齐墩果酸的水溶性,增强其体内的生物利用度,是国内外科学家主要的研究方向。近年来,以齐墩果酸为先导化合物对其进行结构修饰成为国内外科学家研究的热点。
聚乙二醇(polyethylene glycol, PEG),是一种水溶性、无毒的中性高分子聚合物,具有良好的生物相容性,目前被广泛应用于药物结构修饰[19]。聚合物自组装是随着纳米技术的发展诞生的新兴研究领域,近年来,聚乙二醇因其极佳的柔软性和亲水性,被作为亲水性嵌段材料广泛应用于聚合物自组装的研究[20,21]。疏水性齐墩果酸和亲水性聚乙二醇通过化学键结合形成两亲性齐墩果酸的聚乙二醇改性产物,具有结构稳定、载药量高的特点,能够形成自组装颗粒[22],大大提高了齐墩果酸的水溶性,增强其体内的生物利用度,为临床药物治疗尤其是抗肿瘤药物研发提供了新思路。
白血病作为国内外发病率较高的恶性肿瘤之一,具有高达70%的死亡率[23]。慢性粒细胞白血病(chronic myelogenous leukemia,CML)是白血病中的一种常见类型[24]。目前对慢性粒细胞白血病的治疗主要为以伊马替尼为主的一代酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)靶向治疗方案,但伊马替尼治疗易产生耐药性,导致其不能完全阻止CML的进展[25]。因此,积极探索新型治疗慢性粒细胞白血病的药物,以及中药新药的研制开发,对于白血病临床治疗的进展显得十分重要。
本研究以OA为先导化合物,采用PEG对OA进行改构修饰,以合成水溶性更高、活性更强的OA衍生物,并研究衍生物对慢性粒白血病细胞K562的增殖抑制作用,旨在为衍生物的抗肿瘤作用提供实验数据,也为OA及其衍生物用于治疗慢性粒细胞白血病提供数据支撑。
1 材料和方法
1.1 材料
1.1.1 主要试剂 齐墩果酸购于南京迪尔格医疗科技有限公司;甲氧基聚乙二醇胺(mPEG-NH2,Mr=5 000)购于上海亚亦生物科技有限公司;二环己基碳二亚胺(分析纯)、4-二甲氨基吡啶(分析纯)购于美国Sigma-Aldrich公司;胎牛血清购于以色列BI公司;RPMI-1640培养基购于美国Hyclone公司;Cell Counting Kit(CCK-8)购于武汉博士德生物科技公司;PE/AnnexinⅤ Apoptosis Detection Kit I购于美国BD公司;β-actin一抗购于北京中杉金桥生物技术有限公司;PARP-1一抗购于美国Proteintech公司;Caspase-3、Caspase-9一抗购于美国Cell Signaling Technology公司;兔抗大鼠IgG购于武汉博士德生物科技公司;羊抗兔IgG购于美国Proteintech公司。
1.1.2 细胞株 人慢性粒细胞白血病细胞K562购于浙江美森细胞生物科技公司,本实验室保存和传代。
1.1.3 主要仪器 光谱仪(德国Bruker公司);核磁共振波谱仪(德国Bruker公司);透射电子纤维镜(日本Hitachi公司);纳米颗粒分析仪(英国Malvern Instruments公司);二氧化碳培养箱(美国THERMO公司);超净工作台(北京东联哈尔公司);倒置显微镜(日本OLYMPUS公司);全自动多功能酶标仪(美国BioTek公司);流式细胞仪(美国BD FACSAria公司);离心机(湖南赛特湘仪公司);蛋白垂直电泳仪(美国BIO-RAD公司);蛋白转膜系统(美国BIO-RAD公司)。
1.2 方法
1.2.1 酯化法合成齐墩果酸聚乙二醇衍生物OAP5及表征分析 通过甲氧基聚乙二醇胺(mPEG-NH2)氨基与齐墩果酸羧基的酯化反应合成OA-PEG缀合物。具体步骤如下:齐墩果酸(456.7 mg,1 mmol)、甲氧基聚乙二醇胺(Mr=5 000)2 mmol、1.6 mmol二环己基碳二亚胺和0.17 mmol 4-二甲氨基吡啶溶于100 ml二氯甲烷中,在室温条件下以300 r/min搅拌24 h转移到透析袋(Mr=3 000)中,每隔12 h换一次水,透析24 h;冷冻干燥,利用冻干机在-50 ℃的条件下冷冻干燥24 h,获得齐墩果酸聚乙二醇衍生物OA-PEG5000,命名为OAP5。在CDCl3溶液中测定OAP5核磁共振氢谱(400 MHz)。
1.2.2 纳米沉淀法实现OAP5自组装及表征分析 将OAP5的二氯甲烷溶液(1 mg/ml,1 ml)在搅拌下缓慢滴入水(3 ml)中进行自组装。透射电子显微镜对齐墩果酸聚乙二醇衍生物形貌进行表征。纳米颗粒分析仪动态光散射方法测量OAP5的水动力直径和zeta电位,样本测定浓度25 μg/ml浓度。
1.2.3 细胞培养 K562细胞由含10%胎牛血清的RPMI-1640培养基,并添加1%青霉素-链霉素、1% HEPES缓冲液于37 ℃、5% CO2及充分湿度的恒温培养箱中培养。每两天换液一次,细胞生长至80%~90%进行传代分瓶。取对数生长期细胞做后续实验。
1.2.4 CCK-8法检测细胞毒性 常规培养K562细胞,取对数生长期细胞以5×104/ml密度接种于96孔板,每孔100 μl细胞悬液。设置空白对照组、溶剂对照组和OAP5组(4,8,12,16,20,24,28,32,48,64 μg/ml),每组设3个复孔,同时设置调零孔,37 ℃作用24,48,72 h;每孔加CCK-8试剂20 μl,37 ℃恒温孵育2 h,使用酶标仪在450 nm波长下测定各孔吸光度(A)值,并计算K562细胞存活率。细胞存活率(%)=(A用药组-A空白组)/(A对照组-A空白组)×100%。为对比OAP5和OA的作用效果,另设置空白对照组、OA组(0.5,1,2,5,10,20,40,60 μg/ml),每组设3个复孔,同时设置调零孔,37 ℃作用48 h,检测OA组及OAP5组细胞存活率。Graphpad prism软件计算IC50值。
1.2.5 倒置显微镜观察细胞形态变化 常规培养K562细胞,取对数生长期细胞以10×104/ml密度接种于6孔板,每孔2 ml。设置空白对照组和OAP5组(终浓度8,16,32 μg/ml),每组设3个复孔,37 ℃、5% CO2恒温培养箱作用48 h,倒置显微镜下观察细胞形态。
1.2.6 流式细胞术检测细胞凋亡 取对数生长期K562细胞以10×104/ml密度接种于6孔板,每孔2 μl。于37 ℃、5% CO2恒温培养箱培养24 h后进行给药处理。设置空白对照组、OA组(终浓度40 μg/ml)和OAP5组(终浓度8,16,32 μg/ml),37 ℃、5% CO2恒温培养箱作用48 h。每组细胞悬液分别用离心机1 000 r/min离心5 min,PBS重悬后计数。取1×106细胞用1×Annexin Ⅴ Binding Buffer重悬。取100 μl细胞悬液加5 μl PE-Annexin Ⅴ和5 μl 7-AAD染色液,混匀,避光、室温下孵育15 min。每组细胞加入1×Annexin Ⅴ Binding Buffer 400 μl并混匀,于1 h内流式细胞仪上机检测。
1.2.7 Western blotting检测凋亡蛋白Caspase-3、Caspase-9、PARP-1表达 细胞培养同1.2.3。设置空白对照组、溶剂对照组和OAP5组(终浓度为2,8,16,32 μg/ml),37 ℃、5% CO2恒温培养箱作用48 h。离心收集细胞,用预冷的PBS洗涤细胞,加入细胞裂解液80 μl(RIPA ∶PMSF=100 ∶1),冰上裂解30 min后,低温12 000 r/min离心15 min,取上清。BCA法测蛋白浓度。加入5×蛋白上样缓冲液金属浴煮蛋白8 min。每孔10 μl上样,12% SDS-聚丙烯酰胺凝胶电泳后,电转到PVDF膜上。5%脱脂奶粉摇床封闭1 h后一次加入β-actin(1 ∶2 000)、Caspase-3(1 ∶1 000)、Caspase-9(1 ∶1 000)、PARP-1(1 ∶1 000)抗体4 ℃孵育过夜,TBST洗膜3次,每次10 min,加入HRP二抗(1 ∶10 000)摇床孵育2 h,TBST洗膜3次,每次5 min。ECL发光液于凝胶成像系统曝光,并测定灰度值。
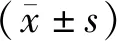
2 结果
2.1 OAP5的合成及表征
核磁共振氢谱中OA的典型峰分别为δ5.3 ppm(h峰)、δ5.5 ppm(a峰)和δ0~2.0 ppm(见图1A)。同时检测到δ2.8~3.9 ppm的化学信号,归因于mPEG的质子,表明OA和mPEG之间存在化学联系。
2.2 OAP5自组装表征
透射电子显微镜图像显示,OAP5自组装产物,粒径为(584.49±76.2)nm,为核壳结构(core-shell nanoparticle)(见图1B)。水动力直径分布图结果显示,与透射电镜测量直径基本一致,显示良好的亲水性(见图1C)。Zeta电位结果显示,OAP5接近0 mV,趋近于电中性,提示OAP5颗粒凝聚密切,有良好的稳定性(见图1D)。
2.3 OAP5对K562细胞增殖抑制的影响
CCK-8结果显示OAP5在24,48,72 h对K562细胞均有抑制增殖作用,IC50依次为(44.80±4.11)μg/ml,(16.10±0.64)μg/ml和(27.66±1.78)μg/ml,48 h效果最好(P<0.000 1,见图2)。不同细胞增殖活性随着浓度的增加而逐渐降低,呈剂量依赖性。48 h OA对K562细胞的IC50值为(32.28±1.60)μg/ml,OAP5对K562细胞增殖抑制作用明显优于OA,差异有统计学意义(P<0.000 1,见图2)。溶剂对照组对K562细胞的增殖并无抑制作用,与对照组相比,差异无统计学意义(P=0.32,见图2)。
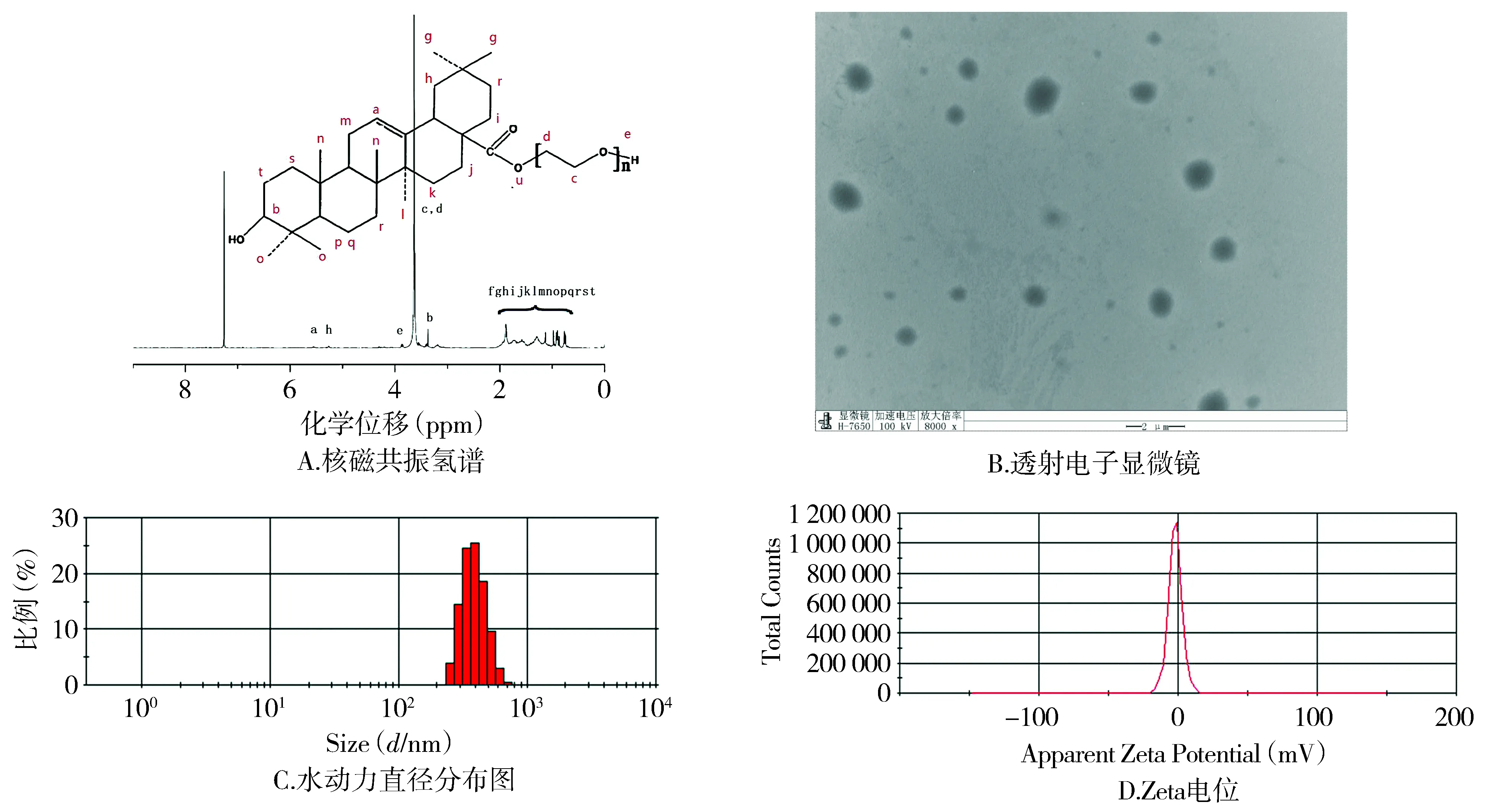
图1 OAP5的表征Figure 1 Characterization of OAP5
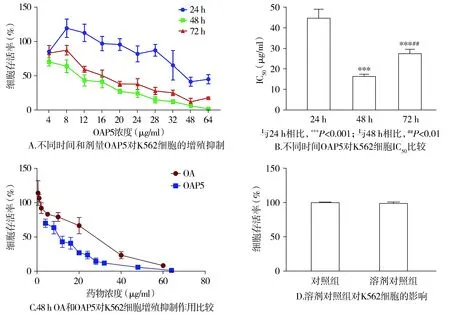
图2 OAP5对K562细胞增殖的影响Figure 2 Effect of OAP5 on K562 cell proliferation
2.4 OAP5对K562细胞形态的影响
倒置显微镜结果显示,对照组K562细胞生长良好,细胞密度大,细胞胞膜清晰,折光性好,细胞呈大小一致的圆形;OAP5作用组的K562细胞生长受到抑制,随着OAP5药物作用浓度的增大,细胞密度降低,细胞间隙增大,细胞逐渐萎缩变形,折光性变差,可见大量细胞碎片(见图3)。
图3 不同浓度OAP5作用48 h对K562细胞形态的影响Figure 3 Effects of different concentrations of OAP5 for 48 h on the morphology of K562 cells
2.5 OAP5对K562细胞凋亡的影响
流式细胞术结果显示,与对照组相比,OAP5 8 μg/ml组凋亡细胞比例为3.9%,16 μg/ml组凋亡细胞比例为13.5%,32 μg/ml组凋亡细胞比例为81.5%,OA 40 μg/ml组凋亡细胞比例为51.7%。可见OAP5能够促进K562细胞凋亡,呈剂量依赖性,且效果优于OA(P<0.000 1,见图4)。
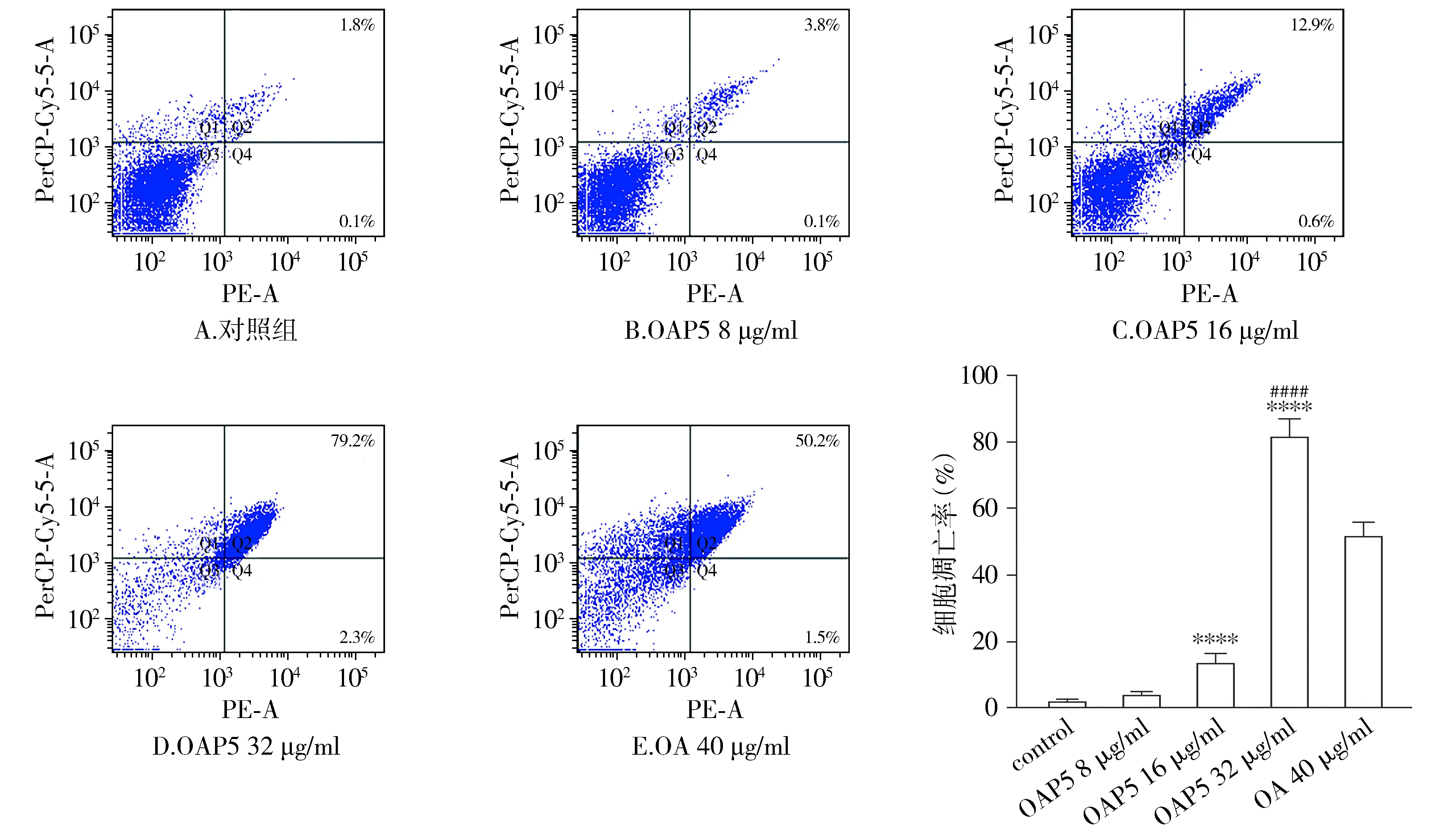
与对照组相比,****P<0.000 1,与OA 40 μg/ml组相比,####P<0.000 1图4 不同浓度OAP5对K562细胞凋亡的作用Figure 4 Effects of OAP5 in different concentrations on apoptosis of K562 cells
2.6 OAP5对K562细胞凋亡相关蛋白表达的影响
Western blotting结果显示,凋亡起始因子Caspase-9、凋亡执行因子Caspase-3及其下游底物PARP-1被活化剪切为cleaved Caspase-9(CASP9-C)、cleaved Caspase-3(CASP3-C)及cleaved PARP-1(PARP1-C)。cleaved Caspase-9(CASP9-C)、cleaved Caspase-3(CASP3-C)的含量随着药物浓度的升高而呈上升趋势,PARP-1蛋白含量随着药物浓度的升高呈下降趋势,cleaved PARP-1的含量基本以剂量依赖的方式变化,OAP5 32 μg/ml组剪切蛋白最明显,结果具有统计学差异(见图5)。
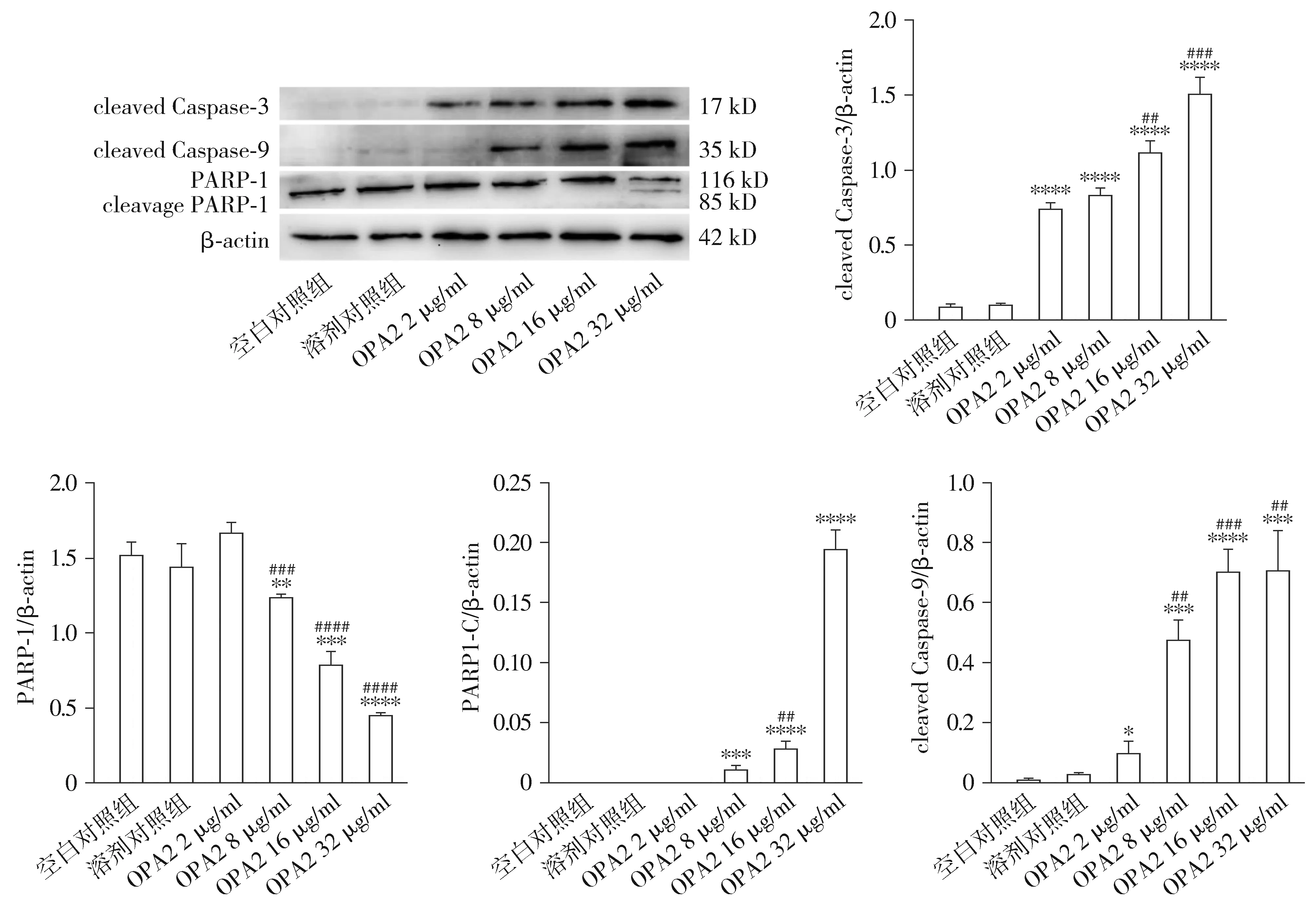
与空白对照组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;与OAP5 2 μg/ml组相比,#P<0.05,##P<0.01,###P<0.001,####P<0.000 1图5 不同浓度OAP5对K562细胞凋亡相关蛋白的影响Figure 5 Effects of different concentrations of OAP5 on the expression of apoptosis-related proteins in K562 cells
3 讨论
齐墩果酸已被广泛证实具有良好的抗肿瘤作用[26],且其来源丰富,副作用小,具有很高的药物开发价值,但因水溶性低、生物利用度差等缺陷,限制了其临床的应用,因此,以齐墩果酸为先导化合物,对其进行结构修饰,开发更优质的齐墩果酸衍生物成为本课题的重点。近年来,聚乙二醇作为FDA批准的亲水性材料,以其极佳的亲水性、柔软性及稳定性被广泛应用于纳米药物自组装领域[27],PEG形成的纳米衍生物能够提高药物的靶向性,较低相对分子质量的PEG能够提高载药量,对于较低半衰期的药物而言,PEG能够维持药物血液循环的时间,提高药效[28],与其他聚合物相比,细胞及蛋白的吸收量较低[29],因此,我们选择PEG5000对齐墩果酸进行结构修饰和自组装,获得齐墩果酸聚乙二醇自组装产物,命名为OAP5,粒径为(584.49±76.2)nm,结构为以疏水嵌段为核、亲水嵌段为壳的特殊“核-壳”结构,药物表征具有良好的亲水性和稳定性。
Caspase-9是线粒体凋亡途径中的重要成员,被激活后的Caspase-9进一步激活Caspase-3。Caspase-3是执行者,其蛋白分子量为32 kD,正常状况下,胞质中的Caspase-3蛋白以无活性的酶原(procaspase-3)形式存在。当细胞受到外界刺激发生凋亡时,Caspase-3在蛋白因子的辅助下可自发激活或被酶级联反应激活。当受到上游凋亡信号的刺激后,Procaspase-3被上游分子剪切成分子量为17 kD和15 kD的两个活性片段,被剪切后的活性片段cleaved Caspase-3又能进一步激活下游的凋亡信号,而Caspase-3最主要的底物为PARP-1,其参与DNA修复,且监护基因的完整性。在细胞凋亡启动时,PARP-1由116 kD被Caspase-3剪切,成为两个片段,分别为分子量为85 kD的大片段和31 kD的小片段,使细胞发生凋亡[30-32]。
本课题组的前期研究结果显示,OA可以通过促进K562细胞的凋亡而起到增殖抑制作用[33],本研究通过CCK-8实验发现OAP5抑制K562细胞增殖,呈浓度依赖性,且作用效果明显强于OA。镜下观察细胞形态也发生变化,32 μg/ml OAP5处理K562细胞后,细胞固缩变形,胞膜溶解,内容物泄出。流式细胞术显示OAP5呈剂量依赖性促进K562细胞凋亡。OAP5作用于K562细胞后表现出对Caspase-3、Caspase-9的活化,47 kD的Caspase-9被剪切成35 kD的cleaved Caspase-9,32 kD的Caspase-3被剪切成17 kD的cleaved Caspase-3及相应的PARP-1切割蛋白,且蛋白表达水平呈剂量依赖。
综上所述,本研究成功改构合成了齐墩果酸聚乙二醇自组装产物OAP5,OAP5通过促进K562细胞的凋亡而起到增殖抑制作用,且增殖抑制作用明显优于OA,为OA的抗慢性粒细胞白血病临床应用提供了新的思路,但OAP5对K562细胞增殖抑制的其他作用机制研究及体内实验还有待进一步研究。
致谢:感谢微生态-免疫调节网络与相关疾病黑龙江省重点实验室提供实验设备及技术支持。

