消退素D1改善2型糖尿病小鼠肝脏脂肪沉积
刘志红,刘 静,王瑞英
(河北医科大学第二医院内分泌科,石家庄 050000;*通讯作者,E-mail:wry0616@126.com)
胰岛素抵抗(insulin resistance, IR)是2型糖尿病至关重要的致病要素[1],慢性炎症侵害并阻碍胰岛素信号转导,降低靶器官胰岛素敏感性[2],脂肪等器官“代谢性炎症”的发生加重IR[3]。消退素D1(resolvin D1,RvD1)是一种有效的脂质介质,具备抗炎和促炎症衰退的作用[4,5]。核因子-κB(nuclear transcription factor-kappa B,NF-κB)是一种介导炎症信号的转录因子,NF-κB过表达能够抑制AKT的磷酸化,导致叉头转录因子1(forkhead box transcription factor 1,Foxo1)的表达增加[6],促进脂肪形成[7]。目前关于消退素能否通过减轻2型糖尿病小鼠肝脏炎症状态来缓解胰岛素抵抗及脂肪沉积的研究较少。因此,本实验通过给予2型糖尿病小鼠腹腔注射RvD1,探讨RvD1是否能下调肝脏NF-κB的表达,降低炎症状态,改善IR缓解肝脏脂肪沉积,为临床发现医治糖尿病新型药物提供基础依据。
1 材料和方法
1.1 试剂与仪器
小鼠超敏胰岛素ELISA试剂盒(美国ALPCO公司,批号:07511);TNF-α试剂盒(杭州联科生物技术股份有限公司,批号:A21300289)、IL-6 ELISA试剂盒(杭州联科生物技术股份有限公司,批号:A21800343);总胆固醇(total cholesterol,TC)(南京建成生物工程研究所,批号:20180306)、甘油三酯(triglyceride,TG)测定试剂盒(南京建成生物工程研究所,批号:20180203);苏木素伊红(hematoxylin-eosin staining,HE)染色试剂盒(北京索莱宝科技有限公司);RvD1(美国Cayman公司);兔p-AKT(Ser473)单克隆抗体(美国CST公司);兔NF-κB p65抗体(美国Santa Cruz公司);兔Foxo1抗体(美国CST公司);兔p-Foxo1抗体(美国CST公司)。EBA12R型低温离心机(德国Hettich公司);Multiskan FC型酶标仪(美国Thermo Fisher科技公司);EG1150型组织包埋机(上海徕卡仪器有限公司);DYY-Ⅲ型稳压稳流电泳仪(中国北京六一仪器厂);GDS8000凝胶成像仪(美国UVP公司)。
1.2 实验动物分组与模型制备
清洁级C57BL/6J雄性小鼠,30只,年龄6周,体质量21.0~23.0 g[合格证号:SCXK(京)2016-0006],购买自北京维通利华公司。将C57BL/6J小鼠随机分为两组:正常对照组(Con)10只(普通饲料喂养),糖尿病组(DM)20只(高脂饲料喂养)。分笼饲养(5只/笼),喂养8周后高脂饮食小鼠禁食8 h测量小鼠体质量后按100 mg/kg腹腔注射链脲霉素。3 d后断尾测空腹血糖(fasting blood glucose,FBG)≥16.7 mmol/L标志模型成功。血糖验证模型成功后随机将DM组小鼠分为DM组和DM+RvD1组,每组10只,连续3周给予DM+RvD1组每只小鼠腹腔注射RvD1(100 ng/d)[8],其余两组小鼠给予同体积0.9%氯化钠注射液。实验期间除Con组外其他小鼠均继续喂养高脂饮食,自由饮水。
1.3 胰岛素抵抗、血脂、炎症相关指标测定
所有小鼠干预结束后断尾,尾静脉测定空腹血糖,之后以2%戊巴比妥钠(45 mg/100 g)麻醉,摘眼球取血于抗凝管中,然后收集所有血液样品放到提前预冷到4 ℃的离心机,离心速度3 000 r/min,10 min,取上层血清保存。空腹胰岛素(fasting insulin,FINS)水平参照ELISA试剂盒说明书步骤进行,计算胰岛素抵抗指数(HOMA-IR)=(FBG×FINS)/22.5。应用酶标仪按照南京建成试剂盒说明书操作步骤测定TG和TC含量。TNF-α、IL-6水平测定步骤参照ELISA试剂盒说明书进行。使用多功能酶标仪测定450 nm吸光度值。
1.4 肝脏病理
苏木素-伊红染色法:取血后立即剪开小鼠腹腔,剔除周围筋膜,取1 cm2大小肝组织迅速放到4%多聚甲醛中,脱蜡至水,苏木素染色,之后梯度酒精脱水,伊红染色,脱水封片,切片机切片(5 μm),显微镜观察细胞分析图像。
油红染色:迅速取材的肝组织制作冰冻切片,避光环境下油红染色8~10 min,75%酒精分化,水洗,苏木素染色3~5 min,水洗,分化液分化,返蓝液返蓝后封片,显微镜观察细胞分析图像。
1.5 肝脏NF-κB p65和p-AKT蛋白表达量检测
Western blot法检测肝脏组织NF-κB p65、p-AKT、Foxo1、p-Foxo1蛋白表达,肝脏组织加入裂解液匀浆,进行蛋白定量。上样、SDS-聚丙烯酰胺凝胶系统电泳、转移至PVDF膜、脱脂奶粉封闭洗膜、加一抗、二抗、发光,应用ImageJ软件对灰度进行测量分析。
1.6 统计学方法
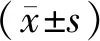
2 结果
2.1 消退素D1对小鼠生化指标的影响
三组小鼠FBG、TG、TC经方差分析,差异有统计学意义(P<0.05)。与Con组相比,DM组小鼠FBG、TG、TC水平升高(P<0.05);与DM组相比,DM+RvD1组三者水平下降(P<0.05)。同时三组小鼠HOMA-IR经方差分析,差异有统计学意义(P<0.05),与Con组相比,DM组小鼠HOMA-IR升高(P<0.05);与DM组相比,DM+RvD1组HOMA-IR下降(P<0.05,见表1)。
2.2 消退素D1对小鼠炎症指标的影响
三组小鼠TNF-α、IL-6水平经方差分析,差异有统计学意义(P<0.05)。与Con组比较,DM组TNF-α、IL-6水平升高(P<0.05);与DM组相比,DM+RvD1组两指标水平下降(P<0.05,见表1)。
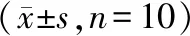
表1 各组小鼠糖脂代谢及炎症指标比较
2.3 消退素D1对小鼠肝脏病理的影响
Con组肝细胞脂肪沉积较少,脂滴空泡较少,无明显的脂肪变性;DM组肝脏脂肪沉积明显,脂肪变性显著,肝细胞脂滴空泡较多;DM+RvD1组与DM组比肝细胞脂肪变性显著减轻,脂滴空泡明显减少(见图1)。
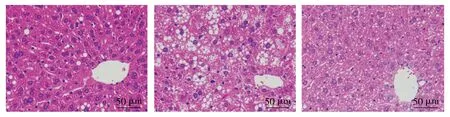
Con组 DM组 DM+RvD1组白色代表脂滴空泡,紫色代表细胞核图1 不同处理后小鼠肝脏组织的HE染色病理结果 (×40)Figure 1 Pathological changes of liver tissue of mice after different treatment by HE staining (×40)
2.4 消退素D1对小鼠肝脏脂质沉积的影响
Con组可见蓝色的细胞核,橘红色脂滴数量较少;DM组可见大量橘红色脂滴沉积;与DM组相比,DM+RvD1组的脂滴明显减少,数量介于Con组和DM组之间(见图2)。

Con组 DM组 DM+RvD1组蓝色代表细胞核,橘红色代表脂滴图2 不同处理后小鼠肝脏组织脂质沉积 (×40)Figure 2 Lipid deposition in liver tissue of mice after different treatment (×40)
2.5 消退素D1对小鼠肝脏的NF-κB p65、p-AKT、Foxo1、p-Foxo1蛋白量影响
三组小鼠肝脏NF-κB p65、Foxo1蛋白水平经方差分析,差异有统计学意(P<0.05);与Con组比较,DM组小鼠NF-κB p65、Foxo1蛋白水平升高;与DM组比较,DM+RvD1组NF-κB p65和Foxo1水平均下降(P<0.05)。三组小鼠肝脏p-AKT、p-Foxo1蛋白水平经方差分析,差异有统计学意义(P<0.05);与Con组相比,DM组小鼠p-AKT、p-Foxo1蛋白水平下降;与DM组比较,DM+RvD1组p-AKT、p-Foxo1蛋白水平升高(P<0.05,见图3)。

与Con组比较,*P<0.05;与DM组比较,#P<0.05图3 各组小鼠肝脏中NF-κB p65、p-AKT、Foxo1、p-Foxo1蛋白水平Figure 3 The levels of NF-κB p65, p-AKT, Foxo1, and p-Foxo1 protein in liver of mice
3 讨论
目前世界上糖尿病患者越来越多,研究者估计到2040年患病人数将高达6.42亿[9]。胰岛素抵抗是2型糖尿病、肥胖等代谢性疾病的发病的生理学基础。研究发现潜在的炎症似乎是IR的关键[10]。在超重和肥胖状态下脂肪细胞释放大量炎症介质如TNF-α、IL-6、抵抗素等[11],激活NF-κB、MAPK等通路,阻碍胰岛素受体底物(insulin receptor substrate,IRS)/磷脂酰肌醇3激酶(phosphatidyl inositol 3 kinase,PI3-K)/AKT胰岛素信号通路。TNF-α、IL-6同时能够使c-jun氨基末端激酶和细胞因子信号抑制物3活性增加,IRS丝氨酸磷酸化水平升高,酪氨酸磷酸化受阻,使通路下游的PI3K失活,从而导致IR。
研究发现补充鱼油能够有效改善2型糖尿病患者IR,使炎症介质水平下降[12],可能与鱼油中富含多不饱和脂肪酸有关。消退素是由人类白细胞转化不饱和脂肪酸生成的物质,包括E类消退素、D类消退素,其中对RvD1的研究较多。RvD1可促进炎症消退,并具有镇痛功效[13]。同时基础研究发现消退素D1可缓解糖尿病多种并发症,通过抑制NF-κB通路、抗氧化应激、升高一氧化氮水平等改善糖尿病肾病[14,15],并可减少高糖对原代视网膜感光细胞的线粒体损伤[16]。RvD1通过降低NLRP3炎性小体的激活水平和相关的细胞因子产生在STZ诱导的糖尿病性视网膜病变中起保护作用[14]。RvD1通过抑制NF-κB/iNOS改善胰岛素敏感性[17]。同时Hellmann等[18]发现RvD1可以使巨噬细胞在脂肪的聚集下降,从而降低肥胖糖尿病小鼠HOMA-IR,同时也发现自发2型糖尿病db/db小鼠应用RvD1 8~16 d后空腹血糖显著降低、胰岛素抵抗指数下降,脂肪组织p-AKT水平升高,本实验结果与之相符合。
研究证明消退素D1可减少体内TNF-α含量,抑制中性粒细胞性能,阻止炎症介质的产生,调节白细胞的积累和多形核中性粒细胞在炎症部位的浸润[19]。本研究发现,应用RvD1干预后,HOMA-IR指数及炎症因子TNF-α、IL-6水平均较糖尿病组下降,肝脏NF-κB p65蛋白下降,p-AKT程度升高,IR改善,同时p-AKT可以抑制Foxo1从肝细胞核的激活和易位,导致肝糖异生减少,减少脂肪合成原料[20],病理上肝脏脂肪变性减少,血脂水平下降。说明RvD1可能通过抑制NF-κB p65/p-AKT/Foxo1通路提高肝脏胰岛素敏感性改善脂肪变性。
本实验也有一定的局限性,研究发现[21]提高p-AKT水平可促使下游哺乳动物雷帕霉素靶蛋白(mTOR)磷酸化抑制脂联素的合成,从而导致固醇调节元件结合蛋白(SREBP)降低,抑制脂肪酸的从头合成,RvD1是否可影响该通路来改善肝脏脂肪沉积以及RvD1对NF-κB通路影响的具体机制及作用靶分子未进一步研究,需要后续进行大量动物及细胞实验进一步探讨。

