miR-223-3p调控人肝星状细胞增殖及迁移的作用及分子机制
胡毅翔,左清平,刘任祝,闫庆梓,邢琪昌,刘 湘*
(1湘潭市中心医院临床药学科,湘潭 411000;2长沙市第一医院药学部;*通讯作者,E-mail:hhyxhi@163.com)
炎症反应及氧化应激是导致大多数慢性肝脏疾病进展的常见原因,其中肝星状细胞(hepatic stellate cells,HSC)中NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)的表达上调可导致TGF-β1/Smad通路的激活以及HSC活化,是肝纤维化向肝硬化、肝癌转归的关键因素[1,2]。NLRP3炎症小体存在于各种内源性免疫细胞以及非免疫细胞,NLRP3/Caspase-1/IL-1β信号通路的激活可导致平滑肌肌动蛋白阳性细胞数量增加以及细胞外基质沉积,同时加速肝细胞的炎症性死亡,促进肝纤维化的进展[3]。近年来研究表明,miRNA类药物具有靶向性、选择性、副作用低等特点,以NLRP3及下游信号通路为靶点的miRNA类药物可能为肝纤维化的治疗提供新的突破口[4]。miR-223-3p是一种重要的miRNAs类调控分子,其通过对靶基因的调节实现多种生物学作用在肝脏疾病进展中发挥重要的调控作用[5],但关于miR-223-3p对肝星状细胞的调控作用目前仍不清楚。本研究旨在探究miR-223-3p对人肝星状细胞株LX-2增殖及迁移的影响及对NLRP3/Caspase-1/IL-1β信号通路的调控作用。
1 材料与方法
1.1 细胞株及主要试剂
人肝星状细胞LX-2细胞株购自中国科学院细胞库,转染试剂Lipofectamine 3000购自美国Invitrogen公司,OPTI-MEM、DMEM/F12培养基购自美国Gibco公司,CCK-8试剂盒购自南京凯基生物技术有限公司,荧光素酶检测试剂购自Promega北京生物技术有限公司,miR-223-3p模拟物mimics和阴性对照mimics购自广州瑞博生物科技有限公司,miR-223-3p模拟物序列为UGUCAGUUUGUCAAAUACCCCA,目标基因探针和内参基因探针均为5′端采用FAM报告荧光标记,3′端采用TAMRA淬灭荧光标记;NLRP3兔单克隆抗体购自美国Abcam公司,辣根过氧化物酶标记二抗购自北京中杉金桥公司,Transwell小室购自美国Millipore公司。
1.2 细胞培养
LX-2细胞用含10%胎牛血清及双抗(100 U/ml青霉素、100 U/ml链霉素)的DMEM/F12培养基培养,于37 ℃、5% CO2培养,待细胞融合度达90%时,用PBS液清洗2次,弃去培养瓶内PBS,滴入0.25%胰蛋白酶(不含乙二胺四乙酸)1 ml,按1 ∶3进行分瓶传代,取对数生长期细胞进行实验。
1.3 LX-2细胞诱导增殖
取对数生长期细胞LX-2接种于6孔板,调整细胞密度为1×105个/ml,置于37 ℃、5% CO2培养24 h。待细胞贴壁后,加入10 μg/L的转化生长因子-β1(transforming growth factor-β1,TGF-β1)刺激诱导24 h,吸出上清液,用含10%胎牛血清及双抗(100 U/ml青霉素、100 U/ml链霉素)的DMEM/F12培养基继续培养。
1.4 miRNA细胞转染
miRNA mimics及miRNA inhibitor冻干粉于13 000 r/min瞬时离心1 min,用DMEM/F12培养基溶解后稀释成10 μmol/L母液,于-80 ℃冰箱保存。取TGF-β1诱导的对数生长期LX-2细胞,采用胰酶消化1 min,重悬细胞于12孔板,调整细胞密度为1×105个/ml,于37 ℃、5% CO2培养箱中培养24 h。细胞铺满瓶底50%左右时,吸出12孔板中培养基,用PBS洗2次。将绿色荧光染料FAM(6-carboxyfluorescein N-hydroxysuccinimide ester)标记的miR-223-3p mimics、模拟物对照(NC mimics)分别转染LX-2细胞,另设空白对照组,加入等体积的转染溶剂。转染步骤如下:取5 ml EP管,分别加入OPTI-MEM 6 μl,加入10 μmol/L的miRNA mimics母液5 μl,轻轻混匀,室温下孵育5 min,加入Lipofectamine 3000后轻轻混匀,室温下孵育15 min,最后加入的OPTI-MEM至1 000 μl,将配置好的miRNA mimics转染液加入12孔板中,于37 ℃、5% CO2培养箱中转染8 h,去除转染液,加入1 ml的OPTI-MEM培养基继续培养24 h,于荧光显微镜下观察荧光强度及转染效率。
1.5 CCK-8检测细胞增殖
取处于指数生长期的各组细胞,调整细胞密度为2×105个/ml,接种于96孔板,37 ℃、5% CO2培养箱中过夜,按上述转染步骤进行miRNA转染,分别为空白对照组、miR-223-3p mimics组(200 nmol/L)、NC mimics组(200 nmol/L)。次日,待细胞贴壁后,在样品中加入DMEM/F12培养基90 μl和CCK-8溶液10 μl,同时设置只含有培养基和CCK-8溶液的空白对照孔,孵育2 h,用酶标仪测定吸光度(A450)。分别于转染后24 h和48 h检测96孔板吸光度,以各组细胞A值减去对应空白组A值,根据标准曲线,计算各组细胞增殖。
1.6 划痕实验检测细胞迁移能力
将处于对数生长期的细胞按1×106/ml铺在6孔培养板,待细胞达到80%~90%融合时,尽量垂直于细胞上用无菌移液枪吸头(200 μl)划出一条细痕,PBS清洗3次,去除漂浮细胞,再加入含2.5%胎牛血清的DMEM培养基,置于37 ℃、5% CO2培养箱培养24 h,4%多聚甲醛固定,显微镜下通过测量划痕宽度代表迁移能力。
1.7 双荧光素酶报告
采用预测软件Targetscan(http://www.targetscan.org)和miRanda(http://www.microrna.org/microrna/home.do)预测miR-223-3p的靶基因,构建NLRP3野生型(NLRP3-WT-Luc)与突变型(NLRP3-MUT-Luc)荧光素酶报告基因质粒,将NLRP3-WT-Luc和NLRP3-MUT-Luc与miR-223-3p mimics和阴性对照(miRNA mimics随机序列)同时转染到LX-2细胞内。转染48 h,去除细胞培养液,获取细胞,检测萤火虫荧光素酶(Firefly)的活性。最终以miR-223-3p mimics组与阴性对照荧光强度比值作为NLRP3 mRNA相对表达量数值,最终以二者的比值作为相对表达量数值(Firefly/Renilla)。
1.8 实时荧光定量PCR检测NLRP3、Caspase-1、IL-1β mRNA表达水平
取上述给药处理后的LX-2细胞,超声机粉碎后清洗干净,加入TRIzol试剂1 ml,吹打数次,静置5 min。按照RNA提取试剂盒说明书,提取总RNA,逆转录成cDNA,采用实时荧光定量PCR法检测NLRP3、Caspase-1、IL-1β mRNA表达情况,反应条件:分别在95 ℃环境下预变性10 min,在60 ℃环境下退火30 s,PCR反应共进行35个循环,72 ℃延伸8 min,反应体系为20 μl,各设置3个复孔,实验重复3次,以U6为内参基因,目的基因及内参基因的引物序列见表1。NLRP3、Caspase-1、IL-1β mRNA相对表达量用2-ΔΔCt法进行计算。

表1 引物序列
1.9 Western blot检测NLRP3蛋白表达
取上述给药处理后的LX-2细胞,用PBS洗2次,加人细胞裂解液(RIPA)提取细胞总蛋白,100 ℃变性8 min。采用BCA法进行蛋白定量试,制作10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳胶,置于电泳槽,每孔加入20 μl的样品,以110 V恒压电泳60 min。根据Marker和分子量将膜上含β-actin,以及对应蛋白分别切下,加入相应的NLRP3、Caspase-1、IL-1β一抗(稀释比例1 ∶200),冰上孵育过夜;TBST缓冲液洗膜3次,每次10 min。加入对应的二抗,室温孵育1 h;TBST缓冲液洗膜3次,每次10 min。内参β-actin以1 ∶2 000溶于T-TBS(含3%脱脂奶粉)中;制备约1 ml ECL工作液,室温孵育转印膜1 min,除去多余ECL试剂,暗盒中放上X-ray曝光5~10 min后进行显影和定影。
1.10 统计学分析
2 结果
2.1 miR-223-3p对LX-2细胞的转染效率验证
将200 nmol/L绿色荧光染料FAM标记的miR-223-3p mimics和未标记的miR-223-3p mimics分别转染LX-2细胞24 h,在荧光显微镜下观察,结果显示,转染效率达90%以上(见图1),由于mimics用绿色荧光染料FAM标记,转染成功后细胞发绿色荧光。
2.2 CCK-8实验检测miR-223-3p对LX-2细胞增殖的抑制作用
采用CCK-8实验研究miR-223-3p对LX-2细胞增殖的影响,结果显示miR-223-3p mimics组相对于空白对照组,转染24 h LX-2细胞增殖被显著抑制(P<0.05)。转染48 h miR-223-3p mimics对LX-2细胞增殖的抑制作用进一步增强,miR-223-3p mimics组与NC mimics组相比差异有统计学意义(P<0.05),其中转染miR-223-3p mimics 48 h抑制率可达42.21%±6.32%,而转染NC mimics后,对LX-2细胞的增殖活力无显著影响(见表2)。以上结果提示miR-223-3p可以显著抑制LX-2细胞的增殖活力。
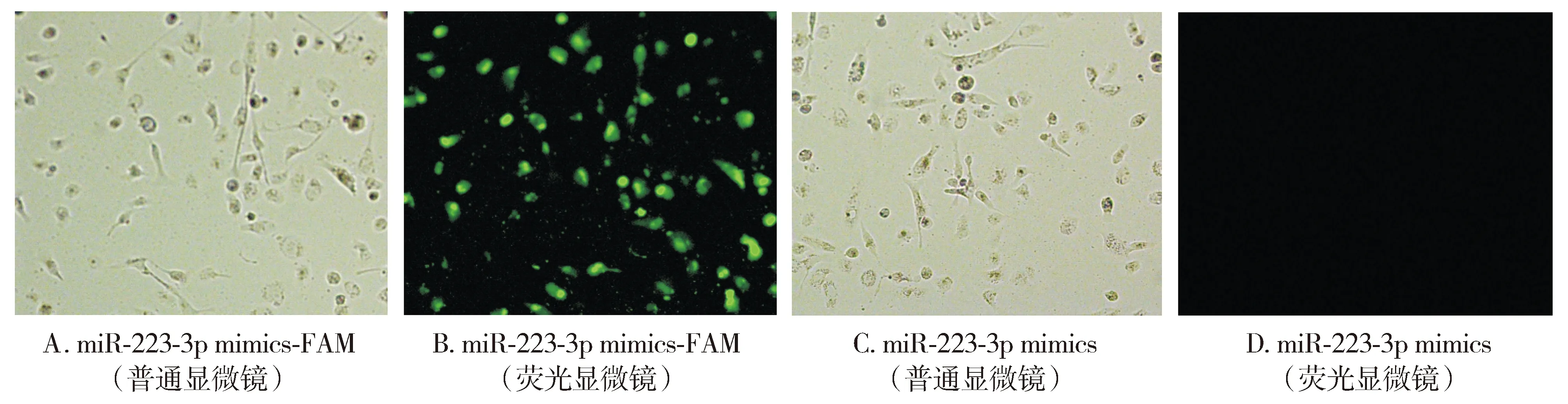
图1 miR-223-3p mimics转染LX-2细胞的效率 (×400)Figure 1 Transfection efficiency of miR-223-3p mimics in LX-2 cells (×400)

表2 CCK-8检测各组LX-2细胞的增殖能力
2.3 划痕实验检测miR-223-3p对LX-2细胞迁移的抑制作用
划痕实验检测结果显示,与空白对照组相比,miR-223-3p mimics组转染48 h LX-2细胞迁移能力被显著抑制,而转染48 h,NC mimics组LX-2细胞迁移能力与空白对照组相比无显著差异(见图2,表3),提示miR-223-3p mimics可抑制LX-2细胞的迁移。

图2 miR-223-3p mimics抑制LX-2细胞的迁移Figure 2 miR-223-3p mimics inhibits the migration of LX-2 cells

表3 划痕实验检测LX-2细胞迁移能力
2.4 miR-223-3p靶基因结合位点分析
采用在线miRNA靶基因预测数据库Targetscan(http://www.targetscan.org)、miRanda(http://www.microrna.org/microrna/home.do)对miR-223-3p靶基因进行预测,结果显示NLRP3与miR-223-3p碱基序列存在8个连续的碱基互补配对(见图3),表明NLRP3可能为miR-223-3p的下游靶基因。

图3 miR-223-3p与靶基因NLRP3结合位点分析Figure 3 Analysis of binding site of miR-223-3p to target gene NLRP3
2.5 双荧光素酶报告分析结果
为了验证miR-223-3p能否识别NLRP3-3′UTR区域,本实验将miR-223-3p mimics与包含NLRP3 3′UTR(WT)区域以及荧光素酶报告基因的质粒共转染入LX-2细胞,转染24 h,测定荧光活性。与mimics阴性对照(NC mimics)组相比,miR-223-3p mimics与pMIR-REPORTER-NLRP3-WT-luc共转染可显著降低NLRP3的3′UTR区荧光素酶活性,差异具有统计学意义(P<0.01),而pMIR-REPORTER-NLRP3-MUT-luc和miR-223-3p mimics及NC mimics组共转染对荧光素酶活性均无显著影响(见图4)。

与NC mimics组相比,**P<0.01图4 双荧光素酶实验检测miR-223-3p mimics与NLRP3的靶向结合作用Figure 4 Verification of targeted binding of miR-223-3p mimics to NLRP3 by dual luciferase assay
2.6 实时荧光定量PCR检测结果
实时荧光定量PCR检测结果显示,与空白对照组及NC mimics组相比,miR-223-3p mimics组LX-2细胞中NLRP3、Caspase-1、IL-1β mRNA表达量均显著下降(P<0.05),而NC mimics组NLRP3、Caspase-1、IL-1β mRNA表达与空白对照组相比差异无统计学意义(P>0.05,见表4)。

表4 RT-qPCR法检测NLRP3、Caspase-1、IL-1β mRNA相对表达量
2.7 Western blot检测结果
Western blot结果显示,与空白对照组及NCmimics组相比,miR-223-3p mimics组LX-2细胞中NLRP3蛋白表达量均显著下降(P<0.05),而NC mimics组NLRP3蛋白表达与空白组相比差异无统计学意义(P>0.05,见图5),提示miR-223-3p mimics可抑制NLRP3蛋白的表达水平。

与空白对照组和NC mimics组比较,*P<0.05图5 Western blot法检测NLRP3蛋白表达情况Figure 5 Expression of NLRP3 in LX-2 cells by Western blot;
3 讨论
肝星状细胞在多种肝脏疾病进展过程中均具有重要的调控作用,肝损伤可诱导肝星状细胞增殖、活化并分泌大量细胞外基质(extracellular matrix,ECM)及炎症细胞因子[6]。人肝星状细胞LX-2细胞属于人肝内非实质性细胞,位于肝窦周围的Disse间隙内,大约占肝细胞总数的5%~8%[7,8]。在正常生理情况下,LX-2细胞表现为静止表型,在多种促炎症因子的作用下,LX-2细胞由静止表型转化为活化表型,分泌合成大量细胞外基质(extracellular matrix,ECM),同时活化的LX-2细胞具有增殖、迁移、分泌炎症因子等特性,进一步促进肝细胞焦亡[9,10]。NLRP3炎症小体是细胞焦亡的关键起始位点之一,主要由NOD样受体NLRP3,衔接分子ASC以及效应分子pro-caspase-1组成[11]。在各种炎症因此刺激下,NLRP3炎症小体聚集并裂解pro-caspase-1前体形成其活化形式,继而活化的caspase-1以蛋白水解的方式裂解炎症介质pro-IL-1β和IL-18成其成熟状态,并分泌到细胞外导致细胞焦亡的发生[12]。其中肝星状细胞中NLRP3的表达上调导致炎症、焦亡通路激活刺激HSC活化,是肝纤维化向肝硬化、肝癌转归的关键因素[13]。NLRP3炎症小体存在于各种内源性免疫细胞以及非免疫细胞,NLRP3/Caspase-1/IL-1β信号通路的激活,可导致平滑肌肌动蛋白阳性细胞数量增加以及细胞外基质沉积,同时加速肝细胞的炎症性死亡[14]。研究表明,miRNA类药物具有靶向性、选择性、副作用低等特点,以NLRP3及下游信号通路为靶点的miRNA类药物可能为肝脏疾病的治疗提供潜在靶点[15]。
miRNAs是一类特殊的非编码单链小分子RNA,由20~25个核苷酸组成,生物信息学家预测人体50%~60%的编码蛋白基因可能受miRNA调控。大量研究证实,miRNA可通过抑制靶mRNA翻译而降低相应蛋白合成,对基因表达、蛋白重组、细胞生长、机体应激等生理生化活动以及疾病发生发展过程具有深远和复杂的效应,可作为疾病早期诊断及预后的新型生物标志物,亦可作为药物干预的新靶点和新途径[16]。近年来研究发现,miRNAs可通过调节肝星状细胞的增殖、迁移及活化等过程,从而调控肝脏疾病的发生发展。例如,据报道miR-122在肝纤维化患者血清中显著高表达,并与患者预后相关,提示miR-122可能在药物诱导的肝损伤中具有作为循环生物标志物的潜力[17]。研究发现,miR-29b通过靶向作用于Smad3调控TGF-β1表达抑制肝星状细胞的活化,抑制ECM及炎症因子的表达[18]。miR-223-3p属于miR-223家族一员,在胚胎组织中几乎不表达,在成熟组织细胞中广泛表达,miR-223-3p具有多种生物学功能,是一种作用广泛的miRNAs分子。研究表明,miR-223-3p可抑制肝细胞炎症性损伤,减少肝细胞炎症因子表达,进而抑制肝纤维的进展[19]。Ji等[20]的研究发现,Hsa_circ_0070963可通过调控miR-223-3p和LEMD3的表达抑制HSC的激活,提示Hsa_circ_0070963可能成为肝纤维化的潜在治疗靶点。Calvente等[21]的研究表明,巨噬细胞能够调控miR-223-3p的表达从而逆肝细胞炎症状态,通过给予miR-223-3p模拟物可恢复小鼠中性粒细胞水,提示其具有免疫调控作用。
本研究表明,miR-223-3p可显著抑制TGF-β1诱导的LX-2细胞增殖,同时对LX-2细胞的迁移具有显著的阻抑作用,采用miRNA靶基因预测数据库Targetscan、miRanda对miR-223-3p靶基因进行预测,发现NLRP3与miR-223-3p碱基序列存在8个连续的碱基互补配对,提示NLRP3可能为miR-223-3p的下游靶基因,通过将miR-223-3p mimics与包含NLRP3 3′UTR(WT)区域以及荧光素酶报告基因的质粒共转染入LX-2细胞,结果显示miR-223-3p可识别NLRP3-3′UTR区域,miR-223-3p可直接靶向NLRP3的3′UTR区域,抑制NLRP3的表达水平。实时荧光定量PCR及Western blot检测结果显示,与空白对照组及NC mimics组相比,miR-223-3p mimics组LX-2细胞中NLRP3、Caspase-1、IL-1β mRNA及蛋白的表达量均显著下降,结果具有统计学差异,提示miR-223-3p mimics可抑制NLRP3/Caspase-1/IL-1β信号通路的激活,阻断下游细胞因子表达。综上所述,miR-223-3p可靶向作用于NLRP3/Caspase-1/IL-1β信号通路从而抑制人肝星状细胞株LX-2的增殖及迁移。

