绿海龟细菌性疾病流行病学调查
叶明彬 马艳平 梁志凌 马江耀 冯国清 陈华灵 王付民 麦瑞琼 刘振兴*
(1.广东惠东海龟国家级自然保护区管理局,惠东,516359;2.广东省农业科学院动物卫生研究所,广东省畜禽疫病防治研究重点实验室,农业农村部兽用药物与诊断技术广东科学观测实验站,广州,510640)
绿海龟(Cheloniamydas)是海洋生态系统的重要维护者[1-3],具有极高的科研、观赏、生态和文化价值。2004年绿海龟被IUCN列为濒危物种,2007年又被CITES列为附录Ⅰ,世界自然基金会(WWF)把绿海龟列为濒危物种,我国也将其列为一级保护动物[4-6]。
绿海龟保护中除需要应对全球变暖导致的种群性别失衡及海平面上升导致的产卵场破坏、海洋垃圾污染、渔业生产导致海洋生物栖息地急剧减少等全球性难题外[7-10],绿海龟自身还面临着病毒、细菌、寄生虫等多种病原的威胁[11-18],尤其是稚龟,因其自身免疫系统不完善,更容易受到病原微生物感染,其中细菌是最为严重的感染性病原。目前对绿海龟细菌性病原的分离、致病力与耐药性研究较少,影响了绿海龟繁育与保护的进一步发展。
本研究针对广东惠东海龟国家级自然保护区患病绿海龟(稚龟)疑似病原菌分离鉴定与抗生素耐药性分析,并对部分分离菌株进行致病力评价,为绿海龟细菌病防控及其绿海龟保护和救护提供了临床数据。
1 材料与方法
1.1 样品来源
采样绿海龟(稚龟,体重30~100 g)均来自广东省惠东海龟国家级自然保护区。患病龟多表现为鼻腔、口腔溃疡,颈部皮肤、鳍状肢皮肤溃烂,皮肤结节,背甲溃烂,部分病龟眼部分泌物增多、流脓。
1.2 试验材料
血琼脂平板、TCBS(thiosulfate citrate bile salts sucrose agar)培养基、MH(Mueller-Hinton)培养基、LB(Luria-Bertani)肉汤培养基及细菌生化鉴定管购自广东环凯微生物科技有限公司;细菌DNA提取试剂盒购自西安天隆科技有限公司;ExTaqMix和pMD18-T载体购自宝日医生物技术(北京)有限公司;大肠杆菌DH5α感受态购自北京擎科生物科技有限公司;药敏纸片购自杭州微生物试剂有限公司。
1.3 细菌分离纯化
2019—2021年,对100余只患病龟溃疡鼻腔、溃疡或溃烂口腔、溃疡或红肿泄殖腔、溃烂表皮、皮肤结节等病灶进行细菌分离纯化。用无菌剪刀剪开鼻黏膜、口腔黏膜、泄殖腔黏膜、眼黏膜溃疡表皮,无菌拭子蘸取病变部位脓液,分别在血平板和TCBS平板上划线;对于溃烂表皮、皮肤结节等处,先用75%乙醇擦拭表面,再用无菌解剖剪在病灶上剪开缺口,将无菌接种环深入其中,划线于血平板与TCBS平板上。病龟取样后创面用75%乙醇消毒隔离饲养。所有平板均于培养箱中30 ℃倒置培养24 h,挑取形态一致的优势单菌落进行革兰氏染色,并将优势单菌落接种至LB培养基,30 ℃扩大培养24 h。
1.4 菌种鉴定
1.4.1 细菌16S rRNA序列PCR扩增
取5 mL扩大培养的菌液,按照天隆细菌DNA提取试剂盒说明书提取菌体DNA作为PCR扩增模板。细菌通用16S rRNA基因引物(16S-27F:5′-AGAGTTTGATCMTGGCTCAG-3′;16S-1541R:5′-AAGGAGGTGA-TCCAGCCGCA-3′)[19]送北京擎科生物科技有限公司合成,作为PCR扩增引物。PCR扩增体系:2×TaqMix 25 μL,16S-27F引物(10 μmol/L)1 μL,16S-1541R引物(10 μmol/L)1 μL,DNA模板2 μL,ddH2O补足至50 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃再延伸8 min。随后,PCR产物通过1%琼脂糖凝胶电泳(120 V,30 min)分析扩增片段是否符合预期。
1.4.2 16S rRNA T克隆载体的构建与测序
确定扩增片段符合预期后,切胶纯化回收目的片段,取4 μL目的片段,加入1 μL pMD18-T载体,5 μL Solution Ⅰ,混合均匀,16 ℃作用2 h,取8 μL连接产物转化大肠杆菌DH5α感受态细胞,涂布Amp+LB固体培养基,37 ℃倒置培养过夜,随后挑取单克隆,利用16S rRNA引物进行PCR鉴定,阳性克隆送北京擎科生物科技有限公司测序,BLAST比对。同源性≥99.0%,可以定义到种;同源性97.0%~98.9%,可以定义到属水平。
1.4.3 弧菌细菌生化鉴定
挑取16S rRNA鉴定成功的弧菌单菌落至无菌生理盐水中,制备成0.5麦氏浊度标准管浓度(约1.5×108cfu/mL),按照使用说明书接种到细菌生化鉴定管中,参照《常见细菌系统鉴定手册》[20]及广东环凯微生物科技有限公司弧菌生化鉴定盒判定标准,对分离菌株生化鉴定。
1.5 分离菌株毒力分析
试验用中华草龟(Chinemysreevesii),体重(90±10)g,购自广州市某草龟养殖场。随机采集5只试验龟,用无菌拭子分别刮取鼻腔、口腔和泄殖腔黏膜,划线于血平板和TCBS平板上,30 ℃倒置培养24 h,鉴定全部分离菌株,确保试验龟不携带溶藻弧菌(Vibrioalginolyticus)。随机分为36组,每组10只,在40 cm×40 cm×30 cm玻璃缸暂养2周,每天饲喂2次,换水1次。取扩大培养的7株溶藻弧菌,接种TCBS液体培养基,30 ℃培养24 h后,10倍梯度稀释5个梯度,取100 μL涂布TCBS固体培养基,30 ℃培养24 h后计数。7株菌液均调整至109、108、107、106、105cfu/mL,各浓度以0.5 mL剂量后脚窝部位腹腔注射攻毒,每天观察攻毒龟发病症状,记录死亡率。
1.6 药敏试验
参照纸片扩散法(K-B法)进行抗生素药敏试验,检测分离菌株对氟苯尼考、恩诺沙星、多西环素、新霉素和复方新诺明的耐药性。步骤:取200 μL 0.5麦氏浊度(约1.5×108cfu/mL)剂量的菌悬液均匀涂布于含0.1% NaCl的MH琼脂平板,每个平板均匀粘贴6个药敏纸片,于30 ℃培养箱倒置培养12 h,测量并记录抑菌圈直径,依据中华人民共和国卫生部医政司WS/T 125—1999纸片法抗菌药物敏感试验标准判断分离菌株的药物敏感性。
1.7 统计学分析
分离菌株LD50测定采用SPSS概率单位加权回归法检验。2019—2020年分离菌株耐药率与2021年分离菌株差异分析采用SPSS交叉表卡方检验,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与分析
2.1 细菌分离鉴定
2019—2021年,从100余只患病龟病变部位划线接种,分别挑取血琼脂平板具有溶血活性的优势单菌落、TCBS平板上优势单菌落,进行革兰氏染色,结果显示均为革兰氏阴性菌。挑取优势单菌落接种至液体培养基,扩大培养,共分离得到疑似病原菌45株。以疑似病原菌提取DNA为模板,进行16S rRNA序列扩增,结果均扩增得到1 515 bp的目的片段(图1)。

图1 分离菌株16S rRNA鉴定结果Fig.1 16S rRNA identification result of isolated strains 注:M.DL2000 DNA Marker;1~45.分离菌株;-.空白对照 Note:M,DL2000 DNA Marker.1-45,Isolated strain.-,Blank control
切胶回收目的片段,连接pMD18-T载体,经PCR鉴定后,重组质粒送测序公司测序。测序结果与GenBank数据库细菌16S rRNA基因序列同源性均在99.0%以上,可以确定为同一种。因此根据16S rRNA鉴定结果,从绿海龟体表溃疡表皮、皮肤结节、口腔拭子、泄殖腔拭子、鼻拭子和眼拭子共分离鉴定了绿海龟疑似病原菌45株,涉及10个菌属,其中占比最高的是弧菌属(Vibrio)细菌,共19株,占42.22%,分别为溶藻弧菌7株,哈维氏弧菌(V.harveyi)4株,副溶血弧菌(V.parahaemolyticus)1株,弗尼斯弧菌(V.furnissii)2株,溶珊瑚弧菌(V.coralliilyticus)1株,河流弧菌(V.fluvialis)1株,锡那罗州弧菌(V.sinaloensis)1株,塔式弧菌(V.tubiashii)1株,东方弧菌(V.orientalis)1株;乳球菌属(Lactococcus)细菌7株,占15.56%,其中乳酸乳球菌(L.lactis)5株,格氏乳球菌(L.garvieae)2株;其他菌株占比少(表1)。
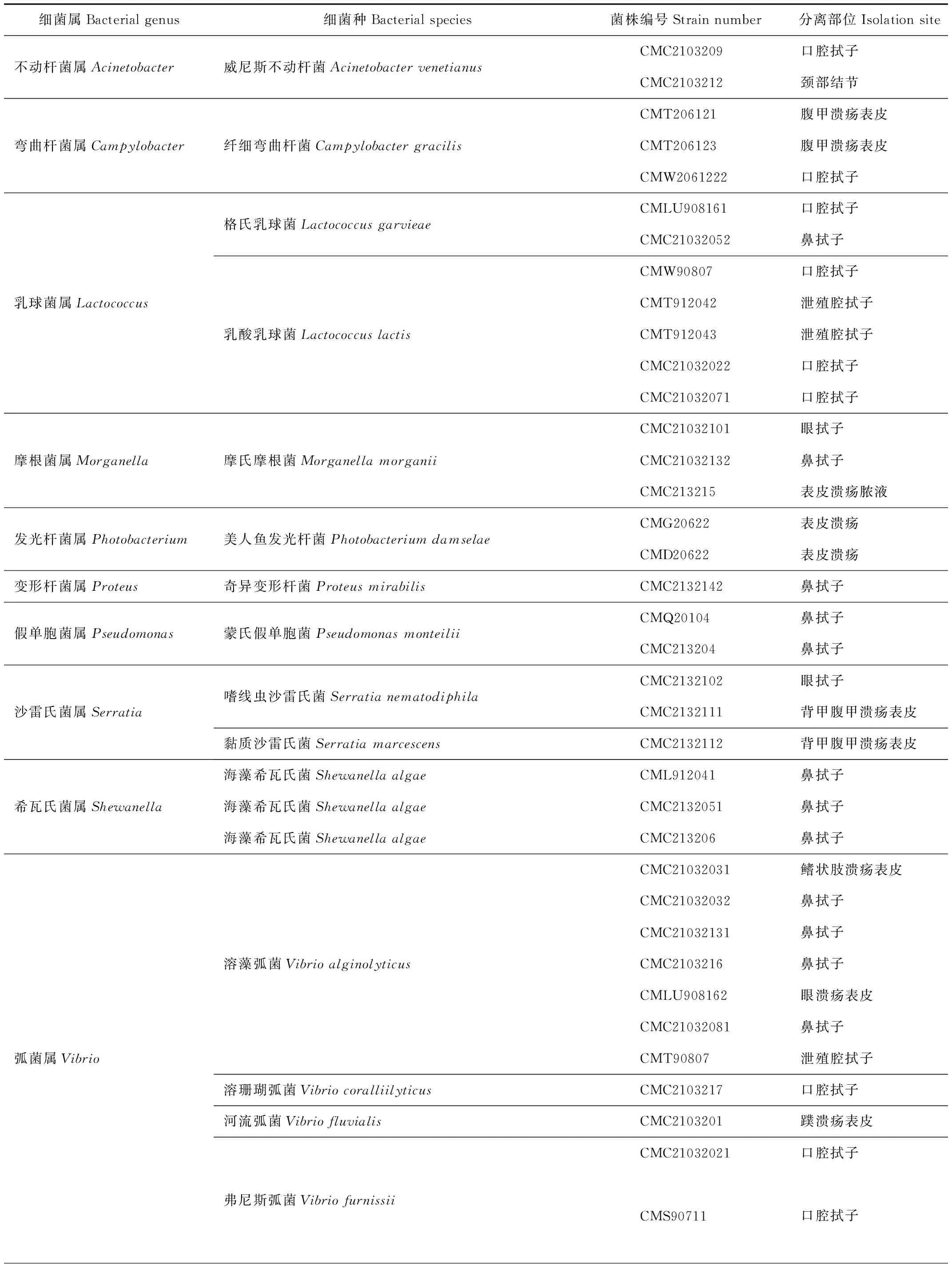
表1 绿海龟分离疑似病原菌汇总

续表1
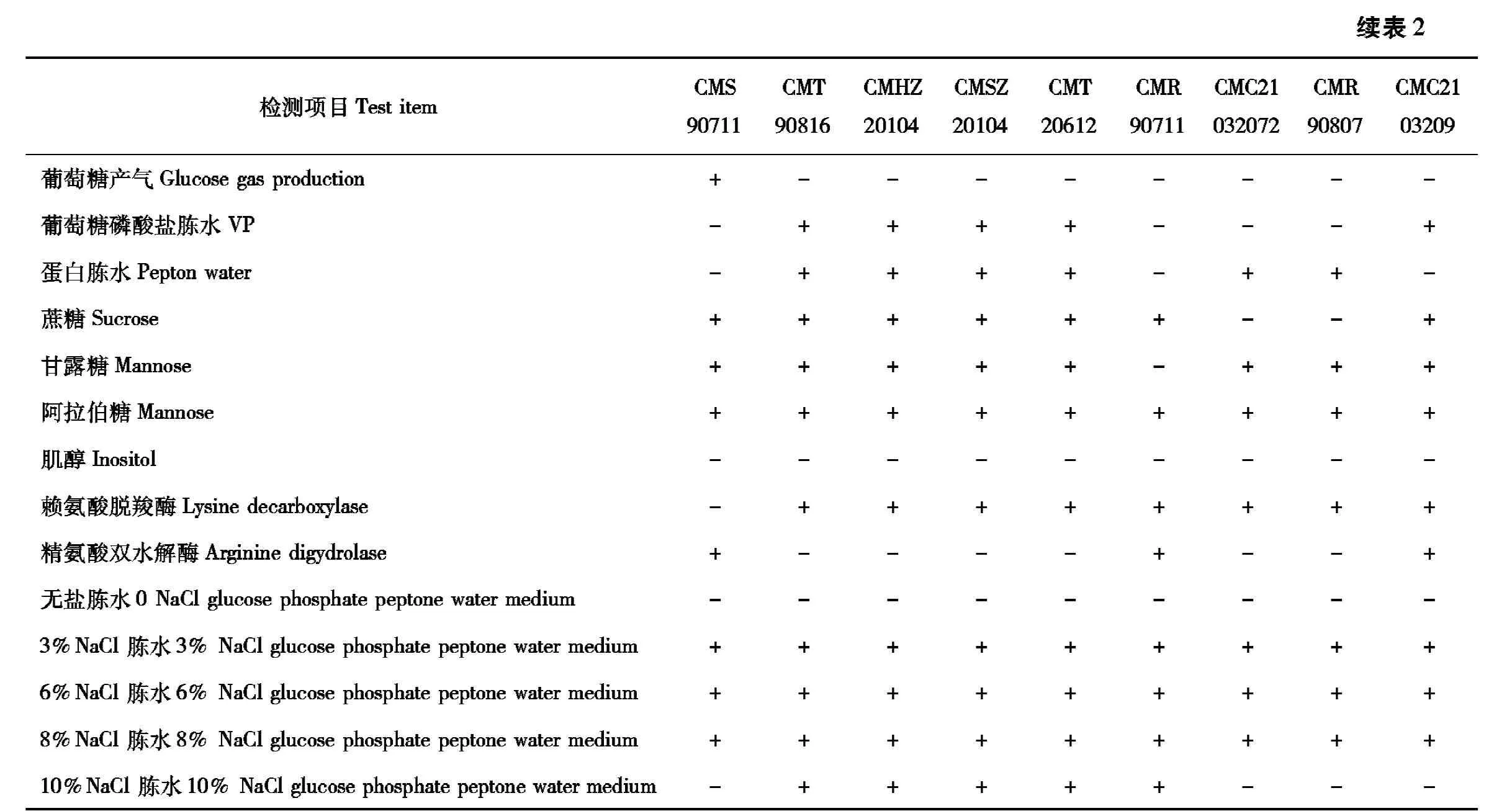
2.2 分离弧菌生化鉴定结果
根据19株分离弧菌的16S rRNA鉴定结果选取生化鉴定管进一步生化鉴定(表2)。按照《常见细菌系统鉴定手册》以及广东环凯微生物科技有限公司弧菌科(Vibrionaceae)细菌生化鉴定盒判定标准,生化鉴定结果与16S rRNA鉴定结果一致。

2.3 分离菌株毒力分析
溶藻弧菌CMT90807、CMC21032031、CMC21032032、CMC21032131、CMC2103216、CMLU908162、CMC2103-2081株均以109、108、107、106、105cfu/mL、0.5 mL剂量腹腔注射中华草龟,每天记录死亡率。除CMC21032031株处理在第4天出现死亡外,其他6株处理均在第2天就出现死亡,7株弧菌109cfu/mL剂量处理死亡率均达到100%(表3),据SPSS软件概率单位加权回归法分析,CMT90807、CMC21032031、CMC21-032032、CMC21032131、CMC2103216、CMLU908162、CMC21032081株LD50分别为7.40×107、2.59×108、6.35×106、7.22×107、7.22×107、2.99×106、7.22×106cfu/mL。发病龟为鳍状肢皮肤溃烂,背甲溃烂,剖解死亡龟,均肝脏充血坏死;肠道出血,肠腔充满炎性脓液;脾脏肿胀坏死(图2)。对病变组织制作石蜡切片,肠道表现为肠绒毛增粗,结构紊乱,损伤脱落,基底层肿胀,炎性细胞浸润;肝脏有广泛团状出血灶,肝细胞肿大;脾脏有明显的坏死灶,淋巴鞘结构损坏(图3)。在肠道、肝脏和脾脏均能重新分离并鉴定到溶藻弧菌优势菌落。
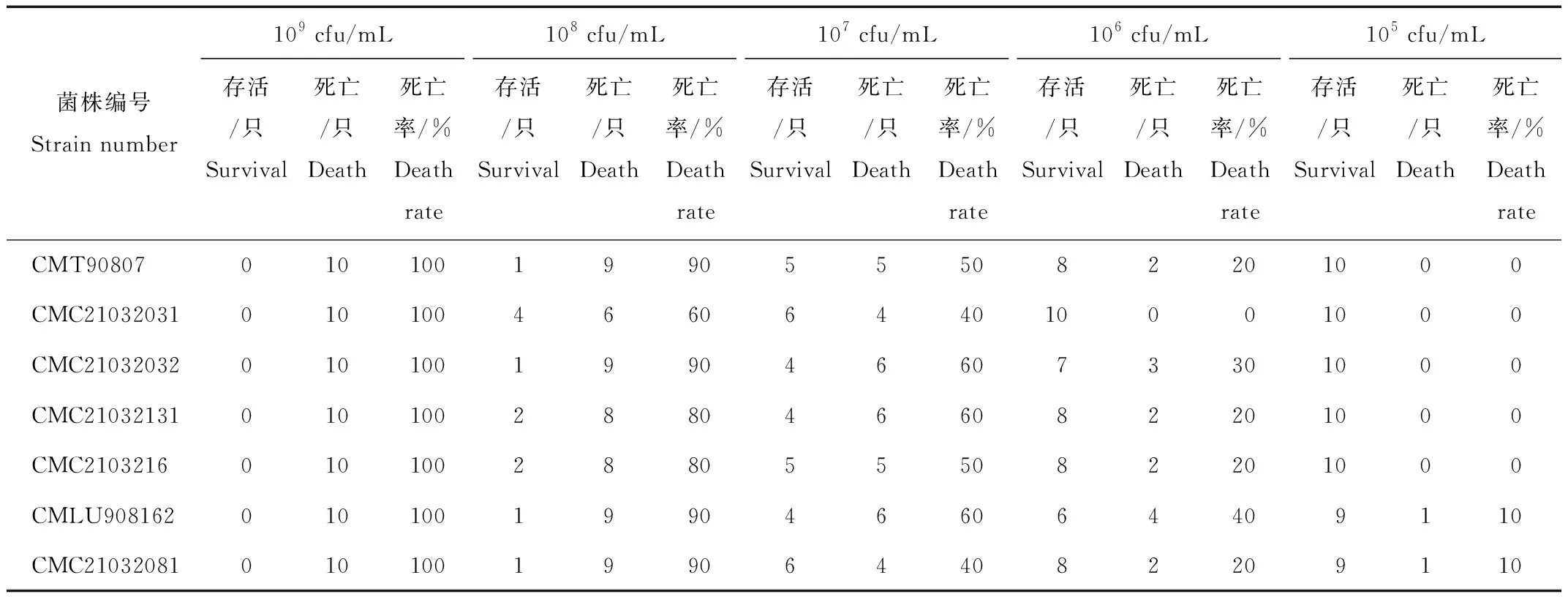
表3 分离菌株攻毒后中华草龟死亡率
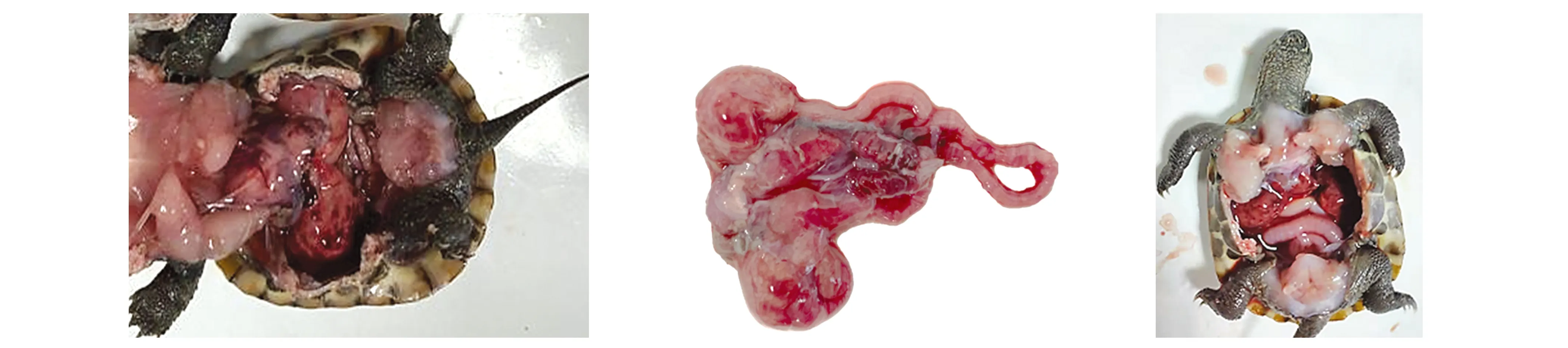
图2 攻毒后死亡中华草龟剖解结果Fig.2 Anatomical symptoms of dead Chinemys reevesii post infection
2.4 细菌耐药性
2019—2021年,在患病的绿海龟病变组织、器官中分离并鉴定45株疑似病原菌,用K-B药敏纸片法检测了分离的疑似病原菌对氟苯尼考、恩诺沙星、复方新诺明、盐酸多西环素、硫酸新霉素和环丙沙星的耐药性。45株菌株对盐酸多西环素和复方新诺明2种抗生素的耐药性较高,耐药率分别为55.56%和53.33%。对硫酸新霉素、氟苯尼考、恩诺沙星和环丙沙星耐药性较低,耐药率分别为37.78%、31.11%、28.89%和15.56%(图4),结果表明,分离菌株对水产养殖允许使用的抗生素产生了不同的耐药性。

图4 45株分离菌株耐药性Fig.4 Antibiotic resistance of 45 isolated strains 注:R.耐药;I.中度敏感;S.敏感;A.氟苯尼考;B.恩诺沙星;C.复方新诺明;D.盐酸多西环素;E.硫酸新霉素;F.环丙沙星。环丙沙星指维生素C磷酸酯镁盐酸环丙沙星预混剂,其他抗生素均指水产用抗生素粉剂。下同 Note:R,Resistance.I,Intermediate.S,Sensitive.A,Florfenicol.B.Enrofloxacin.C,Compound sulfamethoxazole.D,Doxycycline.E,Neomycin sulfate.F,Ciprofloxacin.Ciprofloxacin refers to magnesium ascorbic acid phosphate and ciprofloxacin hydrochloride premix, other antibiotics refer to aquatic antibiotic powders. The same as below
2.5 2019—2020年与2021年分离菌株耐药率差异
通过对2019—2020年与2021年分离菌株耐药率对比分析可见(表4),2019—2020年,分离的21株菌对氟苯尼考、恩诺沙星、复方新诺明、盐酸多西环素、硫酸新霉素和环丙沙星的耐药率分别为47.62%、38.10%、61.90%、57.14%、76.19%、23.81%。2021年,分离的24株菌,对氟苯尼考、恩诺沙星、复方新诺明、盐酸多西环素、硫酸新霉素和环丙沙星的耐药率分别为16.67%、20.83%、45.83%、54.17%、4.17%、8.33%。经卡方检验分析,除盐酸多西环素外,2021年分离菌株对氟苯尼考、恩诺沙星、复方新诺明、硫酸新霉素、环丙沙星耐药率较2020年有极显著性降低(P<0.01)。

表4 2019—2020年与2021年分离菌株耐药率
3 讨论
生态意识、环保意识的逐渐增强推动了中国(大陆)的绿海龟保护研究,广东惠东海龟国家级自然保护区是目前亚洲大陆唯一的海龟保护区,中国的绿海龟保护成为全球绿海龟保护的重要组成部分。2017年广东惠东海龟国家级自然保护区成功实现了绿海龟人工繁殖,为绿海龟的保护提供了坚实的基础,伴随着稚龟的种群密度不断增加,细菌性病害成为人工种群稚龟发病死亡的首要因素[21-22],但是长期以来,均未有南海海域绿海龟细菌性疾病流行病学调查的报道,极不利于我国绿海龟的保护。
本研究对惠东县海龟国家级自然保护区进行了为期3年的细菌性疾病流行病学调查,共分离到疑似病原菌45株,其中弧菌属细菌19株,属绝对优势,占42.22%。弧菌属细菌多为重要的水产养殖动物病原菌,可感染多种鱼类、虾类和贝类,均能导致海洋生物高死亡率[1,22-26]。本研究从绿海龟口腔拭子、鼻拭子、泄殖腔拭子以及表皮溃疡组织中均分离到溶藻弧菌优势菌落。墨西哥海域的绿海龟中分离了82株细菌,62株为弧菌属细菌,其中39株为溶藻弧菌,17株为副溶血弧菌[22]。台湾海域的绿海龟分离了47株革兰氏阴性细菌,其中15株为弧菌属细菌[1],证明弧菌是绿海龟最为主要的流行致病菌株。
绿海龟的病原菌很多为环境常在条件致病菌[22],目前研究报道的细菌均未进行回归试验,对其毒力评价确定其致病力在绿海龟病害防控中尤为迫切。为此,本研究对分离到的溶藻弧菌开展了中华草龟毒力试验,试验结果表明,7株溶藻弧菌均能造成中华草龟死亡,LD50分别为7.40×107、2.59×108、6.35×106、7.22×107、7.22×107、2.99×106、7.22×106cfu/mL,并且在死亡病龟中均能重新分离到菌株,7株溶藻弧菌对中华草龟具有明显的毒力。以中华草龟为攻毒模型,也可以为评价绿海龟细菌性病原的毒力以及防控研究提供数据支撑。
细菌的耐药性分析对抗菌药物选择至关重要,是科学用药的基础。本研究对45株分离菌株进行了抗生素敏感试验,分离菌株对6种水产养殖允许使用的抗生素具有不同程度的耐药性。抗生素是典型海洋污染物之一,耐药菌更是容易在海洋动植物中定植、生存和繁殖。绿海龟作为一种洄游性生物,携带细菌抗生素耐药分析也成为评价海洋抗生素污染水平的指标[4,26-31]。本研究显示,我国惠东绿海龟自然保护区绿海龟(稚龟)携带疑似病原菌耐药性普遍存在。值得注意的是,2021年分离菌株耐药率相比2019—2020年有明显地降低,这可能与本课题组从2019年开始根据药敏试验结果指导绿海龟病害防控过程中的抗生素使用有关,有效降低了绿海龟携带病原的耐药率,进一步保护了绿海龟保护区的生物安全与生态安全。
本研究对绿海龟(稚龟)病原菌分离鉴定以及抗生素耐药性分析,将有效提升绿海龟的全人工繁育水平,为海龟自然保护区提供生物安全保障,对体现中国在绿海龟保护领域的国际影响力、促进海洋生态保护具有重要的意义。

