氯化铵与硫酸制备氯化氢的评价方法研究
袁丽华,吴月玲,田彩梅
(陕西北元化工集团股份有限公司, 陕西 榆林 719319)
多数文献对氯化铵制备氯化氢的工艺试验进行了描述。本文结合氯化铵与硫酸反应制备氯化氢的工艺研究,主要对氯化铵转化率的评价方法进行研究评价,为氯化铵分解制备氯化氢工艺研究推荐更具代表性的检测评价方法。
1 氯化铵与硫酸反应
氯化铵与浓硫酸反应分为2步:第1步为硫酸与氯化铵反应生成硫酸氢铵和氯化氢,第2步硫酸氢铵与氯化铵继续反应生成硫酸铵和氯化氢气体。化学反应方程式如下:

(1);

(NH4)2SO4+HCl↑
(2)。
试验装置如图1所示。
2 H+含量法评价氯化铵转化率
2.1 H+检测原理
以氢氧化钠为标准滴定溶液,以溴甲酚绿-甲基橙为指示剂进行酸碱滴定。反应方程式为:
HCl+NaOH=NaCl+H2O。
2.2 试剂及仪器
氢氧化钠标准滴定溶液(0.5 mol/L), 溴甲酚绿-甲基橙指示剂(1 g/L),滴定管,锥形瓶,移液管。
2.3 H+检测步骤及氯化铵转化率计算
以反应产生的氯化氢水吸收液为评价对象。评价步骤为:添加400 mL去离子水作为吸收液吸收试验产生的氯化氢气体,分别在反应5、10、20、30、40、50、60 min时取出20 mL吸收液检测H+浓度。通过每次取样时吸收液的体积计算该体积吸收液中氯化氢的质量,再补加前几次移取出样品所含的氯化氢质量作为氯化氢的总质量,将氯化氢与氯化铵进行质量换算,通过消耗的氯化铵质量与原料中投入的氯化铵总质量计算氯化铵的转化率。氯化铵与硫酸反应制备氯化氢试验装置如图1所示。
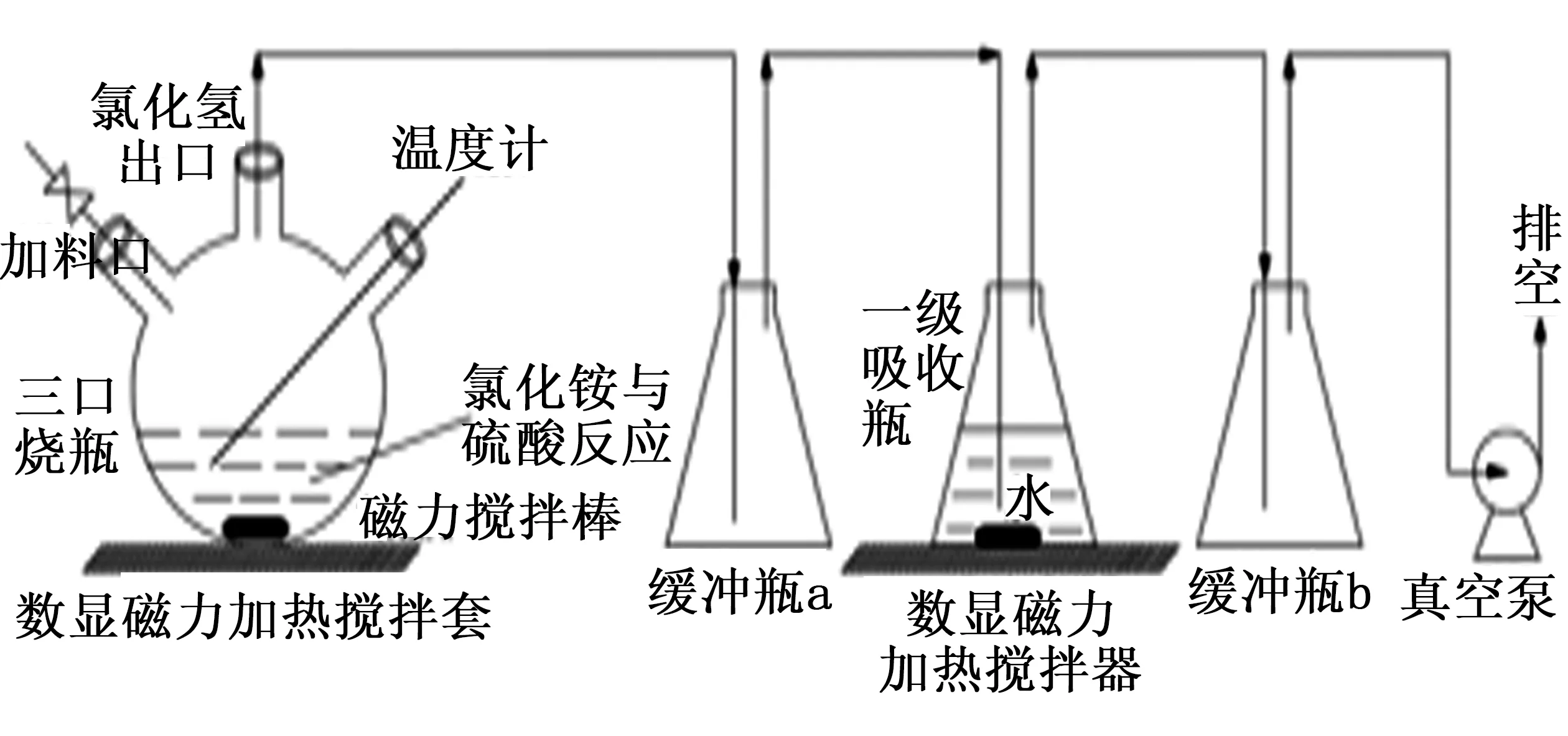
图1 氯化铵与硫酸反应制备氯化氢试验装置图Fig.1 Test device for preparing hydrogen chloride from ammonium chloride and sulfuric acid
3 Cl-含量法评价氯化铵转化率
3.1 Cl-检测原理
在微酸性溶液中,加入过量的硝酸银溶液,使氯离子转化为氯化银沉淀,用邻苯二甲酸二丁酯包裹沉淀,以硫酸铁铵为指示剂,用硫氰酸铵标准滴定溶液滴定剩余的硝酸银。
3.2 试剂及仪器
邻苯二甲酸二丁酯(AR),硝酸溶液(体积比1∶1), 硝酸银溶液(0.05 mol/L), 硫酸铁铵指示剂(80 g/L),硫氰酸铵标准滴定溶液(0.05 mol/L),电子天平,滴定管,锥形瓶。
3.3 Cl-检测步骤及氯化铵转化率计算
以氯化铵与硫酸反应产生的固液混合物为检测对象。称量空反应容器质量和反应后容器及产物的总量,计算产物质量m1。称取一定量产物m2,依据标准GB/T 15063—2020附录B复混肥料中氯离子含量测定法检测产物中氯离子含量。通过氯离子含量,计算产物m1中氯离子总含量,并折算为氯化铵含量,通过剩余氯化铵含量与原料中投入的氯化铵质量之比计算氯化铵的转化率。
3.4 Cl-检测方法验证
3.4.1 加标回收率验证
为了判断本试验产物Cl-检测与标准GB/T 15063—2020 附录B中方法的符合性,进一步排除试验产物中其他组分对氯离子含量检测的干扰,本研究采用氯离子质量浓度为200 mg/mL的氯化钠为加标物进行加标回收率验证试验,加标体积1 mL,计算加标回收率为99.64%。
数据如下:检测100 mL样品加标溶液中Cl-的总质量为167.135 1 mg;检测100 mL待测样品溶液中Cl-的质量为46.717 mg,计算100 mL加标溶液中所含待测样品99 mL中Cl-的质量为
46.717×99%=46.249 83 (mg);
加标Cl-量=
200×1×35.45÷58.44=121.321 0 (mg)。
加标回收率(%)=(Cl-总量-待测样品Cl-含量)×100÷Cl-加标量=(167.135146.249 83)×
100÷121.321 0=99.64。
3.4.2 准确度验证
在无Cl-样品中加入一定量氯化钠,依据GB/ T 15063—2020附录B方法检测氯离子含量,按照相对误差公式对2个样品的检测数据进行计算。
相对误差(%) =(测量值-理论值)×100÷理论值。
1#样品中Cl-理论值为8.42%,检测数据为8.34%,计算相对误差为0.95%。2#样品中Cl-理论值为8.52%,检测数据为8.46%,计算相对误差0.70%。
4 H+和Cl-含量评价数据对比分析
针对同一个试验的吸收液和剩余产物分别进行H+和Cl-含量检测,采集14组数据并计算其转化率,对比如图2所示。
5 结语
通过对Cl-检测方法的加标回收和准确度验证,加标回收率为99.64%,相对误差小于1%,数据准确,对于氯化铵与硫酸反应且无氯化铵挥发流失的情况下氯化铵的转化率可参照标准GB/T 15063—2020附录B方法执行。
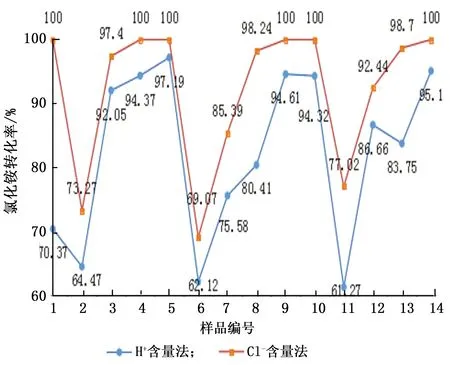
图2 两种方法评价氯化铵转化率对比图Fig.2 Comparison of ammonium chloride conversion rate evaluated by two methods respectively
本试验装置开展的试验数据表明, Cl-含量法比H+含量法表征的氯化铵转化率高。分析原因为装置密封性不足,导致氯化氢气体泄漏而未被吸收或吸收不完全。

