氢气对瓦斯爆炸化学动力学行为影响研究
王振兴,王 洋,韩东洋,任晓伟
(陕西陕煤曹家滩矿业有限公司,陕西 榆林 719000)
0 引 言
瓦斯爆炸是威胁煤矿工人生命安全的重要灾害之一。2019 年,二亩沟煤业有限公司发生瓦斯爆炸事故,造成15 人死亡,9 人受伤;2020 年,山西潞安集团左权阜生煤业有限公司发生瓦斯爆炸,造成4 人死亡,1 人受伤。因此,瓦斯爆炸事故的防控一直是煤矿企业工作的重中之重,也受到了学者们的广泛关注。
瓦斯爆炸事故中可燃气体的主要成分是CH4,初始工况、巷道形状、障碍物等条件下CH4爆炸特性的研究已基本完善,针对CH4爆炸也开发了如惰性气体抑爆(CO2、N2)、粉体抑爆等相应的抑爆技术。
由于井下煤氧化自燃产生多种气体和煤层气组分的复杂性,导致矿井下发生瓦斯爆炸的并非单一的CH4气体,还有H2、CO、C2H8等气体。
其中,CO 的存在对瓦斯爆炸极限有一定的拓宽作用,对爆炸压力也有一定的影响;H2的存在会增加瓦斯爆炸的剧烈程度,H2对瓦斯爆炸反应的影响机理,尤其是化学动力学机理的影响还不清晰。
本文在已有研究的基础上,借助标准20 L 球形爆炸容器和数值模拟软件CHEMKIN-PRO,开展了H2对瓦斯爆炸反应化学动力学行为影响的研究,揭示了H2对瓦斯爆炸化学反应的影响机理。该研究成果对矿井瓦斯爆炸事故的防控是有非常重要的现实意义。
1 研究方案
研究主要分为以下内容:
(1)通过实验研究H2的混入影响瓦斯爆炸烈度的规律。
(2)利用CHEMKIN-PRO 计算H2/CH4混合气体爆炸基元的反应速率、温度敏感性、自由基浓度和生成速率等参数。
(3)结合实验数据和数值模拟结果分析H2的混入对瓦斯爆炸化学动力学行为的影响。
1.1 实验部分
实验所用到的仪器为标准20 L 球形爆炸容器,该容器在前人的研究中广泛使用,故本文不在赘述实验设备部分。
为避免O2浓度对爆炸反应的影响,控制每一组的物质的量比均为1,H2占为0~0.5,共11 组实验。所有实验均在常温、常压下进行,3 次实验取平均值进行后续分析。
实验气体配比见表1。

表1 实验气体配比Table 1 Experimental gas ratio
表1 中O2与N2体积分数均为理论值,由于空气中杂质气体的存在,实际实验过程中,O2与N2的体积分数可能与表1 有一定的误差。
1.2 数值模拟部分
采用CHEMKIN-PRO 开展数值模拟研究,反应器模型为封闭均质燃烧反应器,反应机理选择GRI-mech 3.0 机理。
GRI-mech 3.0 机理包括53 种反应物质和325个基元反应,其中包含了H2和CH4的所有燃烧反应步骤,已被广泛的应用于H2、CO、CH4、丙烷(C3H9)的燃爆反应中。
主要的控制方程在已报道的文献中多次出现,本文不再赘述。初始温度设置为1 300 K,初始压力为1 atm,气体配比按表1 进行设置。
2 结果与讨论
2.1 实验结果
最大爆炸压力是表征爆炸反应剧烈程度的重要指标。H2/CH4最大爆炸压力如图1 所示。

图1 H2/CH4 最大爆炸压力Fig.1 Maximum explosion pressure of hydrogen/methane
H2占比对H2/CH4混合气体爆炸压力的影响整体体现为:
(1)随着H2和CH4混合气体中H2占比的不断增高,最大爆炸压力不断增大。
(2)当H2占比<0.4 时,继续增大H2占比,最大爆炸压力无明显的变化。
(3)在H2占比=0.4 时,爆炸压力最大,为748.76 KPa。
(4)当H2占比>0.4 时,促进效应消失。
从整体上看,H2的存在促进了瓦斯爆炸反应,后文将从化学动力学的角度解释这一规律。
2.2 数值模拟结果
2.2.1 点火延迟时间
点火延迟时间是反映爆炸反应速率的重要参数,点火延迟时间越短,反应速度越快,反之则越慢。
·OH 自由基是碳氢化合物燃爆反应中最重要的中间反应体之一,因此,CHEMKIN-PRO 操作指南中以·OH 自由基达到最高浓度所需时间定义为点火延迟时间,本研究亦采用该定义。
不同H2占比的H2/CH4混合气体爆炸点火延迟时间如图2 所示。

图2 点火延迟时间Fig.2 Ignition delay time
由图2 可以看出:
(1)添加H2后,点火延迟时间明显缩短,且随着H2占比的增加,点火延迟时间不断缩短。
(2)当H2占比=0.3 时,继续增大H2占比,点火延迟时间缩短的幅度不断缩小。这在一定程度上解释了图1 中的实验现象。
(3)当H2占比<0.3 时,H2的增加大幅增大了爆炸反应速率,短时间内释放大量的能量,导致爆炸压力的增加。
(4)当H2占比>0.3 时,H2占比的继续增大对爆炸反应速率无明显的影响,进而对最大爆炸压力的影响也不明显。
2.2.2 温度敏感性分析
由于爆炸反应在瞬间即可完成,与环境反应的热交换的时间极短,因此,在数值模拟中被设定为绝热环境。
本研究关注于H2/CH4爆炸反应本身的化学动力学行为,不考虑环境条件和流场的影响,故选取了零维绝热均质反应器模型。爆炸反应对周围环境的破坏本质上是能量的瞬态释放导致的,因此,本节关注于爆炸反应过程中对温度敏感性最大的基元反应。
Top10 温度敏感性基元反应见表2。

表2 Top10 温度敏感性基元反应Table 2 Top10 temperature sensitive elementary reactions
为更直观的分析H2占比对CH4爆炸反应的影响,将各工况下温度敏感性前10 的基元反应的敏感性系数峰值做归一化处理。其中,敏感性系数为正的基元反应促进温度升高,敏感性系数为负的基元反应抑制温度升高。
由处理后的结果可以看出:
(1)随着H2占比的增大,与H2或·H 自由基相关的基元反应(38#,52#,84#)均有所加强。
(2)38#基元反应H+O2O+OH 为整个反应体系供给重要的中间反应体·O 自由基和·OH 自由基,是决定反应速率和能量释放的基元反应之一。H2的混入增强了38#基元反应,因此,缩短了爆炸反应时间和增大了能量的释放,导致点火延迟时间缩短和爆炸压力的增大。
(3)在53#H+CH4CH3+H2基元反应中,H2是生成物,H2的混入增加了生成物浓度,因此,在一定范围内(H2占比<0.15),随着H2占比的增大,53#反应逐渐减弱。
(4)随着H2占比的继续增大,反应体系内·H 自由基含量不断增高,52#基元反应不断加强,进入温度敏感性前10 的的基元反应,52#反应消耗了53#反应的生成物·CH3自由基,因此,53#反应得到促进。
(5)对于155#、156#、161#、170#基元反应,其H2占比的增加,对于碳氢化合物的氧化反应都有一定的弱化作用,这主要是由于随着H2占比的增大,CH4占比随之减小,进而降低了CH4氧化反应的强度。
(6)另一方面,随着H2占比的增大,对38#、84#的促进作用逐渐降低直至消失,这可能是导致实验结果中,当H2占比>0.4 时,最大爆炸压力不再继续上升的原因之一。
不同H2占比的温度敏感性归一化处理结果如图3 所示。

图3 不同H2 占比的温度敏感性归一化处理Fig.3 Temperature sensitivity normalization for different hydrogen proportions
2.2.3 关键物质含量分析
爆炸链式反应的本质是自由基碰撞可燃气体分子,可燃气体分子分解为新的自由基的过程。在实际的矿井瓦斯爆炸过程中,H2与CH4分子的分解的协同作用是导致实际瓦斯爆炸与单一CH4爆炸不同的重要原因之一。
在不同H2占比的H2/CH4爆炸反应中,CH4含量随时间变化的情况如图4 所示。
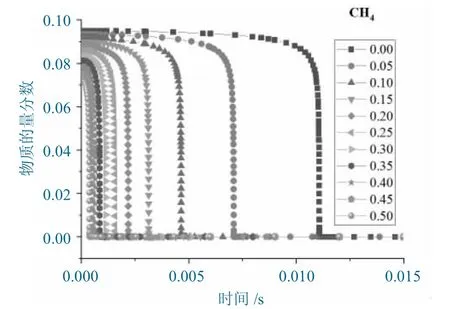
图4 不同H2 占比下CH4 随时间变化的情况Fig.4 Changing situation of CH4 with time under different hydrogen proportions
从图4 中可以看出:
(1)在反应初期,CH4分解的速度较慢,但随着反应的进行,在某一个时间点,CH4分解的速度突然剧增,然后,瞬间消耗完全部的CH4分子。这主要是由于在反应初期的链引发阶段,反应体系中的自由基含量较低,自由基对CH4分子的碰撞较少造成的。
(2)随着反应的进行,自由基数量不断积累,并达到一定数量时,进入链传递阶段,支链反应不断强化,自由基数量激增,进而大大提高了CH4的分解速度。
(3)H2分子分解生成2 个·H 自由基,H2的存在大大提高了反应体系中·H 自由基数量,降低了反应初期的链引发阶段时间。随着H2占比的不断增大,链引发阶段耗时不断减小。
·H 自由基、·OH 自由基是决定爆炸反应速度和剧烈程度的关键反应中间体,是重要的反应活化中心。
H2在不同占比的情况下,·H 自由基和·OH 自由基含量如图5 所示。

图5 关键自由基含量Fig.5 Key free radical content
由图5 可以看出:
(1)添加H2后,明显提高了反应体系中·H自由基的含量,·OH 自由基的含量也有所提高,且随着H2占比的增大,·H 自由基和·OH 自由基的含量不断增大,这直接导致了图3 中·H 自由基和·OH 自由基参与的基元反应被加强(如38#、84#、98#基元反应)。这些基元反应的强化消耗了大量的CH4分子及其相关的自由基,进而减弱了CH4分子的氧化反应。
(2)添加H2后,反应体系中·H 自由基和·OH自由基含量最大值出现的时间也明显提前,且随着H2占比的增大,提前的幅度也越大,这导致了图2中随着H2占比增大,点火延迟时间缩短的现象。
2.2.4 关键生成速率
为更加深入研究H2/CH4爆炸链式反应机制,反应体系中关键自由基的来源分析是至关重要的,其中,·H 自由基的主要来源为H2的分解和CH4分子的脱氢反应,来源较为单一,因此,本研究不再对其进行分析,本节重点分析·OH 自由基的来源情况。
Top10·OH 生成/消耗基元反应见表3。

表3 Top10·OH 生成/消耗基元反应Table 3 Top10·OH generation/consumption elementary reactions
主要基元反应的·OH 自由基生成/消耗速率如 图6 所示。

图6 主要基元反应的·OH自由基生成/消耗速率Fig.6 ·OH radical generation/consumption rates of main elementary reactions
由图6 可以看出:在H2占比为0.3 的工况和单一CH4组分的爆炸链式反应中,生成和消耗·OH自由基最主要的基元反应一致,其中,38#基元反应是生成·OH 自由基的主要反应,84#基元反应是消耗·OH 自由基的主要基元反应。
对比图6 a 和图6 b 可以看出:反应体系中添加H2,缩小CH4比例后,·OH 自由基的消耗反应和生成反应均有一定程度的提升,整体上·OH 自由基的生成反应提升更大,导致·OH 自由基的总生成速率增大。随着H2占比的不断增大,·OH 自由基的总生成速率不断提高。
在一定范围内,H2的分解提高了反应体系中·H 自由基的浓度,一定程度上也促进了·OH 自由基的生成,进而导致与·H 自由基和·OH 自由基相关的基元反应得到进一步激发,增大了反应体系中活化中心的数量,缩短了爆炸反应中链引发阶段的耗时,有利于爆炸反应能量的瞬间释放,在宏观上体现为爆炸压力的增大。
不同的H2占比·OH 自由基总生成速率如图7所示。

图7 不同H2 占比·OH自由基总生成速率Fig.7 Total generation rate of·OH radical whith different hydrogen proportions
当H2占比超过一定范围后,类似于53#的链传递反应的逆反应被加强,与此同时,由于CH4含量的降低和CH4分子与·H 自由基和·OH 自由基碰撞概率的增大,反应体系中CH4分子数量大幅降低,进而导致CH4的氧化反应被弱化,链式反应的传递能力被减弱,反应体系能量释放也被弱化,宏观上体现为H2占比的继续增大,爆炸压力增大幅度逐渐减小。
3 结 论
为揭示矿井瓦斯爆炸反应中H2对爆炸反应化学动力学行为的影响,本研究采用标准20 L 球形爆炸容器测试了不同H2占比的H2/CH4混合气体的爆炸压力;同时,分别利用CHEMKIN-PRO 数值模拟软件分析了爆炸反应的化学动力学特性,得到如下结论:
(1)H2的混入一定程度上增大了瓦斯爆炸压力,当H2占比<0.4 时,H2占比越大,瓦斯爆炸压力越大,当H2占比继续增大,瓦斯爆炸压力无明显变化。
(2)H2的混入明显的缩短了瓦斯爆炸的点火延迟时间,有利于爆炸反应过程中能量的集中释放,进而体现为爆炸压力的提升。
(3)H2/CH4混合气体爆炸反应中,H2的存在促进了·H 自由基和·OH 自由基的生成,进而促进了与之相关的基元反应,其中,对38#基元反应促进作用最为明显,且该反应为促进温度升高的基元反应。当反应体系中H2占比达到一定程度后,类似于53#基元反应的逆反应被促进,CH4氧化反应被减弱,宏观上体现为H2占比的继续增大,爆炸压力无明显变化。

