小分子荧光探针的合成及其对线粒体黏度的实时监测
黄 威,刘正杰
(安徽大学a.化学化工学院;b.物质科学与信息技术研究院,安徽合肥 230601)
黏度是细胞内的一个重要微环境参数,在维持细胞信号转导、分子间相互作用、营养物质运输和代谢产物扩散等生理过程起至关重要的作用[1-2]。人体细胞器黏度维持在一定范围,黏度异常会影响细胞正常生理过程,从而诱发一系列的疾病[3-5]。例如,肿瘤细胞内的溶酶体黏度通常高于正常细胞,以此可作为肿瘤诊断的标志[6]。作为细胞中最重要的亚细胞结构之一,线粒体在细胞代谢和凋亡中起关键作用。研究证明,线粒体黏度的变化会影响线粒体的正常功能[7],这与细胞色素C的释放和膜的流动性变化有关。线粒体黏度异常能够直接影响细胞代谢过程,进而引起神经退行性疾病、高血脂症、恶性肿瘤等[8-9]。因此,监测线粒体黏度具有重要意义。
传统的黏度监测工具如落球式、杯式和毛细管黏度计只适用于体外黏度测量,无法实现细胞层面的黏度监测[10-11]。荧光探针具备非破坏性标记、高灵敏度和高时空分辨率等优点,已成为监测细胞内黏度的一种重要工具[12-13]。近年,监测线粒体黏度的探针被相继报道,Zou等[14]合成一种小分子荧光探针,实现了对线粒体黏度变化的实时成像追踪,并发现线粒体在自噬过程中黏度升高;Cui等[15]合成一种对黏度较敏感的探针,实现了对正常和去极化线粒体黏度变化的可区分成像。然而,目前多数用于黏度测定的探针是基于荧光的强度信息,测定结果受到与黏度无关因素如光漂白、探针浓度、激发光强度等的影响[16]。与荧光强度不同,荧光寿命与荧光团浓度无关,这为监测复杂细胞环境中的黏度提供了更可靠的信息[17]。针对上述问题,设计一种对线粒体黏度敏感且同时具有荧光强度和荧光寿命响应的小分子探针2-[2-(5-二苯胺噻吩基)乙烯基]-1,3,3-三甲基-H-吲哚碘盐,以期通过荧光强度和寿命的变化实现对细胞凋亡过程中线粒体黏度的监测。
1 实验部分
1.1 仪器与试剂
实验仪器为旋转蒸发仪(RE-52AA,德国艾卡)、荧光光谱仪(F-7000,日本日立)、真空干燥箱(FD-1C-80,上海比朗仪器)、紫外-可见吸收光谱仪(UH5300,日本日立)、超快时间分辨荧光光谱仪(FLUOROMAXPLUS-P,日本掘场)、高分辨质谱仪(LTQ Orbitrap XL,美国赛默飞公司)、激光扫描共聚焦显微镜(TCS SP8,德国徕卡)。
碘甲烷、二苯胺、5-溴-2-噻吩醛、2,3,3-三甲基吲哚、甲基三辛基氯化铵、邻二氯苯、碳酸钾、小牛胸腺DNA、酵母RNA 均购于上海阿拉丁公司;乙醇、乙酸乙酯、甲醇、二氯甲烷、石油醚购于上海国药试剂公司;MTT(噻唑蓝溴化四唑)、硫氢化钠、氯化钠、氯化钾、氯化镁、过氧化氢、硫酸钠、亚硫酸钠、次氯酸、氯化钙、赖氨酸、谷胱甘肽购于美国Sigma公司。
1.2 探针分子的合成
探针分子的合成路线如图1。

图1 探针分子的合成路线Fig.1 Synthetic routes of probe molecule
1.2.1 化合物1的合成
称取2.03 g 二苯胺(12.0 mmol)、2.85 g 5-溴-2-噻吩醛(15.0 mmol)置于250 mL 的圆底烧瓶中,依次加入碳酸钾(2.07 g,15.0 mmol)、铜(0.23 g,3.6 mmol)、甲基三辛基氯化铵(1.00 g,2.5 mmol),再加入100 mL邻二氯苯使其溶解,设置温度为120 ℃,冷凝回流,反应48 h。反应液冷却后进行减压抽滤,取滤液,蒸除多余的溶剂,得到油状物。使用柱层析对所得的粗产物进一步分离纯化,洗脱剂为石油醚与乙酸乙酯(体积比=20∶1),最终得到黄色固体化合物1(1.00 g,产率30%)。化合物1的核磁数据如图2。1H NMR(400 MHz,DMSO-d6)δ9.56(s,1H),7.70(d,J=4.3 Hz,1H),7.46~7.40(m,4H),7.34~7.25(m,6H),6.30(d,J=4.3 Hz,1H);13C NMR(101 MHz, DMSO-d6)δ182.29, 163.94, 146.07, 140.42, 130.65, 130.07, 127.10, 126.17, 111.89, 40.69, 40.48,40.27,40.06,39.85,39.64,39.43。
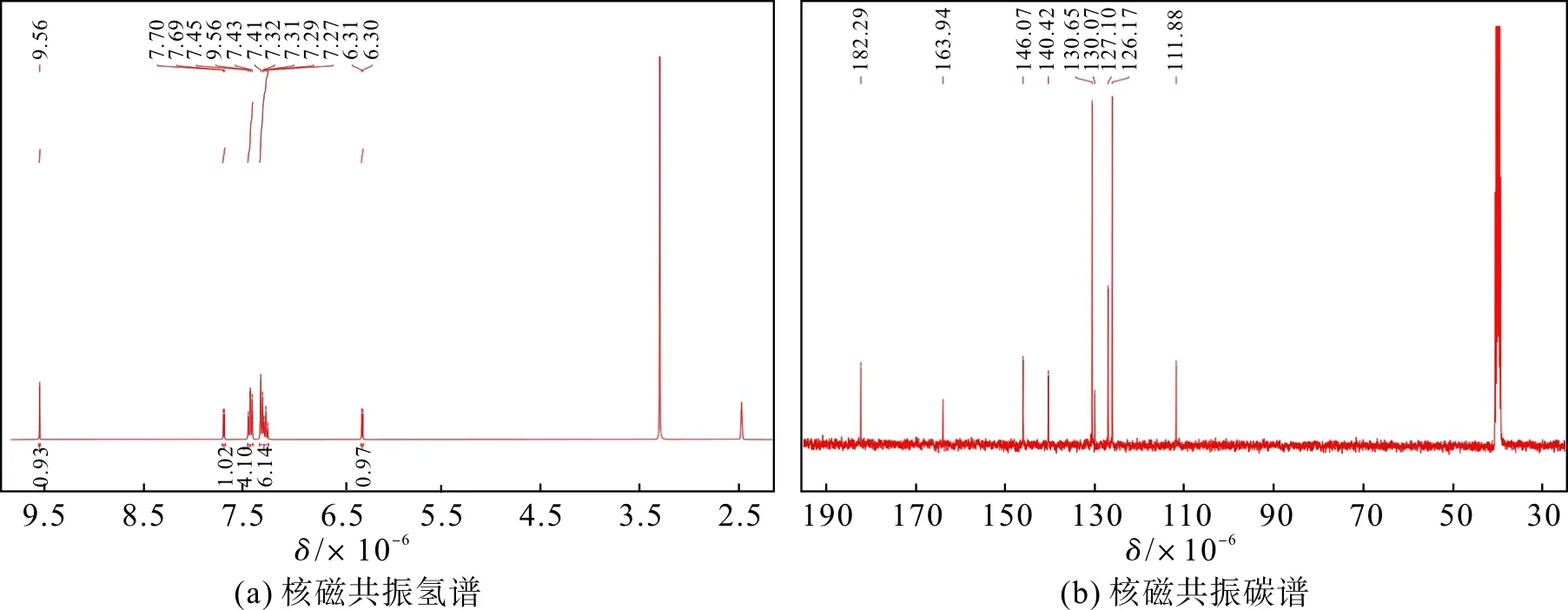
图2 化合物1的1H NMR和13C NMRFig.2 1H NMR and 13C NMR spectrum of compound 1
1.2.2 化合物2的合成
称取1.59 g 2,3,3-三甲基吲哚(10.0 mmol)、1.70 g 碘甲烷(12.0 mmol)置于250 mL 的圆底烧瓶中,取50 mL乙腈溶解,设置温度为80 ℃,冷凝回流,反应12 h。反应冷却后除去多余的溶剂,通过减压抽滤得到紫红色固体化合物2(2.20 g,产率73%)。所得产物用乙腈洗涤3 次即可,无需进一步纯化。化合物2 的核磁数据如图3。1H NMR (400 MHz,DMSO-d6)δ7.90~7.85 (m,1H),7.82~7.76 (m,1H),7.62~7.54 (m,2H),3.94 (s,3H),2.74(s,3H),1.49(s,6H);13C NMR(101 MHz,DMSO-d6)δ196.56,142.66,142.16,129.86,129.36,123.85,115.68,54.47,35.29,22.25,14.74。
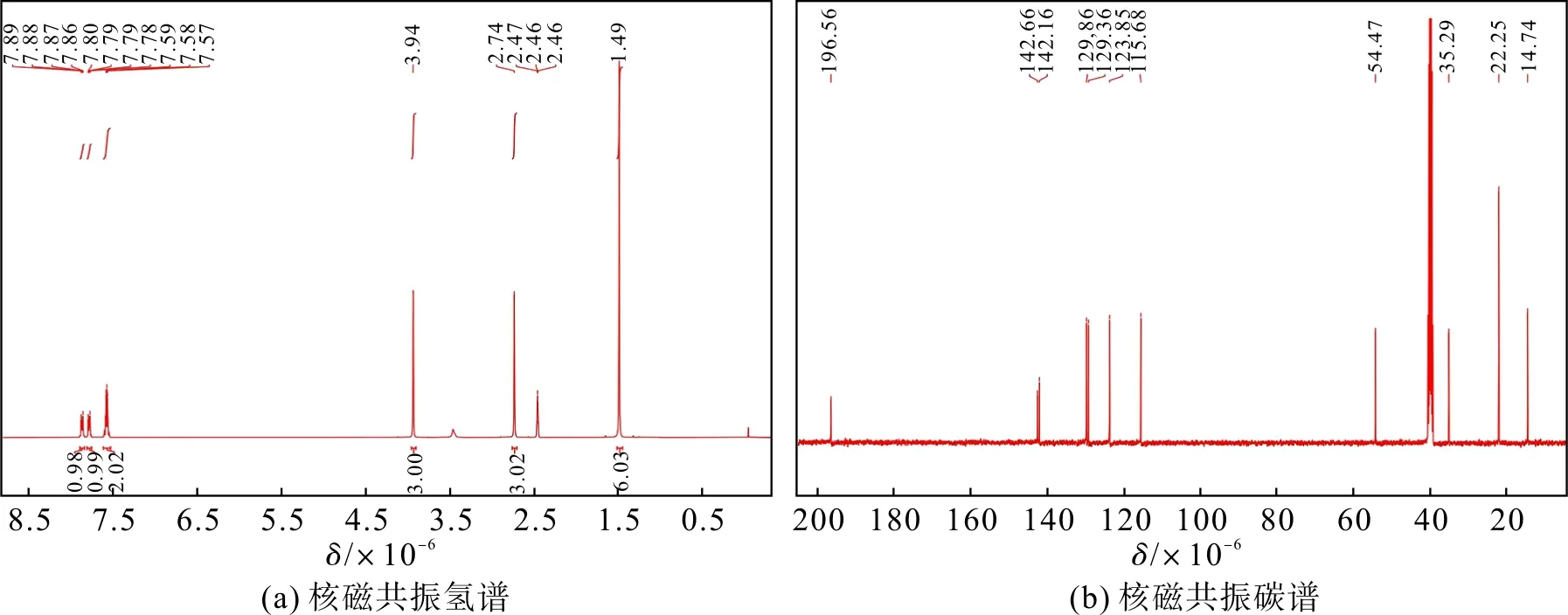
图3 化合物2的1H NMR和13C NMRFig.3 1H NMR and 13C NMR spectrum of compound 2
1.2.3 探针分子的合成
称取0.28 g化合物1(1.0 mmol)、0.30 g化合物2(1.0 mmol)置于150 mL的圆底烧瓶中,取40 mL乙醇作为溶剂,溶解固体,设置温度为80℃,冷凝回流,反应24 h。反应液冷却后除去多余溶剂,使用洗脱剂二氯甲烷与甲醇(体积比=30∶1)的柱层析对粗产物进行纯化,得到紫黑色固体2-[2-(5-二苯胺噻吩基)乙烯基]-1,3,3-三甲基-H-吲哚碘盐(0.29 g,产率50%)。探针分子的核磁数据如图4。1H NMR (400 MHz, DMSO-d6)δ8.44(d,J=15.0 Hz,1H),8.00(d,J=4.7 Hz,1H),7.66(d,J=7.4 Hz,1H),7.58~7.33(m,13H),6.51~6.41(m,2H),3.73(s,3H),1.64(s,6H);13C NMR(101 MHz,DMSO-d6)δ178.26,168.85,146.28,145.25,142.71,142.59,130.98,129.16,128.51,128.16,127.37,126.82,123.06,114.23,113.40,103.11,50.82,32.98,26.78。
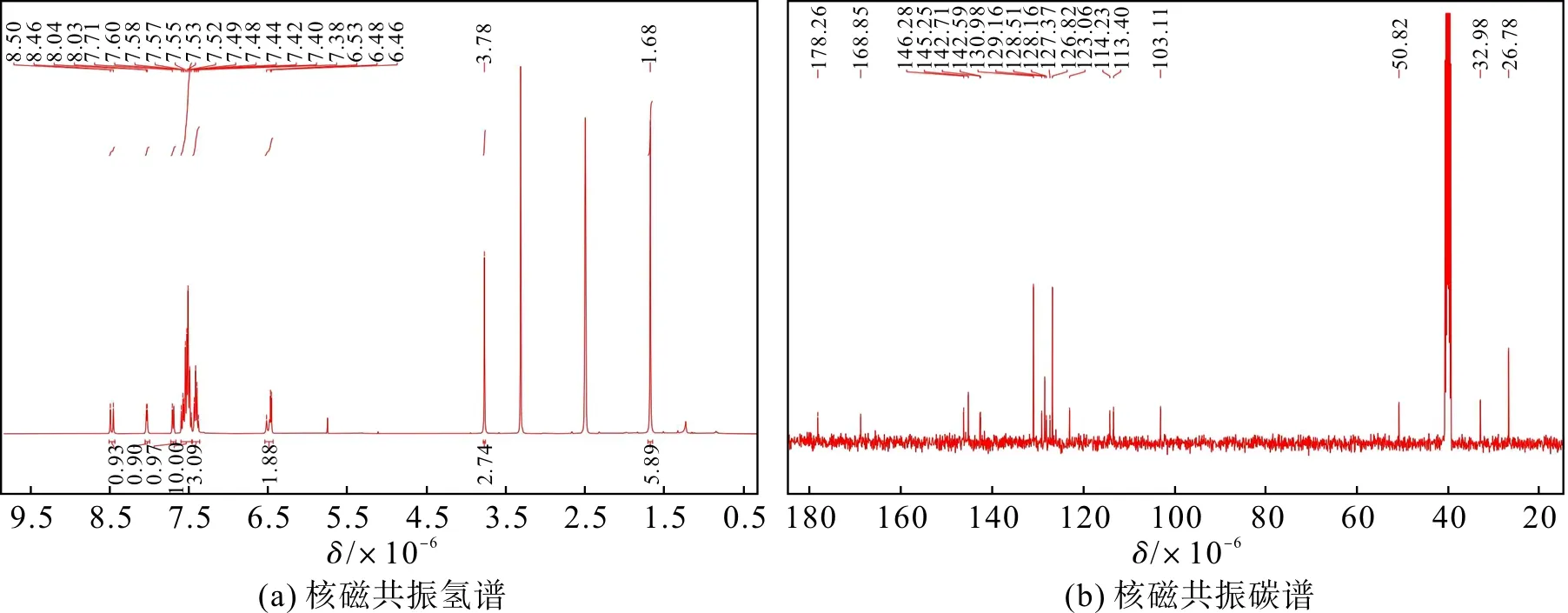
图4 探针分子的1H NMR和13C NMRFig.4 1H NMR and 13C NMR spectrum of probe molecule
1.3 探针分子光谱性质的表征
1.3.1 荧光及吸收光谱
将探针分子分别溶解在水和甘油(用水模拟低黏度环境,甘油模拟高黏度环境)体系中,配制成浓度为1×10-5mol/L的2种工作溶液。采用紫外-可见吸收光谱仪测量探针分子的吸收光谱,激发光波长为570 nm。
1.3.2 荧光强度选择性实验
配制一系列不同分析物(包括无机盐、还原性硫、活性氧、氨基酸、核酸等)的溶液,加入探针使其浓度为1×10-5mol/L,使用荧光光谱仪测定探针在各溶液中的荧光强度。
1.3.3 黏度响应实验
在水和甘油体系中,通过改变甘油比例来模拟不同的黏度(η)环境。将探针加入不同黏度的水-甘油混合体系中,配制成浓度为1×10-5mol/L 的探针溶液,使用荧光光谱仪和超快时间分辨荧光光谱仪测定不同黏度环境下探针分子的荧光强度和荧光寿命。
1.4 细胞培养及染色
细胞培养:Hep G2(人肝癌细胞)购于中国科学院上海生物化学与细胞生物学研究所,将其置于含10%(体积分数)胎牛血清和1%(体积分数)青霉素-链霉素抗生素的DMEM 培养液中培养;将细胞培养瓶置于5%CO2(体积分数)培养箱中37 ℃培养。
活细胞成像:将探针分子以二甲基亚砜为溶剂配制成浓度为1 mmol/L 的母液,成像时用培养基稀释;将接种的Hep G2 细胞在适量浓度的探针分子稀释液中孵育30 min 后,采用PBS(磷酸盐缓冲液)缓冲液清洗3~5次,通过共聚焦荧光显微镜成像,采用如下公式计算细胞的存活率D。

式中:A为加样孔中在492 nm 处的吸光度;B为对照组孔在492 nm 处的吸光度;C为空白对照组孔在492 nm处的吸光度。
2 结果与分析
2.1 探针分子的光谱性质
2.1.1 吸收和荧光光谱性质
图5显示:探针处于水环境时,在波长为575 nm处有一个明显的吸收峰,而(探针)处于高黏度的甘油环境中时,吸收峰红移至585 nm 处;探针在水中几乎没有荧光信号,在甘油中有明显的荧光增强,发射波长在650 nm 左右。这是由于高黏度的环境限制探针的分子内旋转,抑制非辐射跃迁,从而导致荧光增强。
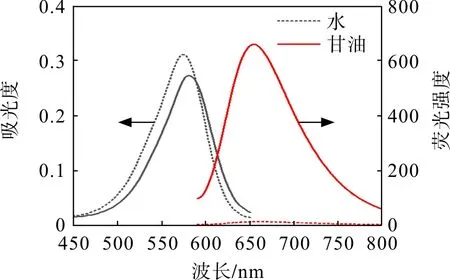
图5 探针的光谱性质Fig.5 Spectral properties of probe
2.1.2 荧光强度选择性
探针的荧光强度选择性实验结果如图6。图中:1 为blank;2 为Na+;3 为K+;4 为Mg2+;5 为Ca2+;6 为SO42-;7 为SO32-;8 为HPO4-;9 为H2S;10 为HClO;11 为H2O2;12 为赖氨酸;13 为谷胱甘肽;14 为RNA;15 为DNA;16 为甘油。样品1~13 的浓度为100 mmol/L;样品14,15 的质量浓度为0.025 mg/mL;样品16 为纯甘油。由图6 可看出,探针仅对黏度有很强的荧光强度响应,对其他分析物如无机盐、氨基酸、核酸等无响应。

图6 探针的荧光强度选择性Fig.6 Selectivity based on fluorescence intensity of probe
2.2 探针分子对黏度的响应
2.2.1 荧光强度对黏度的响应
图7(a)为探针在不同黏度环境下的荧光光谱及其与黏度的响应关系。由图7可知:在低黏度环境下探针分子有荧光响应,随甘油含量的增加探针分子的荧光强度增强,纯甘油中的荧光强度为纯水中的50倍,表明探针对黏度高度敏感;探针的荧光强度与其所处环境黏度符合良好的线性关系,R2=0.99。
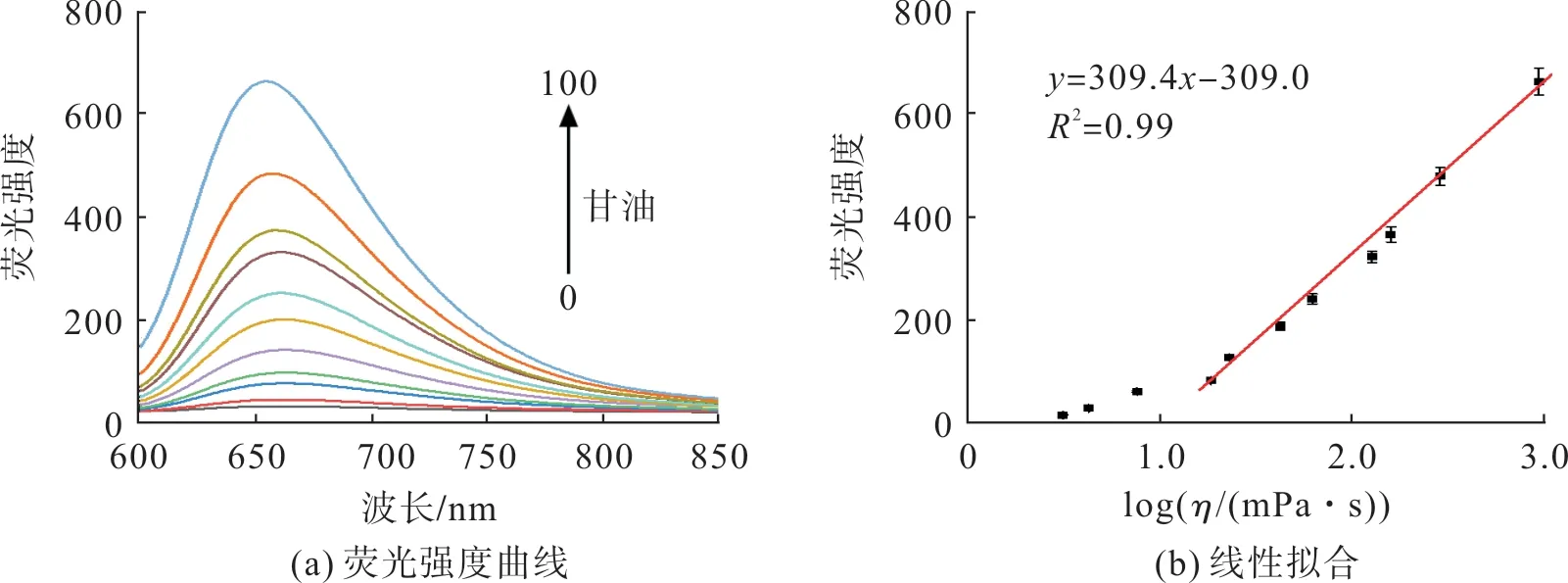
图7 探针荧光强度对黏度变化的响应Fig.7 Response of probe fluorescence intensity to viscosity change
2.2.2 荧光寿命对黏度的响应
探针荧光寿命及其与黏度的响应关系如图8。由图8 可看出:在不同黏度环境下,探针的荧光寿命也表现出高度敏感,纯水环境中探针的荧光寿命仅0.027 ns,纯甘油中可达1.903 ns;与荧光强度相似,探针的荧光寿命与其所处环境黏度在一定范围内也符合良好的线性关系,R2= 0.99。
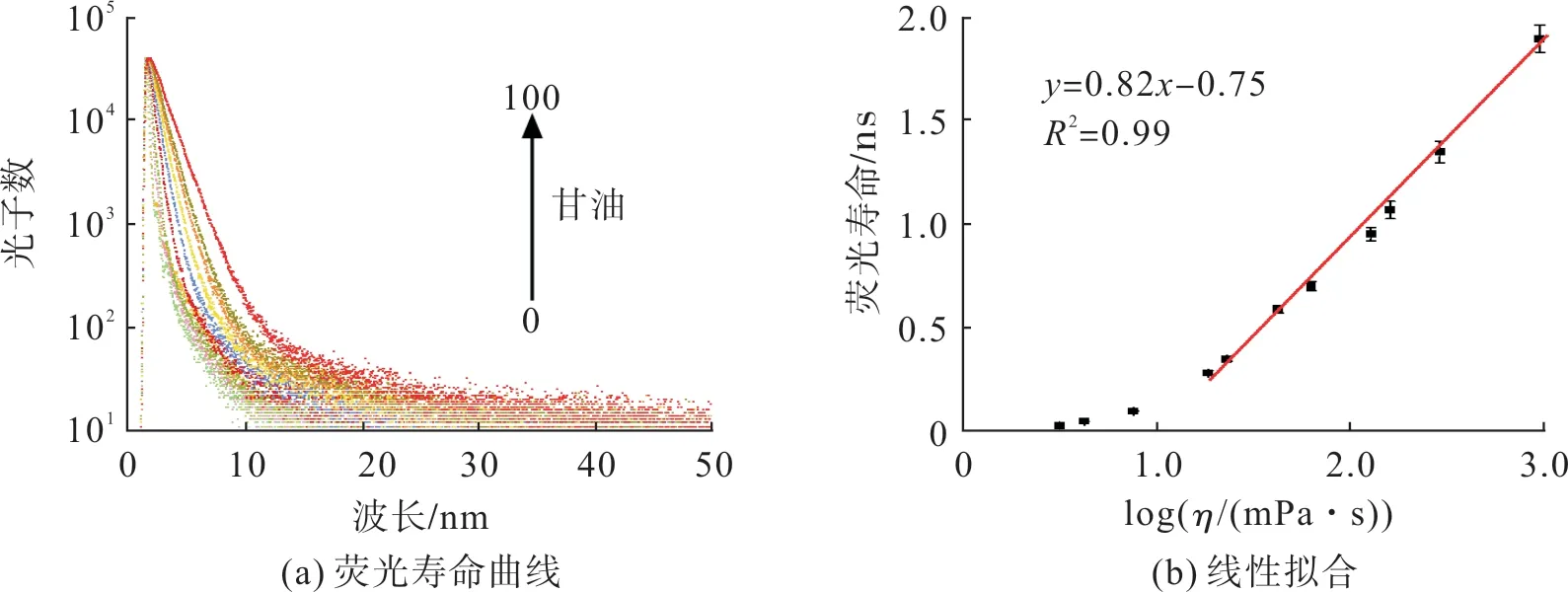
图8 探针荧光寿命对黏度变化的响应Fig.8 Response of probe fluorescence lifetime to viscosity change
2.3 探针分子的细胞毒性
细胞中加入外源性的物质或毒性大的探针分子时会对细胞正常的生理代谢活动产生影响,使细胞进入应激状态,导致细胞产生过量的活性氧,继而破坏细胞稳态,毒性较大时甚至会引发细胞的自噬和凋亡。不同探针分子浓度下的细胞存活率如图9。由图9 可看出:探针浓度达10 μmol/L 时,Hep G2 细胞仍拥有80%以上的存活率;探针浓度为2 μmol/L时,Hep G2 细胞存活率可达90%,表明该浓度下的探针几乎不会对细胞的存活和生长产生影响。

图9 探针的细胞毒性实验结果Fig.9 Cytotoxicity test results of probe
2.4 探针分子在细胞中的定位
探针在细胞中的定位情况如图10。由图10可看出,探针的荧光信号与线粒体商染重叠度较高。采用共聚焦软件计算得到探针通道与线粒体商染的共定位系数为0.83,表明探针在细胞中能够靶向线粒体,这是由于线粒体具有-180~-200 mV的膜电势,探针带正电,能够较好地在线粒体内膜上富集。

图10 探针的共定位实验结果Fig.10 Co-location experimental results of probe
2.5 探针分子对线粒体黏度变化的实时监测
为研究细胞凋亡过程中线粒体黏度的变化,使用外源性的制霉菌素刺激细胞凋亡,采用共聚焦显微镜观察此过程中探针荧光强度和荧光寿命的变化,结果如图11。
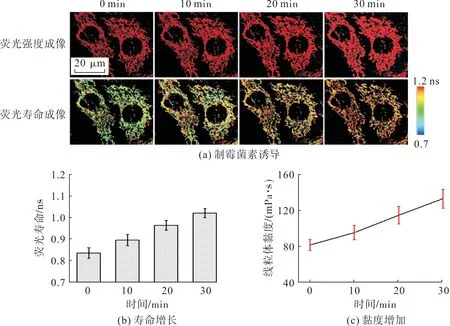

图11 线粒体黏度的实时监测Fig.11 Real-time monitoring of mitochondrial viscosity
由图11(a)可见:探针在线粒体中的荧光强度随时间的增加而增强,说明线粒体黏度上升;线粒体黏度随凋亡水平的增加而逐渐增加,这一结果与之前的报道[12]是一致的。但是,由于荧光强度受到探针浓度或光漂白的干扰,仅通过荧光强度成像分析难以准确计算出黏度,因此使用荧光寿命成像对实验结果进行分析。由图11(a)中荧光寿命成像可见:在初始状态下,探针在线粒体中的荧光寿命为0.824 ns,对应黏度为78.79 mPa·s;进一步培养30 min 后,荧光寿命延长至0.986 ns,相应黏度为121.09 mPa·s,如图11(b),(c),证实线粒体黏度增加;用另一种凋亡诱导剂依托泊苷处理细胞时也得到了类似的结果,如图11(d)~(f)。
3 结论
设计合成一种用于监测线粒体黏度的小分子荧光探针2-[2-(5-二苯胺噻吩基)乙烯基]-1,3,3-三甲基-H-吲哚碘盐。结果表明:探针对线粒体具有特异性靶向,对黏度敏感且荧光响应迅速;利用探针,结合共聚焦显微镜的荧光强度和寿命成像,可实现不同生理过程中黏度的双模式成像。这种活细胞成像的策略可进一步用于动态监测线粒体黏度的变化,为线粒体生理学的研究提供潜在工具。

