两种国兰MADS-box家族B类基因PI/GLO的克隆与时空表达特性分析
田云芳卢 超徐艳花刘宇邈陈景鲜张耀广郑钧屏杨玉珍
(1.郑州师范学院生命科学学院,郑州 450044;2.郑州市观赏药用特色资源植物重点实验室,郑州 450044)
典型被子植物的花由不同的组织(萼片、花瓣、雄蕊和心皮)径向对称的同心轮组成。参照ABCDE花发育模型(图1),B 类拟南芥(Arabidopsis thaliana)MADS-box 基因APETALA3(AP3)、PI决定和控制花瓣和雄蕊的生长发育[1-2]。B功能基因突变致花瓣向萼片转变、雄蕊向心皮转变。目前,B 类花发育基因PI/GLO已从多种植物中克隆,如拟南芥[3-4]、葡萄[5]、万寿菊[6]、烟草[7]、向日葵[8]、红花玉兰[9-10]等。国兰花器官尤其花瓣是重要的观赏部位,但其B 类花发育基因研究相对较少。

图1 拟南芥ABCDE花发育模型[20]Fig.1 ABCDE flower development model of Arabidopsis thaliana[20]
传统意义上,B 类基因AP3和PI在拟南芥花器官第二、三轮发育中表达,在非花组织中不表达[11]。然而,拟南芥中B类功能基因表达界限不够明晰,PI不完全限于花的第二、三轮中表达,PI也表达于第四轮早期[4]。葡萄PI基因表达丰度较高的部位是花序,叶、根较低,雄蕊、花瓣中也有特异表达[5]。Dezar等[8]采用Northern 和原位杂交获得向日葵不育花中Ha PI优先表达,而花瓣和可育花雄蕊中弱微表达。Yao等[12]将转座子插入苹果Md PI基因的突变体Rae Ime中,花瓣替换为萼片,雄蕊替换为心皮,最终单性结实。Sreekantan等[13]将葡萄Vv PI基因转化拟南芥致花瓣重瓣、雄蕊缺失。万寿菊PI主要于花瓣、雄蕊中表达,萼片中低表达,转基因植株花瓣、雄蕊和雌蕊明显变短,TePI过表达影响花器官发育[6]。刘彩霞等[14]将拟南芥At PI转化烟草,雄蕊变短,果实畸形,花冠变小,子房基部变长,At-PI基因调控雄蕊和花瓣的发育。Singh等[15]发现罂粟突变体Paps PI-1 进行烟草异位表达,花瓣萼片状。异位表达Md PI的转基因苹果果实变得扁平[16]。因此,不同物种PI基因的作用有所区别。
PI还可抑制AP1转录而调控花发育。Sundström 等[17]通过染色质免疫沉淀,发现PI蛋白可以直接与AP1基因的启动子相结合。AG基因的激活也需AP3和PI的调控。Wuest等[18]发现在拟南芥雄蕊中,AP3表达水平的维持除需要PI蛋白外,还需要AG转录表达。AP3和PI的起始转录是由AP1、LFY、UNUSUALFLORAL ORGANS(UFO)等花分生组织基因诱导的[19]。
本研究以两种国兰(蕙兰和墨兰)为试验材料,对PI/GLO基因的同源克隆与分析鉴定,利用实时荧光定量对不同时期的组织器官该基因的相对表达水平进行分析,揭示两种国兰PI基因在花发育的保守性和差异性,为国兰的分子育种奠定基础。
1 材料与方法
1.1 试验材料
材料为两种3 a及以上地生兰:蕙兰(Cymbidium faberi)、墨兰(Cymbidium sinense),采自郑州师范学院兰花工程中心智能温室,分别选取:成苗期(没有花葶抽出)的根和叶;花蕾期(花葶抽出,有花蕾,无开花)的根、叶、花葶和花蕾;盛花期(花葶上大部分花蕾展开)的根、叶、花(将花剥离为萼片、花瓣、唇瓣、合蕊柱、子房)和花葶。每份材料至少3个重复。所有材料用锋利刀片切取后迅速用液氮速冻,并置于-80℃冰箱,备用。
1.2 试剂和仪器
主要试剂:RNAprep pure植物总RNA 提取试剂盒、SYBR Premix Ex Taq TM II、M-MLV 反转录试剂盒均购自大连宝生物工程有限公司;主要仪器:琼脂糖凝胶电泳仪(P25T,德国Biometra),微量紫外分光光度计(Q5000,美国Quawell),实时荧光定量PCR 仪(realplex2,德国Eppendorf)。
1.3 总RNA 的提取及cDNA 第一链的合成
按照RNAprep pure试剂盒的方法提取两种国兰器官和组织的总RNA,分别吸取不同材料的RNA 1.0μL,于1.0%琼脂糖凝胶上电泳检测其完整性,利用Quawell Q5000 微量紫外分光光度计检测RNA 浓度、质量,以蕙兰和墨兰的花蕾总RNA 为模板,用M-MLV 反转录酶完成RNA 的反转录。
1.4 PI 基因克隆及生物信息学分析
根据GenBank 建兰(JQ326259.1)、春兰(HM106984.1)、石斛(DQ017701.1)、文心兰(HM140842.1)等的PI基因序列,选择比较保守的区段,根据引物设计原则设计1 对引物PI-F,PI-R(表1)用于蕙兰和墨兰PI基因的克隆。以蕙兰和墨兰花蕾总RNA 反转录后的cDNA 为模板进行RT-PCR,Tm 为51.9 ℃,预期目的条带获得后切胶回收,再进行TA 克隆,测序分析。将正确的PI基因序列在NCBI(http://blast.ncbi.nlm.nih.gov/)上通过blastn检索,并与其他物种PI核苷酸序列比对;通过blastp比对所编码蛋白获得其保守结构域及功能域。
1.5 PI 基因时空表达分析
依据得到的PI核苷酸序列设计特异荧光定量引物进行RT-qPCR 试验。参照SYBR Premix ExTaqTMII使用说明,用RT-qPCR 的方法检测PI基因在蕙兰和墨兰不同发育阶段不同部位的相对表达丰度,蕙兰PI基因的表达检测的内参基因为ACT、UBQ3,EF1α、ACT为墨兰的内参基因。每个样品3个重复,Tm 为58 ℃,利用蒸馏水为阴性对照,反应体系20μL,程序为:95 ℃预变性30 s,95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸30 s,变性、退火、延伸为一个循环单位,共40个循环。表达相对丰度计算方法为:Rel.Exp=2-ΔΔCt。RT-qPCR 反应中使用引物及参数见表1。
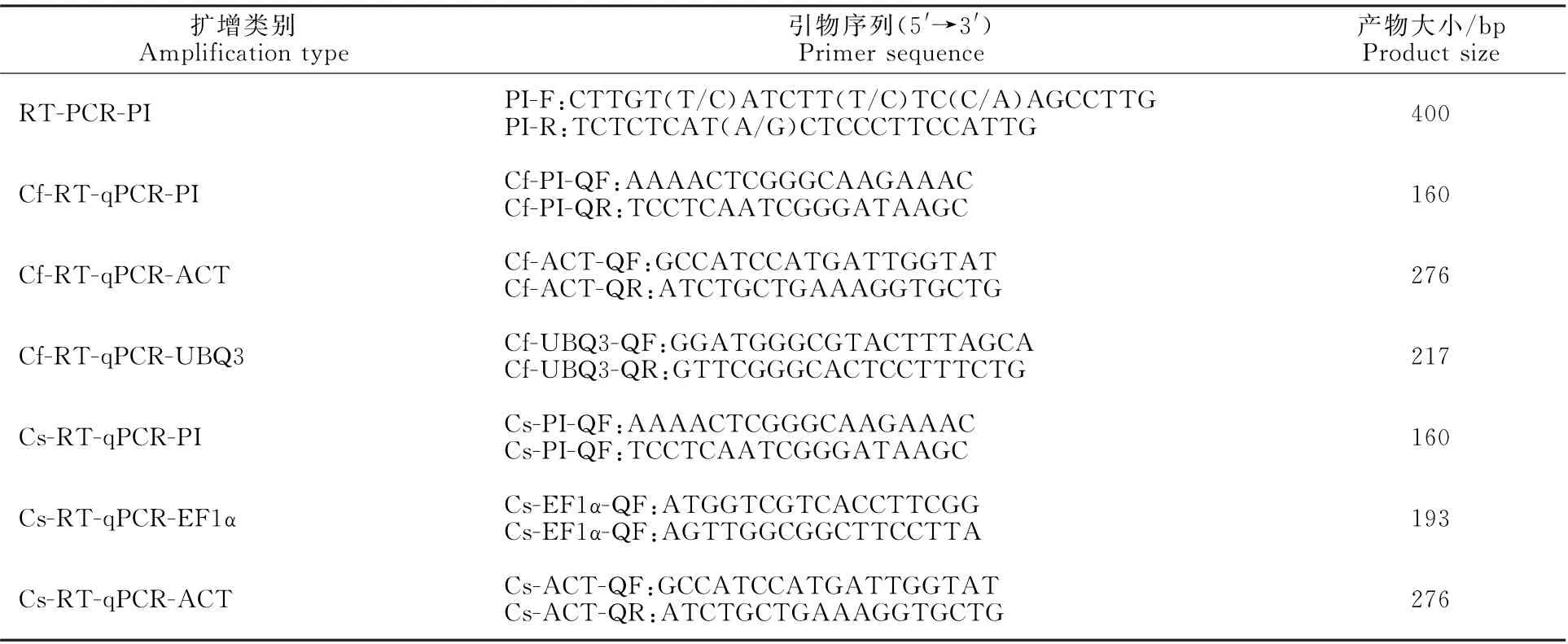
表1 扩增PI/GLO 基因cDNA序列所用的引物及引物之间在各扩增反应中的组合Table 1 PCR primers for amplification of cDNA sequence of PI/GLO gene and combination of primers
2 结果与分析
2.1 PI 基因cDNA 序列克隆
分别以蕙兰、墨兰的花蕾cDNA 为模板,结合PI-F、PI-R 简并引物(表1)扩增PI/GLO保守序列,得到两条长度约为400 bp的目的条带(图2),与预期结果一致,测序后长度均为398 bp。将其核苷酸序列在NCBI上Blast分析,发现蕙兰CfPI1和墨兰CsPI1均与建兰(JQ326259.1)PI基因有99% 的一致性;CfPI1基因与石斛兰(EU444028.1)、球花石斛(DQ017701.1)、细茎石斛(EU056326.2)、萼脊兰(KM975642.1)的同源性为95%、94%、94%、93%;CsPI1基因与上述基因序列的同源性分别为95%、95%、94%、93%。提交GenBank,登录号为 MW654194,MW654193。

图2 两种国兰PI 基因PCR 扩增产物Fig.2 PCR amplification products of two Chinese orchids PI genes
2.2 PI 基因编码的蛋白序列分析
通过NCBI网站比对,两个PI/GLO均为MIKC 型MADS-box 基因,均有保守的MADS区和相对保守的K 区(图3 和图4),且与春兰(AD158461.1)同源性较高,分别为98%、99%。CfPI1和CsPI1与细茎石斛(XP_020679601.1)同源性为95%、97%,文心兰(ACD85113.1)95%、96%,球花石斛(AAY86363.1)95%、96%,萼脊兰(AJG41730.1)93%、95%,蝴蝶兰(AAV28490.1)92%、93%。

图3 CfPI1 基因核苷酸序列和推测的氨基酸序列及蛋白保守域Fig.3 Nucleotide acid sequence and deduced amino sequence of CfPI1 gene and conservative protein domain structure

图4 CsPI1 基因核苷酸序列和推测的氨基酸序列及蛋白保守域Fig.4 Nucleotide acid sequence and deduced amino sequence of CsPI1 gene and conservative protein domain structure
2.3 CfPI1 在蕙兰各组织器官中的表达
CfPI1在蕙兰各组织器官中的相对表达丰度顺次为花萼>花瓣>唇瓣>花蕾>子房>盛花期花葶>合蕊柱(图5),除了盛花期花葶外在生殖器官中均表达,而在苗期的根和叶、花蕾期的根、叶和花葶、盛花期叶中几乎未检测到,即除盛花期花葶外CfPI1在蕙兰营养器官中不表达。就蕙兰的3个生长时期来说,表达丰度顺次为营养生长期<花蕾期<盛花期。对于蕙兰花器官来说,CfPI1在花器官组织中自外而内表达水平逐渐降低。

图5 CfPI1 在蕙兰各组织器官中的表达Fig.5 Expression of CfPI1 in tissues of Cymbidium faberi
2.4 CsPI1 在墨兰各组织器官中的表达
CsPI1在墨兰各组织器官中的相对表达丰度顺次为花瓣>唇瓣>花蕾>花萼>合蕊柱>子房(图6),在营养生长期、花蕾期、盛花期的根、叶、花葶中几乎未检测到荧光信号。CsPI1只在墨兰生殖器官中表达,而在营养器官中均不表达。对于3个生长时期,CsPI1在墨兰器官组织中的表达量逐渐升高,说明CsPI1主要调控生殖器官的生长发育。
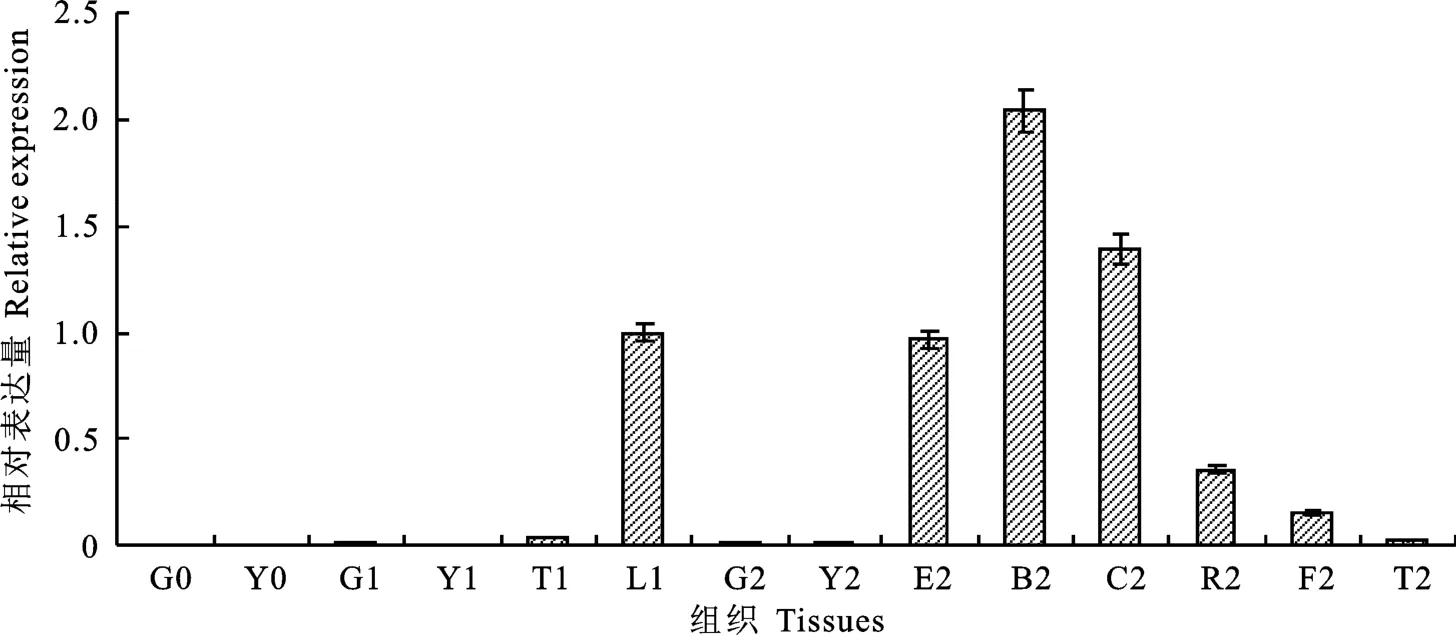
图6 CsPI1 在墨兰各组织器官中的表达Fig.6 Expression of CsPI1 in tissues of Cymbidium sinense
3 讨论
所克隆的两条PI/GLO序列均为MIKC 型MADS-box基因。均有M、I和K 结构域。两基因与春兰(AD158461.1)、细茎石斛(XP_020679601.1)、文心兰(ACD85113.1)、球花石斛(AAY86363.1)、萼脊兰(AJG41730.1)、蝴蝶兰(AAV28490.1)的同源性均在92%以上,推测CfPI1和CsPI1基因功能与以上兰科植物PI/GLO基因相似。
通过RT-qPCR 试验发现两个基因在不同的组织和器官中均差异表达,CfPI1和CsPI1均主要表达于花器官中,这与蝴蝶兰GLO/PI基因Pe MADS6的表达特性一致[21]。两个基因表达相似之处在于二者均在花萼、花瓣、唇瓣和花蕾中突出表达,表明这两个基因主要参与花被片的发育,而且二者在子房中也有表达。不同之处在于,蕙兰表达最突出部位是花萼,墨兰是花瓣;而且蕙兰盛花期花葶中也有表达,墨兰在合蕊柱中表达也相对突出。二者均是主要调控花器官的发育。CfPI1在花器官中自外而内表达水平逐渐下调,CsPI1在花器官花瓣中的表达高于花萼,这与红花玉兰Mawu PI[9-10]的表达相似。这表明不同植物中PI功能并不完全保守,而是存在一定差异。前人研究中,Tunen等[22]首次指出花瓣类似的萼片的形成是B 类基因的表达区域向外扩展导致的结果,致本来花器官第一轮仅A 类基因控制变为A+B同时控制。
拟南芥PI蛋白直接结合AP1启动子中的序列以调控AP1基因的表达,从而参与花的发育[17]。白桦Bp PI过表达可能通过限制开花激活因子来延迟开花,其中Bp AP1显著下调,而且Bp PI可以直接与Bp AP1的启动子结合,限制Bp AP1的表达[23]。蕙兰的AP1/FUL亚家族同源基因CfAP11[24]、CfMADS1[25]主要在营养期叶、花蕾期叶、花蕾、花葶、盛花期叶和子房中表达,与蕙兰的成花诱导和子房发育有关。而Cf-PI1在花蕾和盛花期花器官突出表达。由此推断蕙兰CfPI1的表达限制了开花时间基因CfAP11和CfMADS1的表达,CfPI1基因可能通过调控Cf AP11和Cf MADS1的表达来调控花器官的发育。这还需要通过染色质免疫共沉淀方法进一步分析验证。

