甘蓝型油菜Bn WRKY41的理化性质分析及BnWRKY41-2在花青素合成中的功能解析
于芮芦魏泽楼郭 媛刘子金陈明训
(国家杨凌农业生物技术育种中心,陕西省作物杂种优势研究与利用重点实验室,西北农林科技大学农学院,陕西杨凌 712100)
油菜(Brassica napusL.)不仅能为人类提供食用油,而且可作为生物燃料和动物饲料的来源[1]。在中国油料作物中,油菜的种植范围广、面积大,占油料作物总种植面积的一半以上,其中冬油菜种植面积占油菜总种植面积的九成以上[2]。花青素属于黄酮类化合物,具有较强的抗氧化特性,能够增强植物抵御生物和非生物胁迫的能力[3-7],同时也能被人体所吸收,进而提高机体免疫力[8-10]。冬油菜的抗寒性决定了其能否在北方地区安全过冬并获得丰收[11]。研究表明油菜的抗寒性与花青素的含量息息相关[12-14],然而目前关于油菜花青素代谢调控的研究报道尚不多见。因此,挖掘调控油菜花青素合成的关键基因,有助于利用分子育种手段培育花青素含量高、对非生物逆境具有较强抵抗力的优异油菜种质资源。
WRKY 家族成员众多,目前在拟南芥中报道的WRKYs有72个[15],是高等植物中最大的转录因子家族之一,通常在其N 端有WRKY 结构域,该结构域包含一段保守氨基酸序列WRKYGQK 和结合锌离子的锌指蛋白结构[16-17]。大量研究表明,WRKY 家族转录因子参与调控植物逆境胁迫[18-20]、根系发育[21]、叶片发育[22]、毛状体形成[23]、种子发育[24]和衰老[25-26]等生理生化过程。近年研究表明WRKY 转录因子也参与花青素的生物合成。葡萄Vv WRKY26正调控色素的积累,在矮牵牛ph3突变体中过量表达Vv WRKY26后,色素含量也得到显著提高[27]。Md WRKY11转化苹果愈伤组织后,类黄酮和花青素的含量显著高于对照组,并且类黄酮通路中相关基因的表达量显著上升[28]。WRKY41在植物响应非生物逆境中也发挥关键作用。比如:在烟草中过量表达棉花Gh-WRKY41基因,可显著增强其耐盐抗旱能力[29];在番茄中,Sp WRKY41参与调控番茄的抗逆响应过程,其表达模式受外源水杨酸、赤霉素和乙烯等激素影响[30]。在拟南芥中过量表达辣椒CaWRKY41基因可降低镉的耐受性,增强镉和锌的吸收以及过氧化氢的积累[31]。在拟南芥中,At WRKY41促进种子休眠[32],但抑制叶片花青素的生物合成[33]。尽管科研工作者对WRKY41转录因子研究较多,但对甘蓝型油菜中该基因在花青素合成中的调控功能仍不清楚。
在甘蓝型油菜品种‘中双11’(ZS11)中,WRKY41有两个拷贝,分别为Bn WRKY41-1和Bn WRKY41-2。西北农林科技大学油菜生物育种理论与技术创新团队前期研究发现,Bn-WRKY41-1显著抑制拟南芥叶片中花青素的积累[33]。但是,Bn WRKY41-2 在叶片花青素合成中的生物学功能尚不清楚。本研究对油菜Bn-WRKY41-1和Bn WRKY41-2两个拷贝进行生物信息学比较分析,并在拟南芥中初步分析Bn-WRKY41-2 在花青素合成过程中的调控作用。
1 材料与方法
1.1 植物材料与培养
植物材料包括拟南芥野生型(Col-0)、拟南芥At WRKY41基因的功能缺失突变体wrky41-2(SALK_028449)、甘蓝型油菜‘中双11’(ZS11)和以wrky41-2突变体为遗传背景的T3代转基因株系(wrky41-2 35S:Bn WRKY41-2-6HA)。所有材料均种植于人工培养箱中,温度为22 ℃,光照周期为16 h光照和8 h黑暗,光照强度为160 μmol·m-2·s-1。
1.2 生物信息学分析
利用在线网站了解Bn WRKY41-1 和Bn-WRKY41-2 两个蛋白质的基本理化性质、结构和功能,预测它们在细胞内的功能,相关网站及其网址如表1所示。
1.3 RNA提取与cDNA第一链合成
利用RNA 提取试剂盒(Steady Pure Plant RNA Extraction Kit,Cat:AG21019)提取拟南芥和油菜叶片中的总RNA。使用Naon Drop(NanoDrop ND-1000)测定RNA 浓度。使用反转录试剂盒Evo M-MLV RT for PCR Kit(Accurate Biotechnology,Cat:AG11603)合成cDNA,储存在-20 ℃,供后续试验使用。
1.4 基因克隆和植物表达载体构建
依据NCBI数据库中Bn WRKY41-2基因的CDS序列,利用PrimerBLAST 程序设计特异性引物(表2),以‘ZS11’幼嫩叶片的cDNA 为模板,利用高保真DNA 聚合酶(TaKaRa,Cat:R010A)通过PCR 技术扩增目的基因。PCR 反应程序如下:98 ℃预变性30 s,98 ℃变性10 s,58 ℃退火5 s,72℃延伸1 min 30 s,35个循环,72℃延伸5 min,12 ℃保存。切胶,使用凝胶回收试剂盒(OMEGA,Cat:D2500-02)对胶条中的目的DNA 片段进行回收。利用限制性内切酶XmaⅠ和SpeⅠ对纯化后的目的片段以及载体p Green-6HA、p Green-GFP进行酶切处理,使用T4连接酶(Ta KaRa,Cat:2011A)连接酶切后的目的片段和载体并转化大肠杆菌感受态细胞DH5α,随机筛选6个阳性单克隆送至生工生物工程(上海)股份有限公司测序。这6个阳性克隆的测序结果完全一致,并与目标序列完全一致,表明从‘ZS11’中成功克隆Bn WRKY41-2基因的CDS序列,并成功构建该基因的植物表达载体35S:Bn-WRKY41-2-6HA和35S:Bn WRKY41-2-GFP。
1.5 烟草叶片的亚细胞定位
利用农杆菌侵染法[34]将35S:Bn WRKY41-2-GFP载体转入到烟草(Nicotiana benthamiana)叶片细胞中表达,分析油菜BnWRKY41-2在烟草叶片细胞中的亚细胞定位。步骤如下:将35S:Bn WRKY41-2-GFP载体转染烟草幼嫩叶片,培养72 h后,将DAPI(4’,6-二脒基-2-苯基吲哚)染液(1 mol· L-1Tris,p H 7.4,5 mol·L-1NaCl,1μg·L-1DAPI)注入上述烟草叶片中,30 min后用激光共聚焦显微镜(ZEISS LSM700,Germany)观察荧光信号并拍照。
1.6 转基因株系的筛选与鉴定
将35S:Bn WRKY41-2-6 HA转化农杆菌感受 态 细 胞 (Agrobacterium tumefaciensGV3101),随后在LB 培养基(含50μg·m L-1Kanamycin和25μg·m L-1Rifampicin)上挑取单克隆进行PCR 鉴定。采用花序浸染法[35],转化拟南芥突变体wrky41-2。将收获的种子均匀撒在营养土上,待其长出真叶时,每隔2~3 d喷施草铵膦(Basta),将筛选的抗性苗移至新的营养土上,单株进行DNA 水平和RNA 水平鉴定,确定是否成功转入目的基因,鉴定结果为阳性的株系即为T1代转基因株系,将收获的种子置于MS培养基(含10μg·m L-1草铵膦)上继续筛选,直至获得T3代纯合转基因株系。
1.7 叶片花青素含量测定
参考Chory等[36]方法测定拟南芥叶片花青素的含量,简要步骤如下:准确称取0.1 g拟南芥叶片,用液氮研磨至粉末状加入300μL 提取液[盐酸∶甲醇=1∶99(W/V)],混合均匀后4 ℃避光过夜。加入200μL的蒸馏水和500μL的氯仿,上下摇晃1 min,12 000 r·m L-1离心8 min。利用多功能酶标仪(TECAN Spark,Austria)测定溶液在波长为530 nm 和657 nm 处的吸光值。各样品花青素相对含量=(A530-A657)/鲜质量,鲜质量单位为g。
1.8 基因表达分析
利用实时荧光定量PCR(RT-qPCR)技术分析基因表达情况。使用SYBR○R Premix Ex TaqTMⅡ(TakaRa,Cat:DRR820A)试剂盒进行荧光定量试验。试验每个样品设置3个技术重复和3个生物学重复,参照试剂盒说明书,反应体系为20μL,反应程序为:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环,72 ℃延伸5 min,12 ℃保存。以管家基因At Actin7为内参基因,各个基因的相对表达量根据2-△△Ct法[37],RT-qPCR 试验所用引物见表2。

表2 引物序列Table 2 Sequences of primers
2 结果与分析
2.1 BnWRKY41-1 和BnWRKY41-2 蛋白质的生物信息学比较分析
2.1.1 理化性质分析 如表3 所示,Bn-WRKY41-1氨基酸残基总数为330,分子质量为36 564.71 u,等电点为5.68,其中带正电荷的氨基酸共有31个,占9.4%,带负电荷的氨基酸共有37个,占11.2%,不稳定系数为45.50,平均亲水性为-0.618;Bn WRKY41-2 氨基酸残基总数为323,分子质量为35 948.9 6 u,等电点为5.90,其中带正电荷的氨基酸共有32 个,占9.9%,带负电荷的氨基酸共有36个,占11.1%,不稳定系数为46.42,平均亲水性为-0.693。结果表明Bn WRKY41-1 和Bn WRKY41-2 均为不稳定、弱酸性的亲水蛋白质。

表3 BnWRKY41蛋白质的基本理化特性Table 3 Physicochemical properties of BnWRKY41 proteins
2.1.2 蛋白质结构预测分析 在线网站SOPMA 预测表明,Bn WRKY41-1 和Bn WRKY41-2蛋白质的二级结构均以无规则卷曲为主,分别为62.73% 和59.44%,其次是α-螺旋,分别为21.21%和24.15%,β-转角占比最少,分别为4.24%和2.79% (图1-A、1-B)。在线网站SWISS-MODEL预测表明,BnWRKY41-1和Bn-WRKY41-2 蛋白质三级结构基本一致,均可形成一个单体,没有配体的结合(图1-C、1-D)。
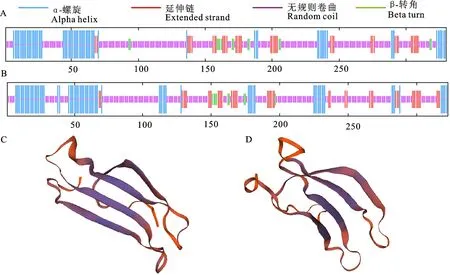
图1 BnWRKY41蛋白质的二级结构和三级结构Fig.1 The secondary and tertiary structuresof BnWRKY41 proteins
2.1.3 结构域预测分析 利用在线网站TMHMM Server对Bn WRKY41两个蛋白质的跨膜结构、信号肽和结构域预测分析,结果表明Bn-WRKY41两个蛋白质均没有跨膜结构域(图2-A、2-B),各项预测指标均低于阈值,没有N 端信号肽(图2-C、2-D),属于非分泌性蛋白质,具有典型的WRKY 家族转录因子结构域(图2-E)。
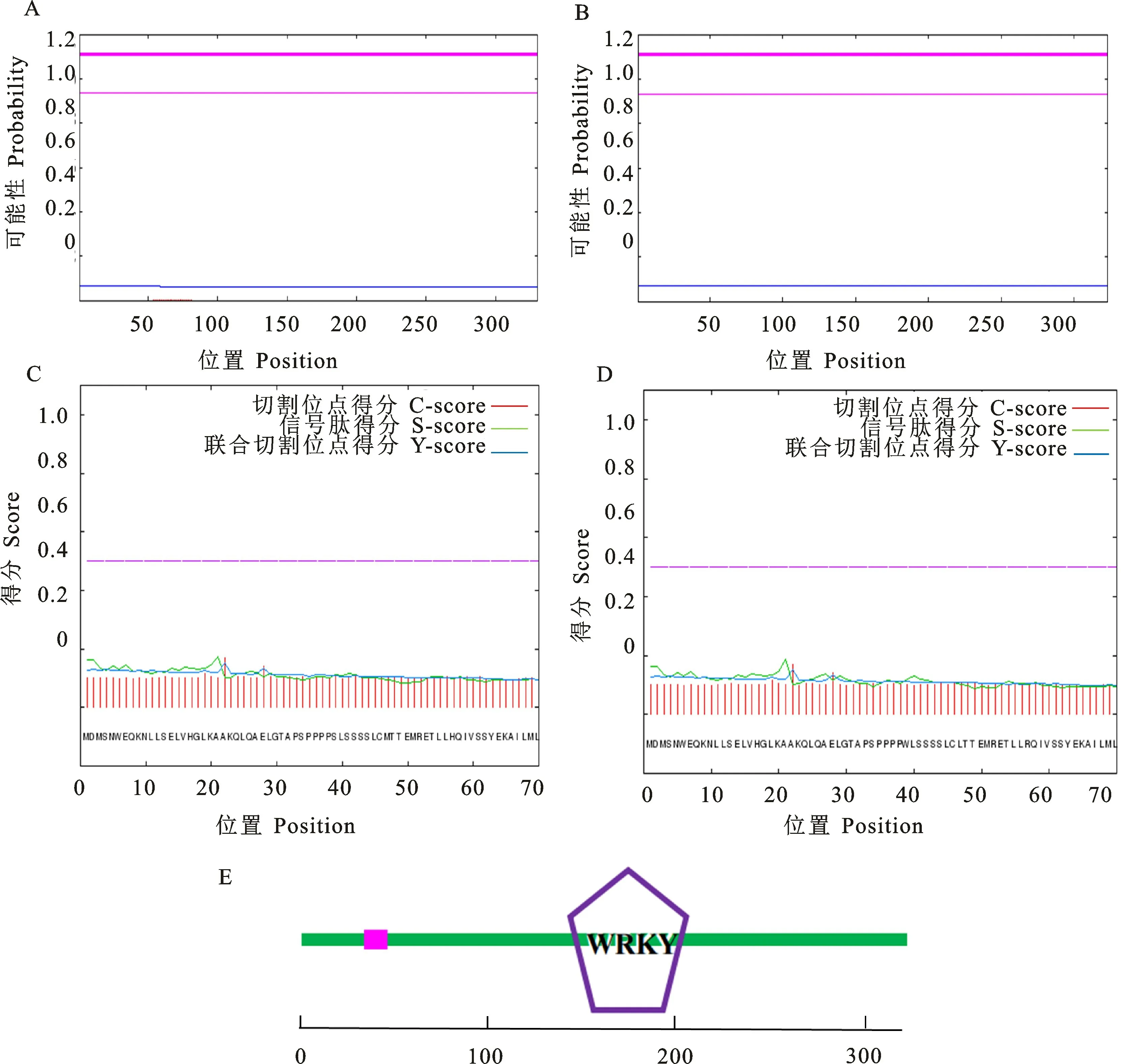
图2 BnWRKY41蛋白质结构域预测分析Fig.2 Prediction of functional domains of BnWRKY41 proteins
2.1.4 氨基酸翻译后磷酸化修饰位点和N-糖基化修饰位点预测分析 利用在线网站NetPhos 3.1 Server对Bn WRKY41两个蛋白质的三类氨基酸残基[丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)]进行翻译后的磷酸化修饰位点预测。结果发现Bn WRKY41-1中磷酸化位点共有44个,其中丝氨酸磷酸化位点最多,有28个,其位置分别在:4、34、39、41、42、44、61、62、78、100、103、107、110、125、126、142、156、173、194、212、245、253、257、266、269、285、299、303。其次是苏氨酸磷酸化位点,有13个位点,其位置分别在:49、54、94、178、182、204、210、223、224、261、291、298、300。酪氨酸磷酸化位点最少,仅3个,其位置分别在:63、160、288(图3-A)。BnWRKY41-2 的磷酸化位点共有42 个,其中丝氨酸磷酸化位点最多,达26个,其位置分别在:4、34、42、44、61、62、77、92、95、99、102、117、118、134、148、165、186、204、237、246、250、259、262、281、292、296。其次是苏氨酸磷酸化位点,有12个位点,其位置分别在:49、54、86、170、174、196、202、215、216、254、289、291。酪氨酸磷酸化位点最少,仅有4个,其位置分别在:63、152、264、277(图3-B)。
通过在线网站Net NGlyc1.0 Server对Bn-WRKY41两个蛋白质进行N-糖基化修饰位点预测,结果显示,BnWRKY41-1 和BnWRKY41-2均含有5个天冬酰胺(Asn)翻译后的N-糖基化修饰位点,分别位于第71、123、226、243、283位(图3-C)和第71、115、218、235、276位(图3-D)。
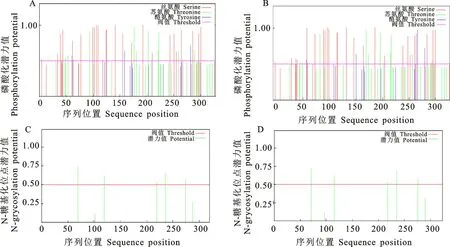
图3 BnWRKY41蛋白质磷酸化修饰位点和N-糖基化修饰位点预测分析Fig.3 Prediction of phosphorylation and N-glycosylation modification sites of BnWRKY41 proteins
氨基酸残基修饰位点预测结果表明,Bn-WRKY41-1和Bn WRKY41-2 主要通过丝氨酸的磷酸化修饰发挥生物学功能。
2.1.5 蛋白质共表达网络预测分析 利用在线网站STRING 预测BnWRKY41 两个蛋白质的共表达网络(图4-A、4-B),结果表明Bn-WRKY41-1 和Bn WRKY41-2 均能够与含有WRKY 结构域、B3结构域、WD-repeat序列的蛋白质形成互作网络,在DNA 结合、转录调控、信号转导等过程中发挥作用。此外,与Bn WRKY41-1互作的蛋白质还参与细胞壁修饰(表4),与Bn WRKY41-2 互作的蛋白质参与细胞组分构成(表5)。
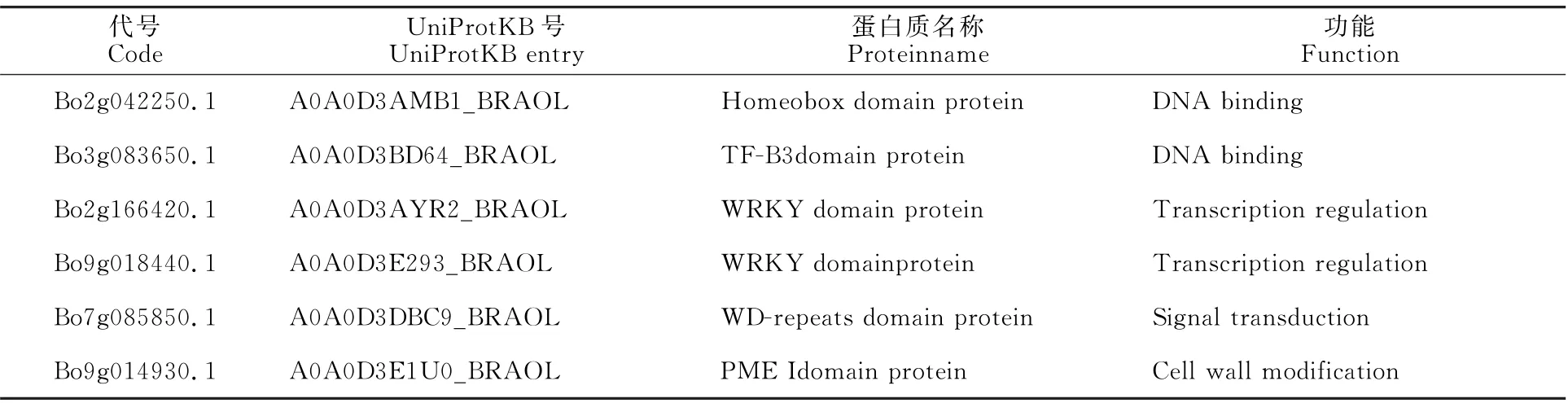
表4 BnWRKY41-1共表达网络中的蛋白质信息Table 4 The protein information in the coexpression network of BnWRKY41-1 protein
表5 BnWRKY41-2 共表达网络中的蛋白质信息Table 5 The protein in formation in the coexpression network of the BnWRKY41-2 protein
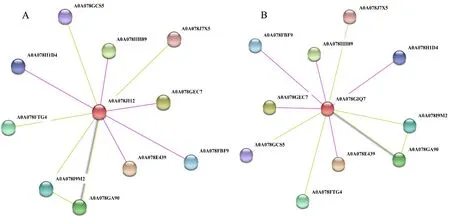
图4 BnWRKY41-1(A)和BnWRKY41-2(B)蛋白质的共表达网络Fig.4 The coexpression network of BnWRKY41-1(A)and BnWRKY41-2(B)proteins
2.2 油菜Bn WRKY41-2定位于烟草叶片细胞的细胞核中
通过瞬时转化使重组载体35S:Bn-WRKY41-2-GFP在烟草叶片细胞中表达,在激光共聚焦显微镜下,根据荧光信号判断Bn-WRKY41-2 的亚细胞定位情况。如图5 所示,Bn WRKY41-2 蛋白质定位于细胞核中,因此推断Bn WRKY41-2 蛋白质在细胞核中发挥功能,可能具有转录因子特性。

图5 BnWRKY41-2 在烟草叶片细胞中的亚细胞定位Fig.5 Subcellular localization of the BnWRKY41-2 protein in N.benthamiana leaf cells
2.3 油菜BnWRKY41-2抑制拟南芥叶片花青素的积累
为探究Bn WRKY41-2 对花青素积累的影响,构建植物过量表达载体35S:Bn WRKY41-2-6HA,并转入到拟南芥突变体wrky41-2(图6-A),利用草铵膦除草剂筛选获得10个以上T1代转基因单株,本研究随机选取2个转基因株系,并用特异性引物对其进行PCR鉴定(图6-B)。利用RT-qPCR 技术检测野生型、突变体和2 个独立的拟南芥转基因株系wrky41-2 35S:Bn-WRKY41-2中油菜Bn WRKY41-2基因的转录水平(图6-C),结果显示Bn WRKY41-2在拟南芥转基因株系中均有大量表达,在野生型和突变体wrky41-2中没有表达。利用酶标仪检测野生型、突变体和2个独立的拟南芥转基因株系wrky41-2 35S:Bn WRKY41-2-6HA发芽20 d叶片中的花青素含量,结果显示过量表达Bn WRKY41-2基因能够使突变体叶片中高花青素含量的表型完全恢复至野生型水平(图6-D),由此说明,Bn-WRKY41-2 在拟南芥叶片花青素积累过程中起负调控作用。
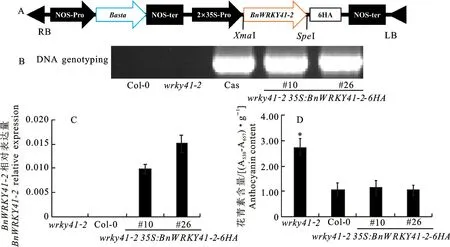
图6 转基因株系wrky41-2 35S:BnWRKY41-2-6HA 的分子鉴定及花青素含量分析Fig.6 Molecular characterization and quantitative assay of anthocyanin content of wrky41-2 35S:BnWRKY41-2-6HA transgenic plants
2.4 油菜Bn WRKY41-2抑制花青素积累相关基因的表达
前期研究表明拟南芥At WRKY41通过抑制At MYB75、At MYB111、At MYBD、AtGSTF12和At1G68840基因的表达,负调控花青素的积累[33]。为进一步探究Bn WRKY41-2 对花青素积累的影响,本研究利用RT-qPCR 技术检测了以上5个基因在Col-0、wrky41-2和wrky41-2 35S:Bn WRKY41-2-6HA转基因株系莲座叶中的表达量。在突变体wrky41-2中At MYB75、At MYB111、At MYBD、AtGSTF12和At1G68840基因的表达量均显著高于Col-0,而在wrky41-2 35S:Bn-WRKY41-2-6HA转基因株系中,这些基因的表达量得到显著抑制,其水平与Col-0相比并无显著差异(图7)。这些结果表明,BnWRKY41-2 与At WRKY41功能类似,均通过负调控At MYB75、At MYB111、At MYBD、At1G68840和AtGSTF12基因的表达,抑制拟南芥叶片花青素积累。

图7 过量表达油菜BnWRKY41-2 基因后花青素合成相关基因的表达Fig.7 Expression of anthocyanin biosyn thesis genes under BnWRKY41-2 overexpression
3 讨论
前期研究表明拟南芥At WRKY41除调控种子休眠[32]、逆境响应外[38],还显著抑制叶片花青素的积累[33]。甘蓝型油菜Bn WRKY41 有两个拷贝,序列同源性高,其中Bn WRKY41-1通过负调控At MYB75、At MYB111、At MYBD、AtGSTF12和At1G68840等花青素合成相关基因的表达,显著抑制拟南芥叶片花青素的积累,并与拟南芥At WRKY41在调控叶片花青素生物合成方面功能相似[33],但Bn WRKY41两个拷贝蛋白质结构及Bn WRKY41-2 在调控叶片花青素生物合成方面的功能尚不清楚。本试验旨在对Bn-WRKY41两个拷贝进行生物信息学分析,并研究Bn WRKY41-2 在调控叶片花青素生物合成中的功能。结果表明Bn WRKY41-1和Bn WRKY41-2分别编码330 和323 个氨基酸残基,均含有WRKY 转录因子家族典型结构域WRKYGQK,两个蛋白质均属于亲水性、不稳定(表3)、非分泌蛋白质(图2-A、2-B),不具备信号识别功能(图2-C、2-D),二级结构主要由无规则卷曲组成(图1-A、1-B),蛋白质磷酸化主要集中在丝氨酸残基上,N-糖基化位点有5 个(图3),推测Bn-WRKY41-1和BnWRKY41-2 蛋白质功能相似;亚细胞定位结果表明Bn WRKY41-2 定位在细胞核中(图5),说明可能作为转录因子发挥作用,这与前期研究的Bn WRKY41-1的亚细胞定位结果一致[33]。在拟南芥突变体wrky41-2中过量表达Bn WRKY41-2基因能够完全恢复突变体莲座叶花青素含量高的表型(图6-D)。因此,以上研究结果表明,Bn WRKY41两个拷贝不仅在蛋白质结构及理化性质方面相似,而且均可抑制拟南芥叶片花青素积累。以往研究显示,高等植物中存在大量结构类似,功能保守的拷贝,例如亚麻中Lu FAD25 个拷贝均能促进亚油酸的生物合成[39]。
前人研究表明,At MYB75、At MYB111 和At MYBD 属于MYB转录因子,在花青素合成过程中发挥重要作用。At MYB75基因参与调控植物体内花青素的积累,调控类黄酮物质生物合成相关基因的表达[40-41]。At MYB111 调控子叶中类黄酮的合成[42-43]。At MYBD 是花青素生物合成过程中的正向调控因子[44]。At1G68440 参与苯丙烷代谢途径[45],生成花青素生物合成的关键底物香豆酰-辅酶A[46-47]。At GSTF12基因编码谷胱甘肽-S-转移酶,将花青素从胞质转运到液泡中,促进花青素积累[48-50]。前期研究表明,At-WRKY41突变以后,At MYB75、At MYB111、At MYBD、AtGSTF12和At1G68840等基因在叶片中的表达量显著提高,而在wrky41-2突变体中过量表达Bn WRKY41-1则能够显著抑制这些基因的表达[33]。本研究发现,在拟南芥wrky41-2突变体中过量表达Bn WRKY41-2也显著抑制了这些基因的表达(图7)。以上结果表明油菜BnWRKY41-1 和Bn WRKY41-2 与At-WRKY41在抑制拟南芥叶片花青素积累方面功能相似。
油菜作为中国第一大油料作物,栽培历史悠久,多功能利用价值高。叶片花青素在抵御各种生物和非生物胁迫方面发挥着重要作用[6],本研究初步分析了油菜Bn WRKY41两个拷贝蛋白质结构以及Bn WRKY41-2 在花青素积累过程中的调控作用,不仅为深入揭示其作用机制奠定了基础,而且为油菜的品质改良育种提供了优异基因资源。

