低氧诱导小胶质细胞代谢进程紊乱的转录组测序分析
李盼,史平玲,葛可可,张文华,胡旭萌,周佳木,魏圆梦,李苗,宋宗明
(郑州大学人民医院/河南省人民医院/河南省立眼科医院/河南省眼科研究所/河南大学人民医院,河南 郑州 450003)
缺血缺氧在许多视网膜疾病的发生发展进程中发挥了重要的作用,如早产儿视网膜病变(retinopathy of prematurity,ROP)、糖尿病视网膜病变(diabetic retinopathy,DR)、视网膜静脉阻塞、老年性黄斑变性等视网膜疾病[1]。视网膜小胶质细胞是视网膜组织驻留的免疫监测细胞[2]。静息状态下,小胶质细胞负责检测机体微环境的变化,并对损伤和感染等刺激作出快速应答[3]。低氧也能够诱导小胶质细胞发生活化,并分泌大量的炎症因子和趋化因子[2],活化小胶质细胞不仅能够引起视网膜神经损伤及新生血管生成[4-5],还能导致代谢异常[6],最终造成不可逆的视力损害。但是低氧诱导小胶质细胞代谢异常的机制尚未完全阐明。因此,探索低氧诱导小胶质细胞代谢紊乱的作用机制可为缺血缺氧性视网膜疾病寻找新的治疗靶点提供新思路。转录组测序是新兴的利用新一代测序技术进行转录组分析的技术,可以快速获取某种干预后组织或细胞的转录本信息,具有高分辨率、高通量、高灵敏度、使用便捷等优点,已广泛应用于医药、动物、植物等研究领域中[7]。本实验对低氧处理的小胶质细胞系BV2细胞进行转录组测序,旨在探讨低氧对BV2细胞基因表达的调控。
1 材料和方法
1.1 材料
1.1.1细胞来源 BV2小胶质细胞购自国家实验细胞资源共享服务平台。
1.1.2主要仪器及试剂 胎牛血清购自浙江天杭生物科技股份有限公司,含1 g·L-1链霉素和青霉素的DMEM高糖培养液、磷酸盐缓冲液(phosphate buffered saline,PBS)、胰蛋白酶-EDTA消化液、RIPA组织/细胞快速裂解液、TBST缓冲液、BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,脱脂奶粉购自北京克尔慧科技有限公司,羊抗兔IgG-HRP、羊抗兔IgG-FITC、鼠单克隆抗体PFKP购自北京博奥森生物技术有限公司,ECL双敏化学发光试剂购自安诺伦(北京)生物科技有限公司,PAGE凝胶制备试剂盒购自上海雅酶生物科技有限公司,罗丹明123、兔多克隆抗体TPI1、兔单克隆抗体PGK1购自上海碧云天生物技术有限公司,羊抗鼠IgG-HRP购自爱必信(上海)生物科技有限公司,蛋白酶抑制剂和磷酸酶抑制剂购自MCE公司,NC膜购自Merck Millipore公司,Trizol Reagent试剂购自Invitrogen公司,反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser及实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)所需试剂TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒购自日本TaKaRa Biotechnology公司,引物由中国上海生工生物工程股份有限公司合成,细胞培养箱(美国Thermo Fisher公司),StepOnePlusTMReal-Time PCR仪(美国Applied Biosystems公司),研究型荧光正置显微镜(Nikon 80i),化学发光仪(美国BIO-RAD公司)。
1.2 实验方法
1.2.1细胞培养 BV2细胞培养于21% O2(体积分数)、5% CO2(体积分数)、37 ℃的三气培养箱中,培养液采用含有10 g·L-1胎牛血清的DMEM,待细胞长至80%融合度时进行传代。从三气培养箱中拿出细胞,移出培养液,PBS轻轻漂洗1遍,用1 mL含EDTA的胰酶消化细胞,在显微镜下观察到细胞形态变圆时即可加入含10 g·L-1胎牛血清的DMEM高糖培养液终止消化,1 000 r·min-1离心5 min后弃去上清,用培养液重悬沉淀,按每毫升1×106个细胞的密度接种细胞至直径为10 cm的培养皿中。
1.2.2细胞分组 细胞在21% O2(体积分数)、5% CO2(体积分数)、37 ℃的三气培养箱中孵育过夜,常氧组在21% O2(体积分数)、5% CO2(体积分数)、37 ℃的三气培养箱中继续培养12 h或24 h,低氧组放入1% O2(体积分数)、5% CO2(体积分数)、37 ℃的三气培养箱中继续培养12 h或24 h。细胞分组为:常氧12 h组、低氧12 h组、常氧24 h组、低氧24 h组。
1.2.3RT-qPCR 收集常氧组和低氧组细胞,采用Trizol试剂提取细胞总RNA,用分光光度计测RNA浓度,按照PrimeScriptTMRT reagent Kit with gDNA Eraser说明书将提取的mRNA反转录成cDNA,再用TB Green®Premix Ex TaqTMⅡ(Tli RNaseH Plus)进行RT-qPCR。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环;95 ℃变性15 s,60 ℃退火1 min,95 ℃变性15 s。内参基因均选用β-actin,引物序列见表1,采用2-△△Ct法计算mRNA的相对表达量,每组4个样本,每个样本重复3次。

表1 RT-qPCR引物序列
1.2.4免疫荧光染色 将BV2细胞接种于6孔板中的细胞爬片上,用含10 g·L-1的DMEM培养液培养过夜,分别在常氧和低氧条件下处理12 h和24 h,取出细胞爬片用4 g·L-1的多聚甲醛(北京索莱宝科技有限公司)室温固定10 min,PBS洗涤3次;使用含0.2 g·L-1Triton X-100(Sigma公司)的PBS室温破膜30 min,PBS洗涤3次;10%(体积分数)山羊血清(北京索莱宝科技有限公司)室温封闭30 min。标记一抗,抗CD11b鼠克隆抗体-PE(50-0112-U100,Tonbo Biosciences公司)和抗IBA-1兔单克隆抗体(17198,Cell Signaling Technology),按1∶100稀释,避光4 ℃孵育过夜,PBS洗涤3次,标记二抗,羊抗兔IgG-FITC (bs-0295G-FITC,Bioss),使用PBS按1∶200稀释二抗,Hoechst33342按1∶1 000稀释,避光室温孵育30 min,PBS洗涤3次,加入防荧光淬灭封固剂进行封固,每组3个样本,通过研究型荧光正置显微镜(Nikon 80i)观察拍照。
1.2.5线粒体膜电位检测 细胞常氧和低氧分别处理12 h和24 h。阳性对照组为CCCP(终浓度为10 μmol·L-1)加入细胞培养液中,提前处理细胞30 min。收集细胞,缓冲液漂洗细胞1次,加入1 mL罗丹明123(终浓度为5 μmol·L-1),避光37 ℃孵育30 min,离心后弃上清,缓冲液漂洗细胞1次,加入500 μL缓冲液重悬细胞,使用流式细胞仪进行检测。
1.2.6蛋白质印迹(Western blot,WB) BV2细胞分别常氧和低氧处理12 h和24 h,收集细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA细胞裂解液,使用超声波细胞粉碎机破碎细胞,16 000 g 4 ℃离心20 min,收集上清,用BCA蛋白浓度测定试剂盒测定蛋白浓度,取等量蛋白进行电泳,转印至NC膜上,脱脂牛奶室温封闭2 h,TBST缓冲液洗涤3次,每次10 min,一抗PFKP、TPI1、PGK1按1∶1 000稀释后4 ℃孵育过夜,TBST缓冲液洗涤3次,每次10 min,二抗羊抗兔IgG-HRP、羊抗鼠IgG-HRP按1∶5 000稀释后室温孵育2 h,TBST缓冲液洗涤3次,使用ECL双敏化学发光试剂和化学发光仪检测蛋白表达。
1.2.7转录组测序分析 每个实验分组均设置3个生物学重复,总RNA的提取、质检及文库的构建由武汉华大科技有限公司完成,使用BGISEQ-500平台进行转录组测序,然后以FASTQ格式输出原始数据,用Trimmomatic软件将低质量、接头污染以及未知碱基N含量过高的reads去除,得到高质量序列,使用HISAT软件将高质量序列比对到NCBI参考基因组序列(GCF_000001635.26_GRCm38.p6),使用Bowtie2软件将高质量序列比对到NCBI参考基因组序列(GCF_000001635.26_GRCm38.p6),获得转录本并计算其表达量,即每千个碱基的转录每百万映射读取的片段(fragments per kilobase of transcript per million mapped reads,FPKM,即在每百万个reads值中,来自某基因每千个碱基长度的reads值)。以Pearson相关系数表示相同处理样本间基因表达模式的相关性。使用R软件的Pheatmap包对常氧组和低氧组进行差异表达分析,显著差异表达基因(differentially expressed genes,DEGs)的筛选标准为|log2FC(fold change)| ≥1且Q≤0.05。采用华大基因多组学Dr.Tom系统进行DEGs数量统计,并对DEGs进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析和基因本体(gene ontology,GO)功能注释分析,用STRING数据库和Cytoscape软件进行蛋白质相互作用网络(protein-protein interaction network,PPI)分析,其中节点大小、颜色深浅代表该基因权重的高低,节点越大、颜色越深代表权重越高。
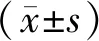
2 结果
2.1 低氧可诱导BV2细胞活化CD11b抗体用于鉴定小胶质细胞,IBA-1抗体用于鉴定小胶质细胞的活化。在BV2细胞中,常氧组和低氧组CD11b均染色阳性,常氧组IBA-1染色阴性,低氧组IBA-1染色阳性,如图1所示,表明低氧处理可使BV2细胞活化。

蓝色代表Hoechst33342染色的细胞核,红色代表CD11b标记的细胞,绿色代表IBA-1标记的细胞,400×,n=3。
2.2 低氧对小胶质细胞线粒体膜电位的影响为了确定低氧处理BV2细胞后是否引起线粒体膜电位变化,使用罗丹明123染色并进行流式分析,常氧组12 h和低氧组12 h、常氧组12 h和常氧组24 h线粒体膜电位相比,差异无统计学意义(P>0.05);常氧组24 h和低氧组24 h、低氧组12 h和低氧组24 h线粒体膜电位相比,差异有统计学意义(P<0.05)。见图2。
A为低氧12 h组与常氧12 h组、低氧24 h组与常氧24 h组的线粒体膜电位相对表达水平比较;B为常氧24 h组与常氧12 h组、低氧24 h组与低氧12 h组的线粒体膜电位相对表达水平比较;*P<0.05。
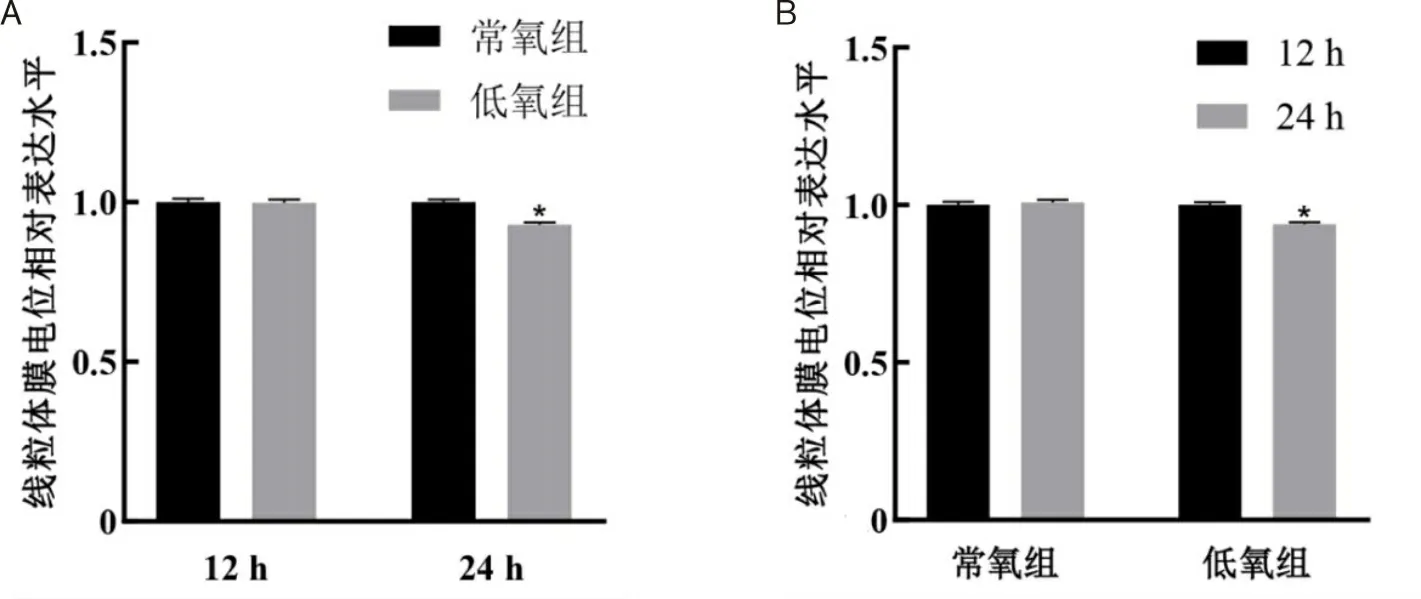
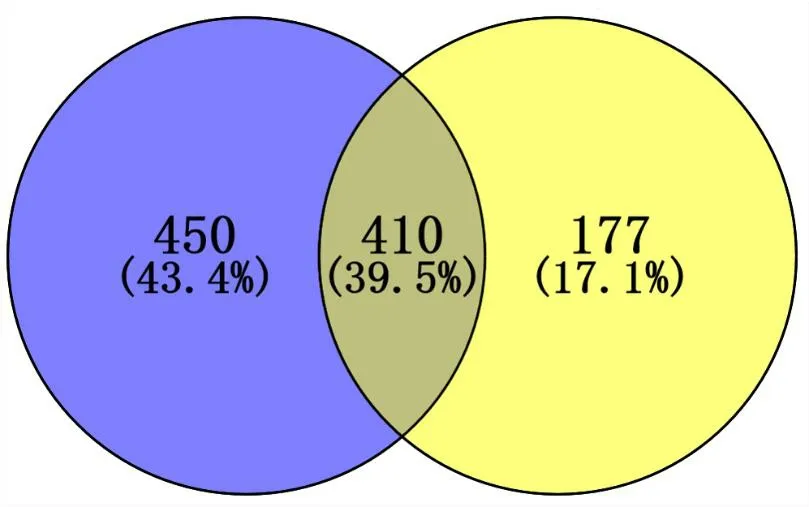
2.3 低氧处理12 h和24 h的差异基因表达分析BV2细胞分别在21% O2(体积分数)和1% O2(体积分数)条件下培养12 h和24 h,收集细胞样本进行转录组测序,以|log2FC|≥1,Q≤0.05为标准进行显著DEGs筛选,1% O2(体积分数)处理BV2细胞12 h共筛选860个显著DEGs,有672个上调基因,188个下调基因。1% O2(体积分数)处理BV2细胞24 h共筛选587个显著DEGs,其中498个上调基因,89个下调基因。使用Venn图比较两组显著DEGs,结果显示12 h和24 h显著DEGs中有410个基因相同,在369个共同上调基因中,低氧处理24 h与低氧处理12 h相比,表达增加的基因有109个,其余260个基因表达下降;在41个共同下调基因中,有9个基因表达增加,32个基因表达下降(图3)。通过火山图展示DEGs的分布(图4)。通过聚类热图分析显著DEGs变化(图5)。
蓝色表示低氧处理12 h后显著DEGs,黄色表示低氧处理24 h后显著DEGs,交叉部分表示低氧处理12 h和24 h显著DEGs中的相同基因。
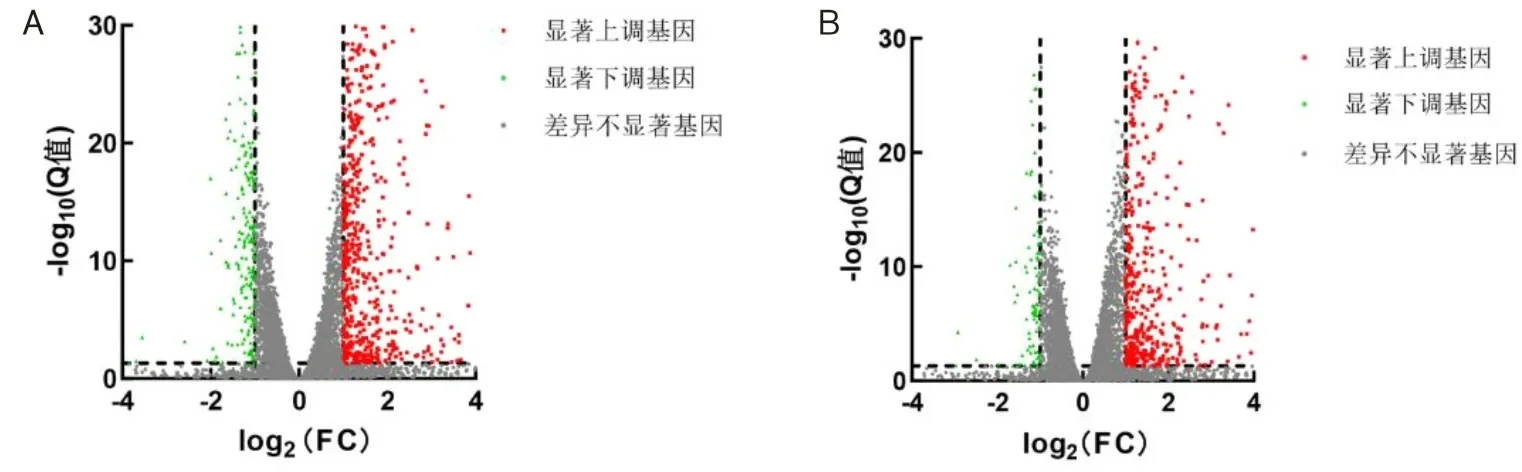
A为12 h DEGs火山图;B为24 h DEGs火山图;红色点代表显著上调基因,绿色点代表显著下调基因,灰色点代表差异不显著的基因。
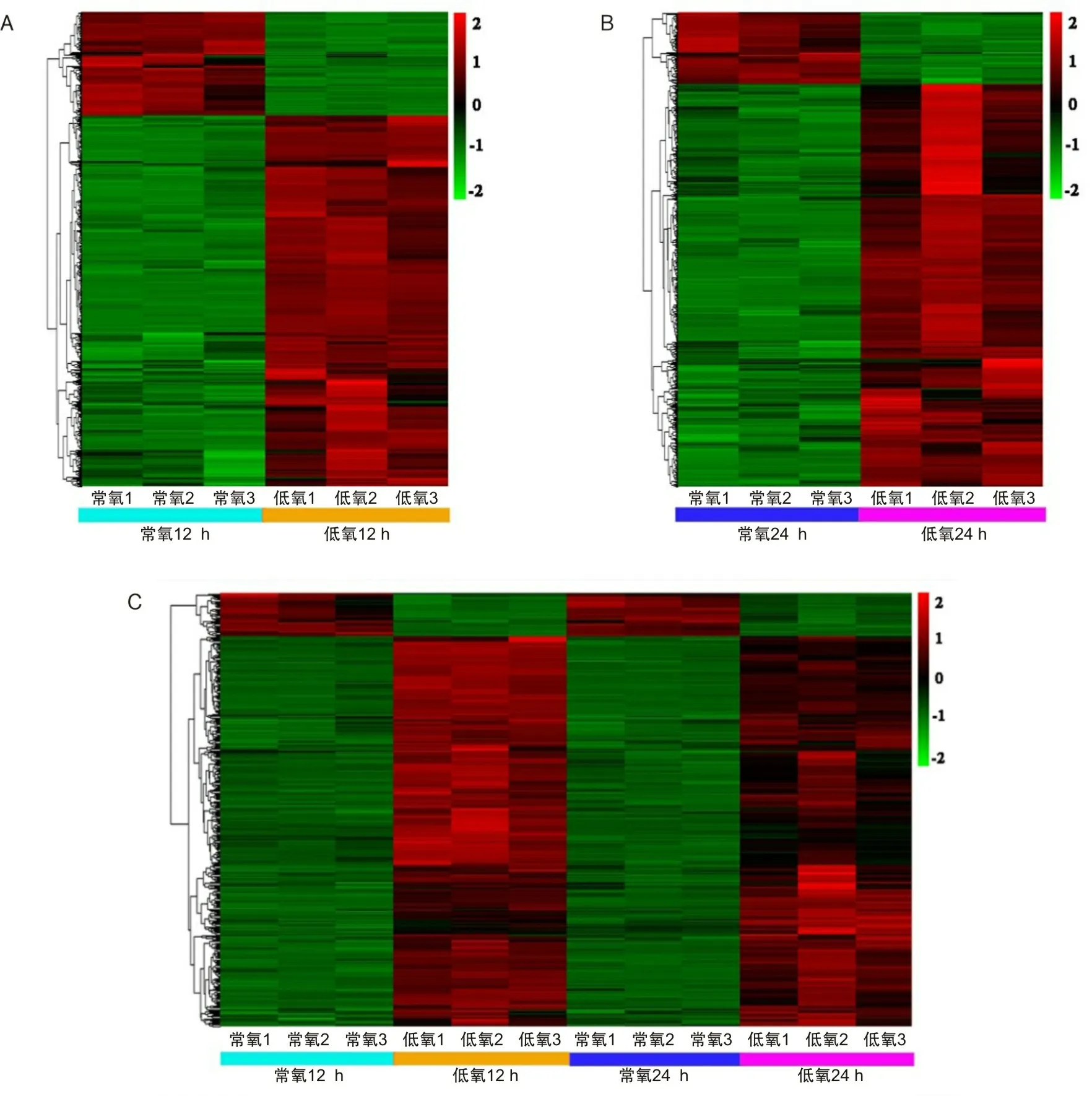
A为12 h DEGs聚类热图;B为24 h DEGs聚类热图;C为低氧处理12 h和24 h的410个DEGs聚类热图;红色代表表达上调基因,颜色越深,表达越高;绿色代表表达下调基因,颜色越深,表达越低。
2.4 低氧处理12 h和24 h DEGs的GO功能注释分析对DEGs进行GO生物进程分析发现,低氧12 h组与常氧12 h组相比,低氧24 h组与常氧24 h组相比,上调DEGs均显著富集在细胞对低氧的反应、糖酵解过程、转化生长因子β信号通路等方面,下调DEGs均显著富集在细胞对DNA损伤刺激的反应、DNA修复、细胞周期等方面。常氧24 h组与常氧12 h组相比,上调DEGs未显著富集到GO条目,下调DEGs显著富集在抗坏血酸稳态、神经递质摄取的负调控、5-羟色胺摄取的调控等方面。低氧24 h组与低氧12 h组相比,上调DEGs显著富集在长链脂肪酸代谢过程、有机酸生物合成过程、异生物分解代谢过程等方面,下调DEGs显著富集在调节生长递质摄取、螯合钙离子、神经递质的再摄取等方面(图6)。

A为低氧12 h组与常氧12 h组DEGs GO功能富集分析;B为低氧24 h组与常氧24 h组DEGs GO功能富集分析;C为常氧24 h组与常氧12 h组DEGs GO功能富集分析;D为低氧24 h组与低氧12 h组DEGs GO功能富集分析;柱状图高度代表GO的富集程度,柱状图越高代表Q值越小,富集程度越高。
2.5 低氧处理12 h和24 h DEGs的KEGG富集分析对低氧12 h组与常氧12 h组DEGs进行KEGG富集分析发现,上调DEGs显著富集在HIF-1α信号通路、Rap1信号通路、Jak-STAT信号通路、糖酵解/糖异生、果糖和甘露糖代谢、淀粉和蔗糖代谢等代谢进程,下调DEGs显著富集在细胞周期、同源重组、DNA复制等进程。对低氧24 h组与常氧24 h组DEGs进行KEGG富集分析发现,上调DEGs显著富集在HIF-1α信号通路、TGF-β信号通路糖酵解/糖异生、磷酸戊糖途径、果糖和甘露糖代谢、淀粉和蔗糖代谢、花生四烯酸等代谢进程,下调DEGs显著富集在细胞周期、同源重组、Fanconi贫血通路等进程(图7)。常氧24 h组与常氧12 h组、低氧24 h组与低氧12 h组因DEGs较少,富集的KEGG通路也较少。
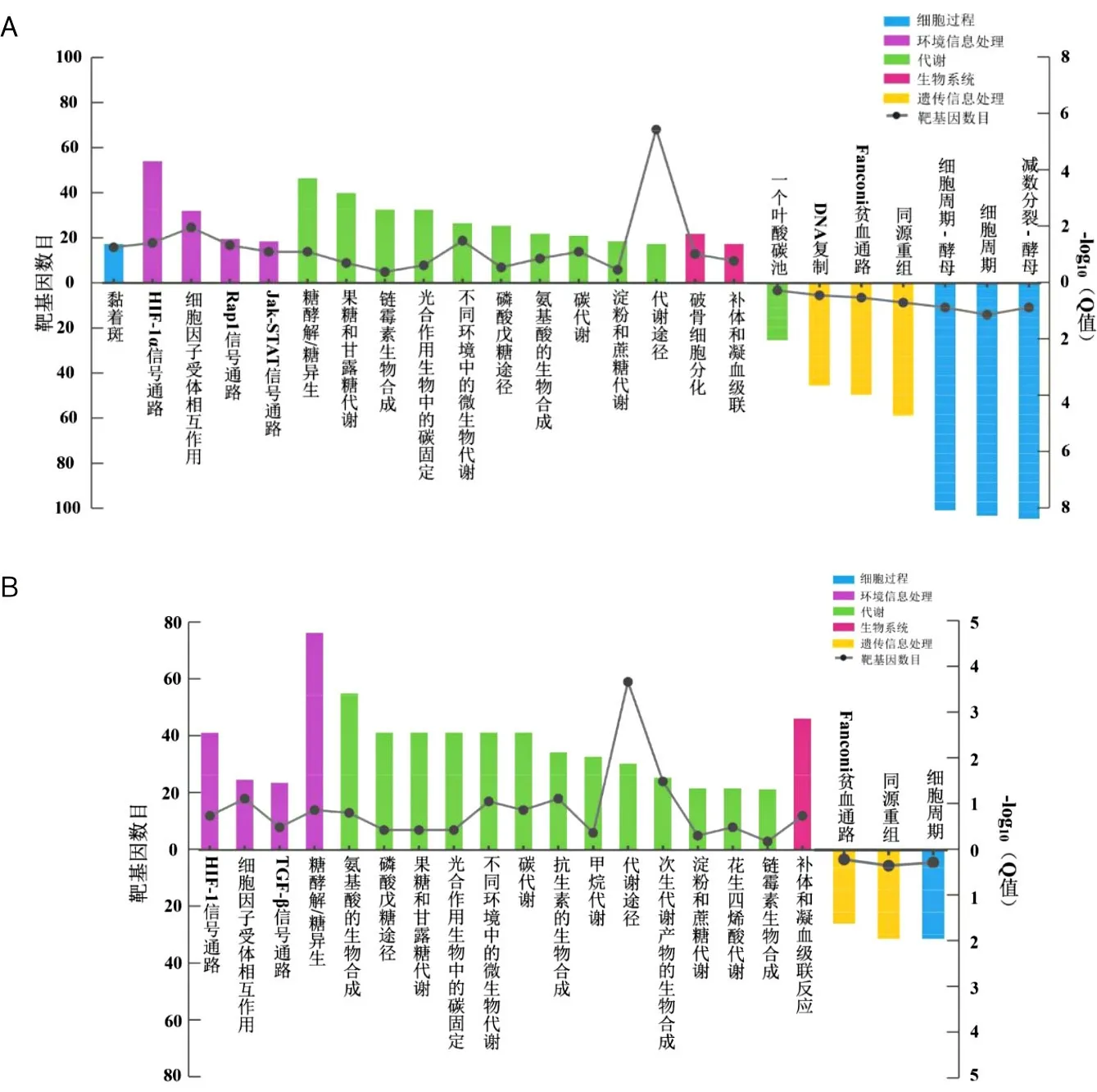
A为低氧12 h组与常氧12 h组DEGs KEGG分析;B为低氧24 h组与常氧24 h组DEGs KEGG分析;横线上方表示显著上调基因富集的KEGG通路,横线下方表示显著下调基因富集的KEGG通路;柱状图代表KEGG富集程度,柱状图越高代表Q值越小,富集程度越高;折线图代表KEGG通路对应的靶基因数目,越高代表靶基因越多。
2.6 低氧处理12 h和24 h的410个相同显著DEGs的基因PPI分析将410个相同显著DEGs通过STRING数据库和Cytoscape软件绘制PPI网络图,见图8。本研究经KEGG富集分析发现低氧对BV2细胞基因表达的调控与代谢相关通路关联的可能性大,见图9。
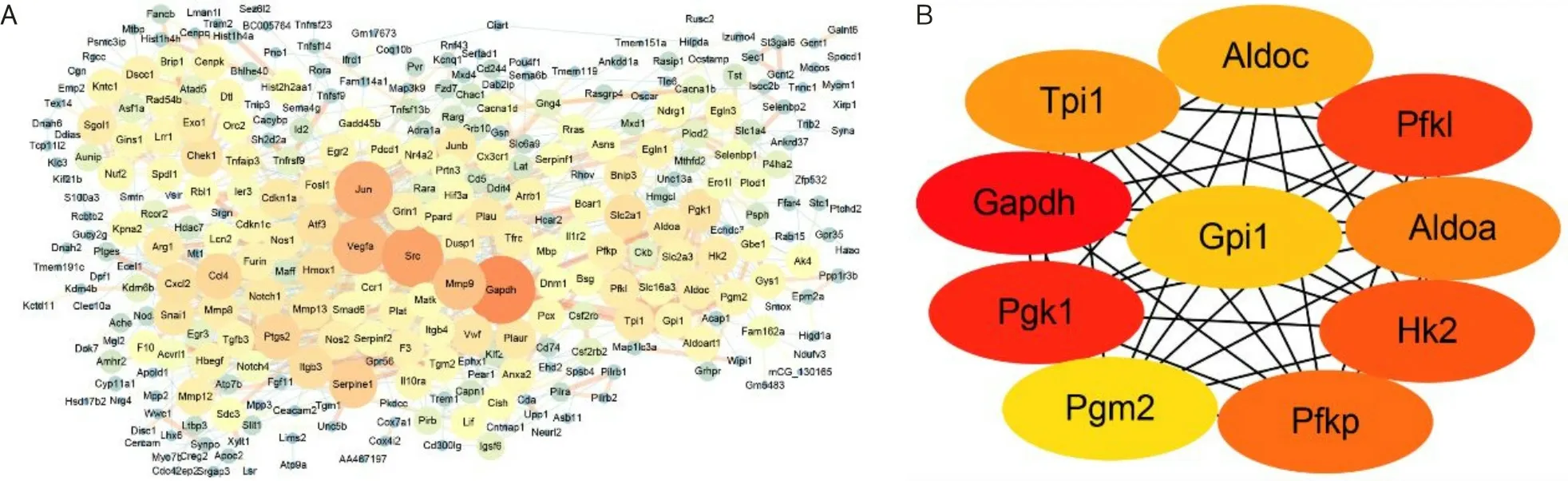
A为低氧处理12 h和24 h的410个相同显著DEGs的PPI图;B为富集程度排名前10的基因;节点越大,颜色越深,表示与其关联靶基因数目越多。

A为代谢相关基因的PPI图;B为富集程度排名前10的基因;菱形表示代谢通路,节点越大,表示包含的靶基因数目越多;圆形表示靶基因,节点越大,颜色越深,表示与其关联靶基因数目越多,其中红色表示上调基因,绿色表示下调基因。
2.7 低氧处理后与代谢相关基因的蛋白表达变化为了确定低氧处理后是否引起代谢相关基因编码的蛋白质发生变化,需进行蛋白水平验证。常氧24 h组与常氧12 h组、低氧24 h组与低氧12 h组相比,PGK1、PFKP、TPI1蛋白相对表达量变化差异无统计学意义(P>0.05)。低氧12 h组与常氧12 h组、低氧24 h组与常氧24 h组相比,PGK1、PFKP、TPI1蛋白相对表达量升高,差异有统计学意义(P<0.05)。见图10。
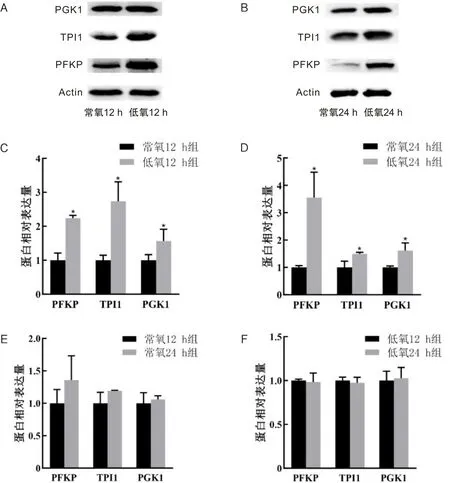
A、B为蛋白表达电泳图;C、D、E和F为蛋白表达柱状图;*P<0.05。
2.8 RT-qPCR验证DEGs低氧分别处理12 h和24 h后,经过高通量测序和生物信息学分析,分别筛选出12 h和24 h低氧组与常氧组的DEGs,经过比对发现12 h和24 h有410个DEGs相同,通过STRING数据库和Cytoscape软件从中筛选出前10个关键基因为GAPDH、PGK1、PFKL、HK2、PFKP、ALDOA、TPI1、ALDOC、GPI1、PGM2。再从410个相同的DEGs中筛选出56个与代谢相关的基因,并通过STRING数据库和Cytoscape软件筛选出前10个关键基因为PFKL、TPI1、PFKP、PGK1、ALDOART1、HK2、GPI1、ALDOA、ALDOC、GAPDH,从2个基因集中筛选出的前10个关键基因有9个是相同的,对其中6个及VEGFA基因进行RT-qPCR以验证测序结果的准确性。RT-qPCR检测结果表明,常氧24 h组与常氧12 h组、低氧24 h组与低氧12 h组相比,PFKP、PGK1、TPI1、PFKL、GPI1、ALDOC、VEGFA表达变化差异无统计学意义(P>0.05);低氧12 h组与常氧12 h组、低氧24 h组与常氧24 h组相比,PFKP、PGK1、TPI1、PFKL、GPI1、ALDOC、VEGFA表达均增加,差异有统计学意义(P<0.05),见图11。此结果与转录组测序结果一致。
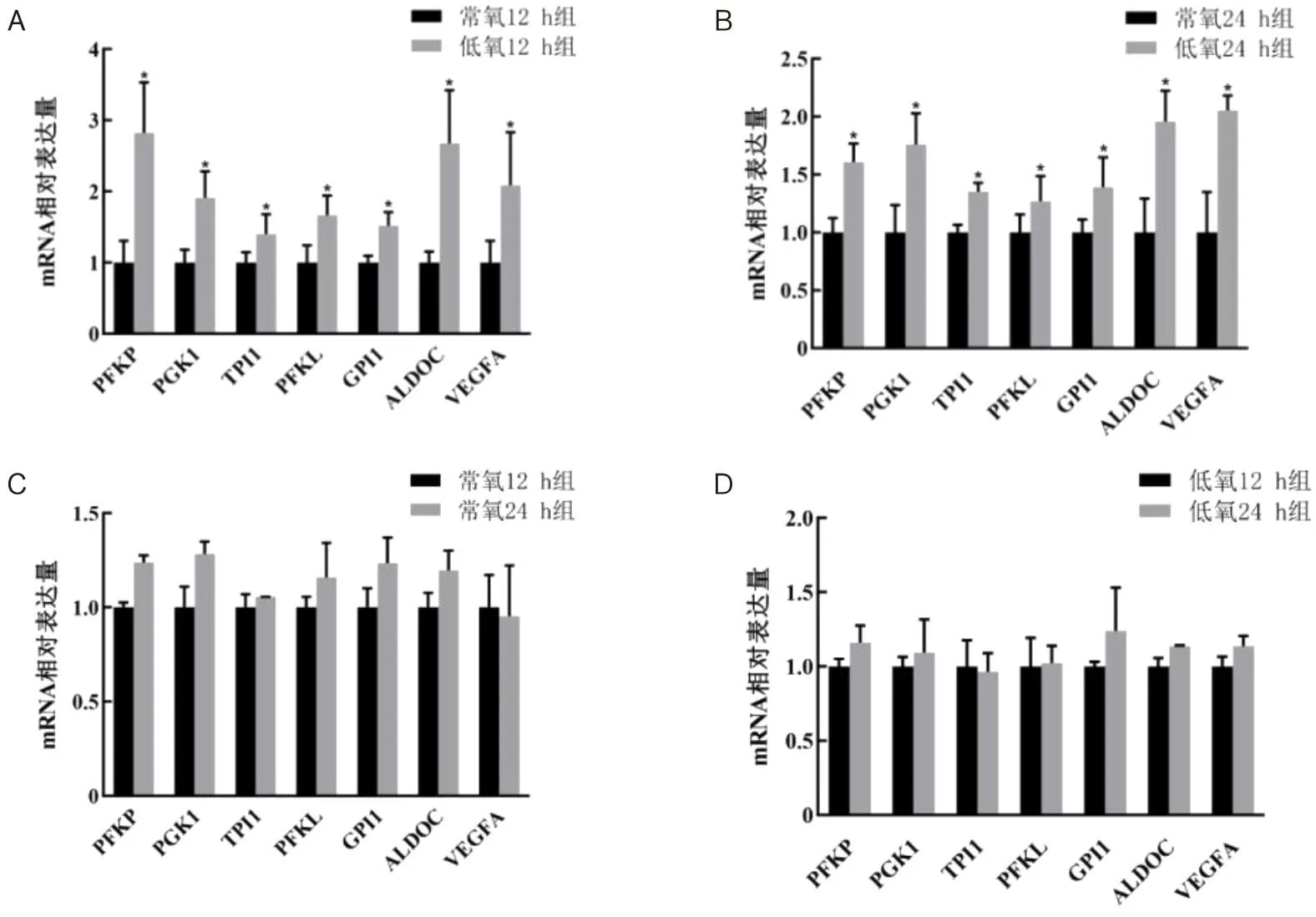
A为低氧12 h组与常氧12 h组DEGs的mRNA相对表达量;B为低氧24 h组与常氧24 h组DEGs的mRNA相对表达量;C为常氧24 h组与常氧12 h组DEGs的mRNA相对表达量;D为低氧24 h组与低氧12 h组DEGs的mRNA相对表达量;*P<0.05。
3 讨论
低氧能够诱导小胶质细胞发生反应,引起ROP或DR等视网膜疾病的神经损伤和新生血管生成,造成不可逆的视力损害。目前治疗这些疾病的方法主要有视网膜激光光凝、玻璃体腔注射抗VEGF药和玻璃体切割手术等,这些方法虽然有一定疗效,但并不能完全控制疾病病情[8-9],因此需要寻找治疗这些视网膜疾病的新靶点和新方法。本研究以小胶质细胞系BV2细胞建立体外低氧模型,通过转录组测序技术研究低氧对BV2细胞的作用机制。
研究表明IBA-1可用于鉴定小胶质细胞的活化[10-11]。文献报道低氧可诱导小胶质细胞活化[12]。本研究结果显示,低氧处理可使BV2细胞IBA-1表达升高,证实了低氧可以诱导小胶质细胞活化。文献中多采用低氧诱导8 h、12 h和24 h进行研究[3,13-14],但本课题组发现低氧诱导8 h显著差异基因极少,因此,本研究采用低氧诱导12 h和24 h进行实验,转录组测序分析结果显示,低氧处理12 h显著差异基因最多,并且表达量最高。因为生物mRNA随时间延长表达活性下降,可能与自由基、酶活性相关[3,14]。研究表明,低氧可损伤线粒体功能,导致活性氧产生、线粒体膜电位降低和代谢改变[15]。本研究结果示低氧处理后小胶质细胞线粒体膜电位下降。缺氧诱导因子1α(hypoxia inducible factor-1,HIF-1α)在缺氧模型中发挥关键的作用,HIF-1α能够调节糖酵解酶,并增强O2及营养物质的运输,从而保护机体免受缺氧损伤[16]。缺氧可诱导HIF-1α表达上调,引起小胶质细胞的活化,进而促进脑缺血后的神经元变性[14]。HIF-1α作为低氧反应基因启动子中的低氧反应元件,通过改善组织氧合、上调靶基因、调节代谢进程从而适应低氧环境。低氧诱导大鼠视网膜小胶质细胞白细胞介素-17表达增加,通过上调VEGFA表达、促进炎症反应而与视网膜新生血管性疾病紧密相关[17]。研究表明TGF-β信号可在视网膜色素上皮细胞中有效激活VEGFA的表达,从而促进视网膜新生血管的生成[18]。KEGG富集分析发现HIF-1、白细胞介素-17和TGF-β信号通路显著富集,表明HIF-1、白细胞介素-17和TGF-β信号通路在低氧诱导小胶质细胞活化中也发挥重要的作用。Rap1可调节各种细胞类型中整合素和其他黏附分子的功能,在细胞迁移、细胞-细胞和细胞-基质相互作用的控制中发挥重要作用[19]。目前关于Rap1信号的研究主要集中其在免疫和造血系统及恶性肿瘤中的作用[20]。但低氧条件下Rap1信号在小胶质细胞中的作用尚未报道,本研究结果示低氧能够诱导小胶质细胞Rap1信号通路激活。
研究表明ITGB3可在低氧时翻译激活[21]。ITGB3还参与肿瘤血管生成、代谢重编程、干细胞维持、免疫调节等进程[22]。本研究结果示低氧处理后ITGB3基因表达上调。ARG1主要参与氨基酸的代谢途径,可通过抑制缺氧缺血诱导的巨噬细胞炎症反应在视网膜损伤进程中起到保护作用[23]。缺氧导致HIF-α表达增加,诱导SLC2A1的表达,转位到细胞膜上以增加对缺氧神经元进行糖酵解的葡萄糖供应[24]。这些基因主要与低氧引起的代谢紊乱有关。
研究表明,在高海拔地区,随着O2水平的下降,ATP的产生从线粒体中氧依赖的氧化磷酸化过程转变为细胞质中氧不依赖的糖酵解过程[25]。本研究发现,低氧处理12 h与24 h有410个相同的DEGs,KEGG富集分析示这些基因主要与代谢通路相关。本研究结果显示PFKL、TPI1、PFKP、PGK1、GPI1、ALDOC在低氧诱导的小胶质细胞中显著高表达。PFKP、PFKL、PGK1可通过调控糖酵解和代谢重编程过程参与多种肿瘤的发生发展[26-27]。研究表明,参与糖酵解的GPI1可能是Th17介导的自身免疫性疾病的良好药物靶点[28]。缺氧动物大脑和骨骼肌中糖酵解酶ALDOC的转录水平升高[29]。低氧处理后HIF-1α信号转导激活,上调下游靶基因VEGFA表达,促进细胞代谢和血管生成[30]。本研究结果显示低氧能够诱导VEGFA表达增加。因此PFKL、TPI1、PFKP、PGK1、GPI1、ALDOC、VEGFA基因均在糖酵解过程中发挥重要作用,其中TPI1还参与糖异生生物进程。本研究也发现PFKL、TPI1、PFKP、PGK1、GPI1、ALDOC主要与低氧诱导的代谢通路相关,可能是诱导小胶质细胞代谢进程紊乱的关键基因,能够作为治疗缺氧性视网膜疾病的关键靶点。
本研究的不足之处:缺血缺氧诱导的视网膜病变发病机制复杂,低氧诱导的细胞模型不能完全模拟体内缺氧情况,还需要进一步体内实验进行验证;只分析了低氧干预后显著DEGs及信号通路的改变,但关键基因及信号通路的功能分析验证仍需进一步实验研究。
综上所述,本研究发现ITGB3、ARG1、SLC2A1基因可能为治疗缺血缺氧性视网膜疾病的潜在靶点,HIF-1、白细胞介素-17、TGF-β、Rap1信号通路及代谢相关通路可能在缺血缺氧性视网膜疾病中发挥关键作用,为治疗缺血缺氧性视网膜疾病的新药研究提供了新的分子机制,因此这些靶向通路和基因的表达有望为缺血缺氧性视网膜疾病带来新的治疗方法,为临床转化研究提供理论基础。

