双相气道正压通气呼吸机联合纳洛酮对老年慢性阻塞性肺疾病合并呼吸衰竭患者的疗效
胡雪,王傲霜
(南阳市第一人民医院 呼吸与危重症医学二科,河南 南阳 473000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)属于慢性消耗性疾病,以老年人多见[1]。该疾病可降低患者肺功能,引起呼吸障碍或呼吸衰竭,从而导致患者氧分压以及二氧化碳分压平衡失调、酸碱度失衡、电解质紊乱等,甚至出现神经递质的改变,最终导致肺性脑病的发生,危及患者的生命健康。因此,及时纠正COPD并发呼吸衰竭,对降低死亡率和改善预后具有积极的意义[2]。临床常规治疗方式为药物治疗,首选药物为纳洛酮。但是由于病程较长,呼吸肌长期紧张,患者可出现营养不良,导致常规药物虽能改善呼吸频率与意识,但是却无法停止肺功能的恶化。双相气道正压通气呼吸机(bi-level positive airway pressure ventilator,BiPAP)可改善患者的肺通气,纠正缺氧状态,可降低肺性脑病的发生风险[3-4]。本文就BiPAP联合纳洛酮对COPD合并呼吸衰竭的治疗效果进行研究。
1 资料与方法
1.1 一般资料选取2016年1月至2019年12月在南阳市第一人民医院治疗的100例老年COPD合并呼吸衰竭患者为研究对象,采用随机数表法将患者分为对照组和观察组,各50例。纳入标准:(1)符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》中相关诊断标准[5];(2)经过临床影像学、肺功能以及疾病史检查确诊为COPD;(3)存在呼吸困难与喘息症状;(4)患者或家属签署知情同意书。排除标准:(1)存在BiPAP使用禁忌证;(2)接受中枢呼吸兴奋类药物治疗;(3)合并严重的肝肾功能衰竭;(4)合并肺大疱、肺气肿以及纵隔气肿等肺部疾病;(4)精神或沟通障碍;(5)存在药物禁忌证;(6)严重心律失常;(7)存在肺栓塞、肺大泡性疾病。对照组年龄53~72岁,平均(61.24±7.49)岁;男27例,女23例;病程1~12 a,平均(5.32±0.87)a;合并Ⅰ型呼吸衰竭29例,Ⅱ型呼吸衰竭21例;平均动脉血氧分压(52.32±3.58)mmHg(1 mmHg=0.133 kPa),平均二氧化碳分压(57.32±4.85)mmHg。观察组年龄52~73岁,平均(60.87±7.55)岁;男26例,女24例;病程2~13 a,平均(5.87±0.91)a;合并Ⅰ型呼吸衰竭28例,Ⅱ型呼吸衰竭22例;平均动脉血氧分压(52.41±3.61)mmHg,平均二氧化碳分压(57.48±4.92)mmHg。两组基线资料差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准。
1.2 治疗方法两组均接受氧气支持、抗感染、化痰等对症治疗。对照组应用盐酸纳洛酮注射液(北京四环制药有限公司,国药准字H20055758)2 mg治疗,溶入9 g·L-1氯化钠注射液50 mL中,加入到微量泵中进行静脉泵注,速度为每小时6 mL,每日2次,疗程为1周[5]。观察组在对照组基础上接受无创通气治疗:采用BiPAP呼吸机,呼吸参数调节为S/T模式,并给予氧气吸入,调节氧流量为每分钟3~5 L,吸气压设置为10~20 cmH2O(1 cmH2O=98.06 Pa),呼气压设置为8~12 cmH2O,维持患者血氧饱和度在90%以上,每日2~4次,每次1~2 h,并根据患者的病情逐渐减少通气时间[6]。
1.3 观察指标(1)肺功能以及动脉血气指标变化情况。采用MSA99型(北京麦邦)肺功能测试仪测定肺活量、深吸气量、残气量以及最大呼气中期流速。治疗前后检测患者动脉血氧分压、二氧化碳分压、pH值。(2)不良反应,包括两组鼻出血、烦躁、困倦、恶心、呕吐情况。
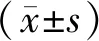
2 结果
2.1 肺功能指标治疗前,两组肺功能差异无统计学意义(P>0.05)。治疗后,两组肺活量、深吸气量、残气量较治疗前均升高,残气量较治疗前降低,且观察组肺活量、深吸气量、残气量、最大呼气中期流速高于对照组,且观察组残气量低于对照组,(P<0.05)。见表1。

表1 两组肺功能指标比较
2.2 动脉血气指标治疗前,两组血气分析值差异无统计学意义(P>0.05)。治疗后,两组动脉血氧分压、pH值较治疗前升高,观察组高于对照组,两组二氧化碳分压较治疗前降低,观察组低于对照组(P<0.05)。见表2。

表2 两组动脉血气指标比较
2.3 不良反应发生情况在治疗过程中,对照组鼻出血1例,恶心呕吐2例、烦躁1例,困倦3例,总发生率为14.00%(7/50)。观察组恶心、呕吐1例,烦躁2例,困倦2例,总发生率为10.00%(5/50)。两组不良反应总发生率差异无统计学意义(χ2=0.379,P=0.538)。
3 讨论
COPD是常见的以持续性气流受限为特征的慢性炎症性疾病[7-8]。老年人随着年龄的增长,呼吸功能明显衰退,即使未患有慢性肺疾病的老年人呼吸中枢的兴奋性也会低于青年人,而COPD患者的呼吸中枢功能储备更小[9-10]。COPD并发呼吸衰竭后,电解质紊乱、酸中毒均可损害呼吸中枢的调控能力,丧失中枢功能。此外,COPD患者合并呼吸衰竭时,其机体处于高应激状态,体内的β-内啡肽被激活并大量释放,该类物质与阿片受体结合,降低脑干神经元对CO2的敏感性,抑制呼吸,导致高碳酸血症的发生[11-12]。因此,及时纠正患者低氧血症、高碳酸血症潴留以及改善肺功能是其主要治疗原则[13-14]。
本研究中,观察组肺活量、深吸气量、残气量、最大呼气中期流速指标均优于对照组;观察组动脉血氧分压、二氧化碳分压、pH值均优于对照组。本研究结果与郑燕冰等[15]研究结果一致。纳洛酮本身无内在活性,但是其化学结构与吗啡相似,是一种人工合成的特异性阿片受体拮抗剂,可通过竞争性拮抗阿片受体相互结合,发挥药理作用。纳洛酮可拮抗β-内啡肽的呼吸抑制作用,改善脑缺氧以及二氧化碳潴留,从而达到解除呼吸抑制,改善意识的目的。同时,纳洛酮通过抗凝物质,降低血液黏稠度,阻止COPD患者肺小动脉血栓的形成,抑制呼吸道腺体的分泌,保证呼吸道的畅通。BiPAP属于非创伤性操作,具有操作简单、安全、成本低等优点,BiPAP可增加肺泡气体量,促使肺部气体分布合理,增加气道以及肺泡内的压力,促进肺间质的吸收与肺泡的渗透,提高气道弥散功能,降低气道阻力,提高肺通气能力,增加呼吸机收缩能力,改善呼吸肌疲劳症状,从而达到降低高碳酸血症、提高PaO2的作用。二者联合使用,具有改善动脉血气指标以及肺功能的作用。由此说明,BiPAP联合纳洛酮可改善肺功能,促进疾病的恢复。
纳洛酮是一种非特异性受体拮抗剂,可迅速通过血脑屏障而发挥药效,解除呼吸抑制,改善大脑皮层供血,对烦躁不安、躁动患者有镇静催眠的效果。而BiPAP属于人工机械通气装置,降低人体呼吸消耗,促进呼吸功能的消耗。本次研究结果显示,在治疗过程中,对照组不良反应发生率为14.00%,观察组不良反应发生率为10.00%。这与包金星等[16]研究结果一致,说明BiPAP联合纳洛酮治疗安全性较高,不良反应少。
综上所述,BiPAP联合纳洛酮治疗老年COPD合并呼吸衰竭患者,有助于肺功能恢复和氧合状态改善。

