视网膜分支静脉阻塞相关黄斑水肿不同治疗方案疗效评价
梁 沛 王 谭 李东辉 陈有信 闵寒毅
视网膜分支静脉阻塞(BRVO)在临床上较为常见,发病率为0.4%~1.2%[1-2],具体发病机制尚未完全明确,动静脉交叉处的压迫与之有一定关系,其相关黄斑水肿(ME)被认为是引起患者视力下降的主要原因[3-4]。对于ME的治疗,传统的方案以黄斑格栅激光光凝为主,然而随着血管内皮生长因子(VEGF)与BRVO相关ME的关系不断被揭示,玻璃体内注射抗VEGF药物常作为BRVO相关ME的首选治疗方案[5],但因抗VEGF药物持续时间短,需玻璃体内重复注射,增加了眼内炎的风险[6],也需引起人们的注意。近几年,地塞米松玻璃体内植入剂被批准用于治疗BRVO相关ME,且起到了很好的临床效果。本文就单纯应用抗VEGF药物和联合应用地塞米松玻璃体内植入剂治疗BRVO相关ME效果进行对比研究。
1 资料与方法
1.1 一般资料回顾性分析2019年3月至2022年3月于北京协和医院眼科诊断为BRVO合并ME的患者102例102眼,所有患者均行最佳矫正视力(BCVA)、眼压、OCT及FFA检查,其中男48例,女54例,年龄31~89(60.48±13.29)岁,病程3~20(8.50±6.62)个月。
1.2 纳入与排除标准纳入标准:(1)主诉视力下降或视物变形,通过OCT及FFA检查确诊为BRVO且伴有ME的患者;(2)每月随访,共随访6个月及以上,随访期间使用与治疗前相同的设备与方法行相关检查者;(3)未接受过玻璃体内注射抗VEGF药物、激素类药物或眼底激光治疗者。排除标准:(1)存在视网膜中央静脉阻塞(CRVO)、糖尿病视网膜病变、年龄相关性黄斑变性等其他影响视力的眼部疾病者;(2)青光眼、眼压异常者;(3)排除有药物注射禁忌证者;(4)3个月内接受任何眼内手术者。
1.3 分组标准根据治疗方法不同分组,A组:单纯玻璃体内注射抗VEGF药物组(治疗期间接受任何一种抗VEGF药物);B组:玻璃体内注射抗VEGF药物联合地塞米松玻璃体内植入剂组(不分先后顺序,治疗期间使用了两种方法)。
1.4 治疗方法玻璃体内注射前3 d及注射后1周使用5 g·L-1左氧氟沙星滴眼液滴眼,每天4次。按常规操作行玻璃体内注射,不同药物使用剂量:康柏西普眼内注射液0.05 mL(0.5 mg),雷珠单抗眼内注射液0.05 mL(0.5 mg),阿柏西普眼内注射液0.05 mL(2 mg),地塞米松玻璃体内植入剂(傲迪适)0.7 mg。注射后包扎术眼4 h,注射1个月后采用“1+PRN(按需治疗)”的治疗方案,根据ME情况决定是否再次注药、是否更换药物及再次注药时间。
1.5 观察指标观察终点为末次注射后,连续3次随访均无视网膜下液,黄斑中心凹厚度(CMT)变化≤50 μm,且CMT≤250 μm。注射后随访6个月及以上,记录玻璃体内注射前、注射后随访期间每个月各组BCVA、眼压、CMT、注药次数及并发症情况。BCVA:采用标准对数视力表检查,结果转换为最小分辨角对数(logMAR)视力进行统计分析。CMT:采用日本拓普康DRI OCT Triton行OCT检查,以黄斑为中心,扫描范围6.0 mm×6.0 mm,ETDRS九分区,计算中央1 mm直径区域视网膜的平均厚度。
1.6 统计方法采用SPSS 19.0统计学软件进行统计分析,BCVA、CMT、注射次数以均数±标准差表示,同组治疗前后比较采用配对样本的t检验,不同组别之间比较采用独立样本t检验。分类变量采用数字和百分比表示,采用卡方检验比较。检验水准:α=0.05。
2 结果
2.1 一般资料分析纳入研究的102眼中,颞上分支静脉阻塞者61眼(59.8%),颞下分支静脉阻塞者29眼(28.4%)。不同年龄组中,≥50岁者83眼(81.4%),合并基础性疾病(高血压、高血脂、糖尿病)者79眼(77.5%)。A、B两组患者间年龄、性别、各指标基线水平差异均无统计学意义(均为P>0.05)(表1)。

表1 A、B两组患者基本情况
2.2 两组患者BCVA、CMT及注药次数分析经治疗后,A、B两组患者BCVA较治疗前均明显改善(均为P=0.00),CMT较治疗前也均明显降低(均为P=0.00),但两组患者间BCVA和CMT在观察终点比较差异均无统计学意义(均为P>0.05)。B组患者玻璃体内平均注药次数较A组减少,差异有统计学意义(P=0.00),且B组患者平均病程较A组缩短,差异有统计学意义(P=0.02)(表2)。
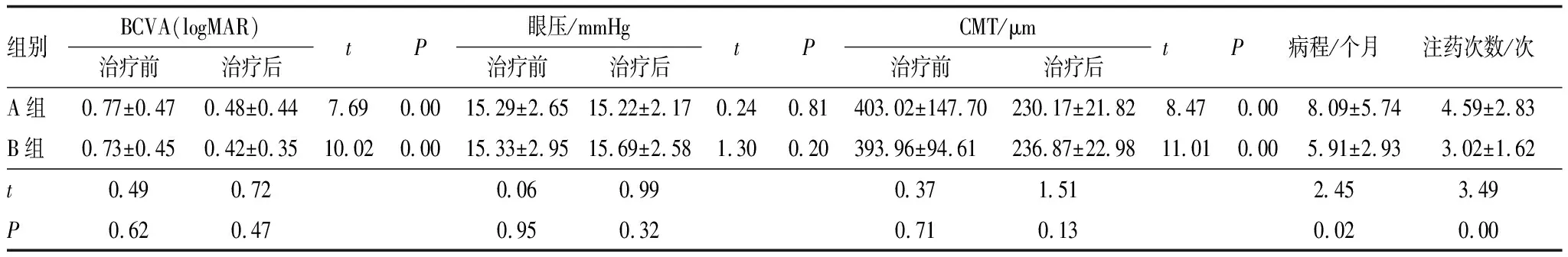
表2 A、B两组患者治疗前后各指标及病程、注药次数比较
2.3 两组患者眼压变化及并发症情况A、B两组患者间观察终点眼压比较差异无统计学意义(表2),但B组患者玻璃体内注射地塞米松植入剂后部分患者出现眼压升高,其中1个月内出现眼压升高至≥25 mmHg的概率为14.6%,且均局部应用降眼压药物后病情平稳。而A组观察期间均未出现明显眼压升高者。观察期内,A组白内障进展行白内障手术者2例(3.7%),B组白内障进展行白内障手术者8例(16.7%),两组相比差异有统计学意义(χ2=4.52,P=0.03)。至随访末期,两组患者均未发生视网膜脱离、玻璃体积血、眼内炎等严重并发症。
3 讨论
视网膜血管阻塞(RVO)是仅次于糖尿病视网膜病变的第二位常见视网膜血管疾病,根据阻塞部位的不同,通常分为CRVO和BRVO,另外,部分学者提出半侧RVO和黄斑分支静脉阻塞,根据是否缺血又分为缺血型和非缺血型。其中BRVO发病率较高,一项关于多种族、多地区的RVO的荟萃分析结果表明,RVO的发病率为0.520%,而BRVO发病率为0.442%[1]。BRVO血管阻塞部位在颞上象限者最常见,其次为位于颞下象限者,位于鼻侧象限者罕见[7]。一项关于218例RVO患者的研究中,BRVO占71.1%,其中颞上分支静脉阻塞占63.9%[8],这可能与该象限动静脉交叉较其他象限多有关。本研究102眼中,颞上分支阻塞者61眼,占59.8%,与之前的研究大致相同。
BRVO病因复杂,目前发病机制尚未完全明确。其危险因素包括全身及眼部相关疾病,如高血压、高血脂、糖尿病、高龄、心血管风险因素、凝血异常、青光眼及远视等[2]。本研究中存在高血压、高血脂或糖尿病的患者共占77.5%,年龄≥50岁者占81.4%,可见临床上存在基础疾病的老年患者应警惕BRVO的发生。BRVO临床表现有相应血管迂曲扩张,血管旁视网膜浅层火焰状出血,棉絮斑形成,伴视网膜水肿,常累及黄斑,造成ME。另外缺血型BRVO可有大片毛细血管无灌注区,新生血管形成,玻璃体积血及视网膜脱离。ME和视网膜下液为患者视力下降的主要原因[9]。
临床上除治疗诱发BRVO存在的高风险疾病外,主要是针对BRVO相关ME的治疗。缺血区局部播散激光光凝可阻止新生血管和玻璃体积血的发生[10],而针对ME的黄斑格栅光凝[11],可以使视网膜血管氧合增加,导致血管收缩和缩短,降低血管内压力,从而减少水肿的形成[12]。但部分学者认为应仅在非缺血区出现新生血管时给予视网膜光凝,因为过早的激光治疗可引起视野的损伤[13]。视网膜缺血、缺氧与VEGF水平相关,VEGF上调可使血管通透性增加,血-视网膜屏障破坏,导致血管渗出和ME形成[14-15]。因此,玻璃体内注射抗VEGF药物,如雷珠单抗[16]、贝伐单抗[17]、阿柏西普[18]及康柏西普[19]得到普遍应用,美国眼科学会及欧洲视网膜专家协会也强调了抗VEGF药物在治疗BRVO相关ME中的重要性[20-21]。与激光相比,抗VEGF药物在治疗BRVO相关ME时更有优势[22],但大约50%的BRVO患者在抗VEGF治疗4年后,仍需要注射抗VEGF药物以控制ME[23]。一些患者经抗VEGF药物治疗后,ME并不能完全消退,可能原因为多种促炎因子,如白细胞介素-6、单核细胞趋化蛋白-1、可溶性细胞间黏附分子-1等在ME发生中起着重要作用[24-26]。
糖皮质激素具有抗炎和调节免疫作用,临床应用玻璃体内注射曲安奈德治疗BRVO相关ME起到了一定的效果,但玻璃体内注射曲安奈德的剂量和次数不能完全统一,且高眼压和白内障发生率更高[27-28]。地塞米松玻璃体内植入剂能够缓慢释放、更久维持,0.7 mg地塞米松玻璃体内植入剂有很好的安全性,也起到了很好的临床效果[29-30]。SHASTA研究中,地塞米松玻璃体内植入剂治疗患者的平均间隔时间可长达5.8个月[31]。另外,人们在联合治疗方面也不断尝试,如眼底激光联合贝伐单抗较单纯激光治疗能更好地改善视力[32],且能减少玻璃体内注射贝伐单抗的次数[33]。玻璃体内注射雷珠单抗联合阈值下微脉冲激光能减少雷珠单抗注射次数[34]。玻璃体内注射地塞米松植入剂后再注射贝伐单抗较单纯注射贝伐单抗能更快地获得视力改善和ME消退[35]。也有研究证明,贝伐单抗与地塞米松玻璃体内植入剂联合注射具有一定的协同作用[36]。本研究中,抗VEGF联合地塞米松玻璃体内植入剂治疗的患者较单纯抗VEGF治疗的患者玻璃体内注药次数明显减少,且病程缩短,也说明联合治疗存在一定优势。
玻璃体内注射抗VEGF药物和地塞米松玻璃体内植入剂在治疗BRVO相关ME时各有优势,雷珠单抗3+PRN注射和单次地塞米松玻璃体内注射剂注射比较,前3个月在改善视力上无明显差异,但3个月后雷珠单抗治疗显示出优势,因此,根据临床情况,3个月后可考虑再次注射地塞米松玻璃体内植入剂[37]。地塞米松玻璃体内植入剂注射次数少,费用相对较低,但应注意激素引起的高眼压与白内障的风险[38-40]。本研究中玻璃体内注射地塞米松植入剂后部分患者出现眼压升高,其中1个月内出现眼压升高至≥25 mmHg的概率为14.6%,且观察期内玻璃体内注射地塞米松植入剂组因白内障进展行白内障手术比例较单纯注射抗VEGF药物组明显升高。通常眼压升高是短暂的,大部分可通过降眼压药物控制,但注射后仍需要密切关注眼压变化。
临床上治疗BRVO相关ME时,抗VEGF药物常作为首选,但频繁的眼内注射会增加患者的经济负担和心理压力,另外BRVO患者多合并高血压、糖尿病、冠心病等慢性疾病,患者在眼部获益的同时,可能增加心血管疾病患病风险[41],因此需权衡利弊。临床上地塞米松玻璃体内植入剂注射间隔多为3个月,虽存在加速白内障进展及眼压升高风险,但在一些重复注射抗VEGF药物反应不明显者或人工晶状体眼及无激素性青光眼者可选择地塞米松玻璃体内植入剂治疗。
本回顾性研究结果表明,单纯玻璃体内注射抗VEGF药物和联合应用地塞米松玻璃体内植入剂治疗BRVO相关ME均能起到很好的临床效果,且观察期间联合应用地塞米松玻璃体内植入剂可减少注药次数。本研究存在一定不足,如未对不同抗VEGF药物进行单独分类比较,且未对不同抗VEGF药物及地塞米松玻璃体内植入剂之间转换应用的条件详细比较,而且研究例数有限,观察时间较短。随着科学技术的进步,人们在治疗BRVO相关ME方面有了更多的选择,希望以后能通过多中心、大样本、长期、随机对照试验的进一步研究,为患者提供更好的治疗依据。

