肿瘤来源的外泌体PD-L1在肿瘤中的研究进展
杜晓月,温少迪,沈波
外泌体是由多种细胞通过内吞、融合以及外排等一系列生物作用后形成的、直径30~150 nm的细胞外囊泡。这种内部包裹核酸、脂质、小分子代谢产物,外部携带不同类型表面蛋白的胞外囊泡广泛分布于体液中,它们在体液中自由循环,介导细胞间的物质传递与信息交流[1]。
根据外泌体传递信号途径的不同,将其发挥作用的方式分为:①外泌体膜表面的配体与靶细胞的受体直接结合激活细胞内信号通路[2];②外泌体膜通过与靶细胞膜相融合进而将其内容物释放入靶细胞胞内实现信号传递[3];③外泌体释放胞内信号分子与靶细胞直接结合发挥作用[4]。外泌体来源和形成方式的不同使其具有高度异质性,再加上其发挥作用途径的多样性,使其能够诱导复杂的生物学反应。既往研究聚焦于外泌体对肿瘤细胞或肿瘤微环境的直接作用:肿瘤血管生成[5]、肿瘤侵袭转移[6-7]、肿瘤细胞增殖[8]、介导肿瘤细胞耐药[9]等。目前,越来越多的学者将研究聚焦于外泌体对肿瘤免疫治疗的影响,尤其是对程序性死亡受体1(programmed death-1,PD-1)/程序性死亡配体1(programmed death ligand 1,PD-L1)信号通路的影响。免疫系统的稳定是机体发挥抗肿瘤作用的前提,PD-L1这种抑制性信号分子在免疫调节中发挥重要作用。PD-L1表达于包括肿瘤细胞在内的多种细胞表面,在与其受体PD-1结合后可使细胞毒性T细胞的活动受到抑制,促使肿瘤细胞逃避免疫系统监视。研究发现PD-L1也存在于外泌体膜上,并且可能是免疫治疗抵抗的可能机制之一。由此,肿瘤细胞来源的外泌体(tumor-derived exosomes, TEX)以及其表达的PD-L1在肿瘤发展与治疗中扮演的角色以及在不同肿瘤中的作用引起研究者们的深思。
1 外泌体PD-L1的检测手段
外泌体PD-L1的表达水平与肿瘤的分期、免疫治疗的反应性、肿瘤患者的存活率相关[10-11]。作为预测肿瘤进展和治疗反应性的潜在标志物,外泌体PD-L1快速、精确的定量分析至关重要。外泌体体积小、分布广且异质性高,因此对检测手段的要求严格,目前仍缺乏公认的有效检测手段[12]。酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)是外泌体PD-L1经典的检测手段,该方法利用抗原抗体特异性结合免疫反应对目标外泌体进行定性定量检测,但其对外泌体PD-L1的表达量有一定要求,具有局限性[13]。利用新型PD-L1蛋白适体与外泌体PD-L1形成复合物进而进行荧光定量分析的HOLMES-Exo PD-L1法,相比于传统的ELISA法,所需样本量更少,灵敏度更高,是外泌体PD-L1检测手段的重要补充[14]。表面等离子共振分析法(SPR)是利用表面等离子生物传感器对贵金属-外泌体复合物所产生的独特等离子信号进行外泌体PD-L1定量分析,此方法可在无荧光标记下进行,提高效率的同时节约了检测成本[15-16]。现有的检测手段各有优势和劣势,尚需大规模的研究验证上述技术的可靠性[13-18],表1。同时,在保证快速、精准、动态的前提下,低成本的检测出外泌体PD-L1是未来检测技术发展的方向之一。
2 肿瘤细胞可释放有PD-L1的外泌体
免疫治疗是通过阻断肿瘤细胞表面PD-L1与T细胞表面PD-1之间的作用来恢复T细胞对肿瘤细胞的杀伤能力[19]。然而,在免疫治疗的临床应用过程中,不同患者及不同肿瘤类型之间免疫治疗疗效差异显著,产生这种差异的机制尚不明确,因此及早识别免疫治疗应答者和无应答者至关重要。肿瘤组织来源的PD-L1的表达水平是指导免疫治疗可靠标志物之一,但由于肿瘤组织PD-L1表达具有异质性和动态性,指导治疗方面存在一定局限性[13]。外泌体具有良好的稳定性且含量丰富,肿瘤患者外泌体的含量约是健康人的2倍,提示肿瘤细胞是外泌体活跃的生产者,但外泌体产生增加的根本原因仍未知[20]。为了明确肿瘤来源的外泌体是否表达PD-L1,研究者对PD-L1表达或PD-L1敲除(PD-L1KO)的人乳腺癌细胞(MDA-MB-231)和小鼠乳腺肿瘤细胞(4T1)培养的上清中的外泌体分别进行检测,在表达PD-L1的细胞培养上清中,研究者检测到了外泌体标志蛋白CD63、CD81和PD-L1的表达;与其不同的是,在PD-L1KO的细胞培养上清中,只检测到CD63和CD81的表达。此外,研究者利用免疫荧光技术和免疫组织化学染色证明了CD63和PD-L1在外泌体释放的前体形式多囊泡体中共同存在,这些发现都说明了外泌体上表达PD-L1[21]。目前认为,PD-L1通过内体途径表达于外泌体膜表面(图1A),质膜内陷包裹着胞外液体成分以及包括PD-L1在内的表面蛋白通过内吞作用进入细胞内,在胞内进行一系列的融合与物质交换后,最终外泌体PD-L1以胞吐的形式被释放到细胞外,跟随体液自由循环并积累,从而在机体局部和远处部位发挥作用[1]。
3 外泌体PD-L1的免疫抑制作用
3.1 外泌体PD-L1促进免疫逃逸的机制 肿瘤细胞表面PD-L1协助细胞免疫逃逸,学者们对“外泌体PD-L1是否通过诱导局部或全身免疫抑制来促进肿瘤进展”这一问题展开研究。在对40例头颈部鳞状细胞癌患者的血浆中外泌体PD-L1进行分析后,研究者发现外泌体PD-L1水平与患者的疾病活动性、分期和淋巴结状况相关(P<0.05),阻断外泌体PD-L1与T细胞表面的PD-1之间的作用后,免疫抑制状态也相应的减弱[22]。同样,Blelloch等[10]指出,肿瘤来源的外泌体PD-L1可抑制引流淋巴结T细胞的活化,成为肿瘤发展的主要调控因子,并且由于单个肿瘤细胞能够分泌多个外泌体,其抑制作用可导致长期的全身抗肿瘤免疫。
随着研究的深入,目前认为外泌体PD-L1主要通过以下方式发挥全身免疫抑制作用:一是直接作用,即内源性外泌体PD-L1免疫抑制作用(图1B)。外泌体PD-L1与细胞表面PD-L1具有相同的膜拓扑结构[13],外泌体PD-L1可直接结合PD-1诱导免疫抑制表型,从而抑制毒性T细胞的功能,使肿瘤免疫逃逸[11]。二是间接作用,即外泌体诱导PD-L1表达增高后产生的免疫抑制作用(图 1C)。外泌体通过Toll样受体驱动PD-L1在PD-L1表达阴性的细胞上表达,利用一种替代的间接机制发挥免疫抑制功能。Yang等[21]向外泌体PD-L1KO的实验鼠体内分别注射了乳腺癌小鼠来源的PD-L1表达阴性和阳性的外泌体,5 d后在注射外泌体PD-L1阳性的实验鼠体内检测到了PD-L1的转移,说明了外泌体具有诱导PD-L1低表达或不表达的细胞获得PD-L1的能力。目前研究认为,细胞外部刺激可促进部分细胞向肿瘤表型发展,往往以PD-L1表达上调以及免疫抑制为特点。然而,PD-L1表达增加的确切机制仍有待阐明,也是未来研究的目标。
另外,外泌体PD-L1对免疫系统的影响可能是导致免疫治疗耐药的原因之一。外泌体PD-L1不仅可与效应T细胞表面的PD-1结合,还可以与抗PD-L1单克隆抗体结合使肿瘤细胞表面的PD-L1得以暴露,这两种情况都可否定抗体对PD-L1的封闭作用,从而使PD-L1介导的免疫抑制持续存在[11]。
3.2 外泌体PD-L1对肿瘤免疫状态的影响 外泌体PD-L1可通过抑制淋巴细胞活性、抑制细胞因子的分泌、诱导局部及全身免疫抑制等方式发挥免疫抑制作用,促进肿瘤增长[10]。研究者向PD-L1敲除的黑色素瘤小鼠模型中外源性引入黑色素瘤来源的外泌体后,肿瘤浸润的CD8+T淋巴细胞数量以及脾脏和淋巴结中淋巴细胞的增殖比例均降低[13]。Yang等[21]向敲除PD-L1的乳腺癌小鼠模型中外源性引入乳腺癌来源的外泌体PD-L1后监测实验鼠肿瘤生长情况,结果显示注射外泌体PD-L1的小鼠肿瘤生长高于对照组,且T细胞的活性受到抑制。前列腺癌的研究中同样有外泌体PD-L1抑制引流淋巴结中T细胞的活化的现象[10]。外泌体PD-L1通过抑制T淋巴细胞的活性影响其杀伤作用,研究发现外泌体PD-L1对淋巴细胞的耗竭为暂时性,提示预先干预外泌体PD-L1在转移过程中对肿瘤特异性CD8+T细胞耗竭的诱导作用有利于恢复机体抗肿瘤作用,提示靶向外泌体PD-L1是实现精准医疗的潜在途径[23]。
4 外泌体PD-L1作为生物标志物的潜在价值
4.1 外泌体PD-L1作为肿瘤诊断及疾病进展的生物标志物 外泌体PD-L1作为外周血衍生物,可作为肿瘤标志物,与组织检查相比,具有侵入性小且可重复性高等优势。近年来研究发现,外泌体PD-L1水平与肿瘤的发展密切相关,且PD-L1的表达具有异质性和动态性,外泌体PD-L1作为肿瘤标志物很有吸引力[13]。非小细胞肺癌的前瞻性研究中,研究者对85例肺癌患者及27名健康人员血浆外泌体PD-L1水平进行分析,发现肺癌患者外泌体PD-L1的水平高于健康对照组,并且其表达量与肿瘤的大小、淋巴结状态、有无远处转移等临床指标呈正相关[24]。同样,Chen等[13]发现转移性黑色素瘤患者的外泌体PD-L1水平高于健康者。Marine等[25]仅在癌症患者的血液样本中检测到了外泌体PD-L1表达,并且发现肿瘤进展与外泌体PD-L1水平升高相关,为外泌体PD-L1的肿瘤预测作用提供了数据支持。在一项对胃癌患者术前血浆外泌体PD-L1水平与预后关系的回顾性研究中发现,外泌体PD-L1水平与胃癌分期相关,并且高外泌体PD-L1组患者的总生存期降低,外泌体PD-L1是胃癌独立的预后因素[26]。对头颈部鳞状细胞癌的研究表明,外泌体PD-L1的水平与患者的疾病活动、分期及淋巴结状态相关[24]。上述研究表明,外泌体PD-L1对癌症的诊断及进展的预测具有重要意义。表2。
4.2 外泌体PD-L1具有成为免疫治疗反应性生物标志物潜力 免疫治疗已在多种实体瘤获批为一线标准治疗,但由于肿瘤的异质性以及不同个体间肿瘤微环境的差异性,实际应用免疫治疗的患者的临床反应性不同,造成这种差异的具体机制尚不明确,在此研究现状下,早期精准识别免疫应答者和无应答者对治疗至关重要[25]。研究者对入组的黑色素瘤和非小细胞肺癌患者免疫治疗前后的外泌体PD-L1水平进行监测,发现免疫治疗应答者治疗后外泌体PD-L1水平下降[26]。同样,在对46例黑色素瘤患者治疗前后的外泌体PD-L1测定后发现,外泌体PD-L1治疗前后的变化与疾病状态相关,疾病进展者外泌体PD-L1水平升高[27]。Chen等[23]同样认为,免疫治疗前较高水平的外泌体PD-L1与较差的临床结果相关。外泌体具有较好的稳定性,并且在血浆中含量丰富,这些优势使得外泌体PD-L1可作为良好的免疫治疗反应性预测指标[28]。表2。
5 总结与展望
外泌体是细胞间信息交流与物质运输的介质,也是肿瘤微环境的重要组成部分。这种胞外囊泡通过促进肿瘤血管的形成、肿瘤侵袭转移以及抑制免疫系统等方式来影响癌症的发生发展。外泌体PD-L1作为外泌体的形式之一,通过与抑制性受体结合来干扰免疫系统对肿瘤的监视。目前研究认为外泌体PD-L1主要具有以下潜力:①外泌体PD-L1具有预测疾病进展及免疫治疗反应性的潜力[18]。②外泌体PD-L1是免疫治疗的潜在靶标。有学者认为抑制外泌体PD-L1的释放可增加癌症患者从免疫治疗中获益的可能,因此,对于免疫治疗效果不佳的肿瘤类型,免疫治疗联合外泌体PD-L1靶向治疗是潜在的治疗方式,但由于肿瘤微环境的复杂性以及外泌体的异质性,尚需综合评估靶向外泌体PD-L1对机体的影响,从而为外泌体PD-L1药物的开发提供可行依据。然而目前的研究多停留于实验层面来探索外泌体PD-L1变化水平与免疫治疗反应性之间的关系,针对外泌体PD-L1的治疗能否在临床层面为免疫治疗带来突破尚不明确,尚需更多临床干预性研究填补此研究方向的空缺。总体而言,外泌体PD-L1作为新型标志物之一,在预测疾病进展、治疗反应性和作为治疗靶标方面都具有一定的研究前景,期待未来的研究能为肿瘤精准治疗提供新思路。
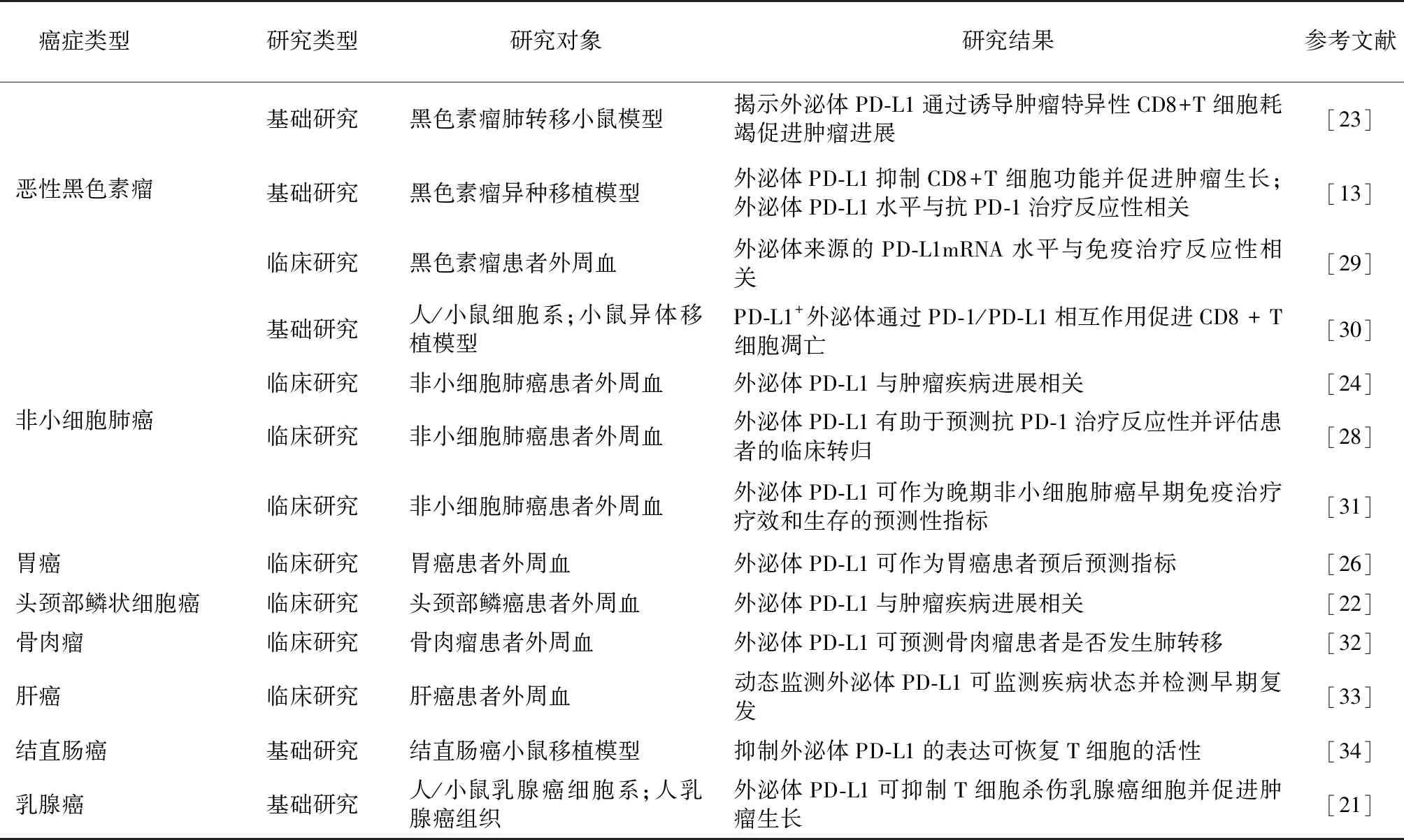
表2 外泌体PD-L1在不同肿瘤中作用的研究

