牙源性双相磷酸钙与两种临床骨替代材料在兔上颌窦中成骨效果的对比研究
杨 刚,刘 鑫,王元银
在种植义齿修复中,如上颌后牙区骨量不足,行种植手术有可能穿通上颌窦壁,现临床上常在上颌窦底壁与黏膜之间植入骨替代材料来增加骨量。磷酸钙陶瓷的应用受到了极大的关注[1],主要是羟基磷灰石(hydroxyapatite, HA)和β-磷酸三钙(β-tricalcium phosphate, β-TCP)[2-3]。HA虽然具有骨传导性,但其生物降解性较低。β-TCP在体内降解速度偏快,不利于引导成骨。因此,由HA和β-TCP组合而成的双相磷酸钙(biphasic calcium phosphate, BCP)陶瓷被开发及应用[4-5]。有研究[6]表明,将牙齿高温煅烧后,可获得双相陶瓷生物骨。人的牙齿的化学组成和主要元素与骨组织相似,已有学者将离体牙烧结制成仿生材料,并检测了其促进细胞成骨分化的能力[7]。但是该材料植入体内后形成新骨的量和质量,以及在上颌窦环境下的骨再生能力,都有待研究。该研究制备了牙源性BCP,并检测其与两种临床常用骨替代材料(Bio-Oss®和CERASORB®M β-TCP骨粉)相比,在兔上颌窦中的骨重建效果差异,为临床治疗提供新的思路和手段。
1 材料与方法
1.1 材料来源收集口腔颌面外科临床拔除的废弃离体牙作为烧结原材料,制作牙源性BCP。以口腔临床上常用的Bio-Oss和β-TCP骨粉作为对照材料。Geistlich Bio-Oss®骨填充材料来自瑞士盖氏制药有限公司,CERASORB®M β-TCP来自德国科卢森公司。
1.2 主要仪器及试剂MXX1600-20箱式高温烧结炉(上海微行炉业有限公司);布鲁克X射线衍射仪D8 advance(德国Bruker公司);瓦里安710-ES电感耦合等离子体发射光谱仪(美国Varian公司);GeminiSEM 300场发射扫描电子显微镜(德国Zeiss公司);SkyScan 1176 Micro-CT(德国Bruker公司);硬组织切片机(上海徕卡仪器有限公司);Eclipse Ci-L正置白光拍照显微镜(日本Nikon公司);PANNORAMIC DESK/MIDI/250/1000全景切片扫描仪(匈牙利3DHISTECH公司);Goldner染液(武汉赛维尔生物科技有限公司)。
1.3 实验动物实验动物为9只雄性新西兰白兔,体质量2.5 kg左右,由安徽医科大学实验动物中心提供。
1.4 材料制备将收集的离体牙去除牙结石、龋坏等,用牙骨锤砸成小块,乙醇梯度脱水,烘干。将处理好的材料于烧结炉中进行第一次煅烧:2 h升温至400 ℃,再3 h升温至800 ℃,至800 ℃保温1 h,后缓慢降温冷却。然后置于0.1 mol/L磷酸氢二铵溶液中浸泡24 h,取出样品后烘干。然后进行第二次煅烧:2 h升温至400 ℃,200 min缓慢升温至600 ℃,再1 h升温至800 ℃,800 ℃保温1 h,再2 h升温至1 150 ℃,至1 150 ℃保温2 h,随后进入降温程序。
1.5 材料检测
1.5.1物相分析 通过布鲁克D8 advance X射线衍射仪对烧结后的牙源性材料进行物相分析,并用全峰图拟合(WPF) 与 Rietveld 精细化方法做定量分析。检测条件为:Cu靶,电压30 kV,电流30 mA,扫描速度10°/min~20°/min,2θ测量范围为10°~80°。
1.5.2元素分析 通过瓦里安710-ES全谱直读电感耦合等离子体发射光谱仪分析烧结牙源性材料的钙磷元素比。
1.5.3扫描电镜观察材料表面 将牙源性BCP、Bio-Oss和β-TCP三种材料干燥、喷金处理后,用GeminiSEM 300场发射扫描电子显微镜观察三种材料的表面特征及微观结构。
1.6 动物实验研究
1.6.1兔上颌窦开窗术及骨粉填充 将9只实验动物随机均分成以下三组:牙源性BCP和Bio-Oss骨粉,牙源性BCP和β-TCP骨粉,Bio-Oss骨粉和β-TCP骨粉。每组兔的双侧上颌窦开窗后随机植入对应的两种材料。兔称重后用3%戊巴比妥钠1 ml/kg耳缘静脉注射麻醉,全麻后鼻背部备皮,取俯卧位,消毒后铺巾,并在鼻背部注射甲哌卡因作局部浸润。沿鼻背中线做2.5~3 cm左右的垂直切口,切开皮肤及皮下组织,剥离骨膜以暴露鼻骨、中线结合处及鼻额缝。见图1。无菌生理盐水冷却下,使用种植机的环形钻(直径5 mm)在鼻额缝下2 cm、中线外0.5 cm处做双侧圆形骨窗,暴露完整无破损的上颌窦黏膜,可观察到黏膜随呼吸运动起伏,并留取开窗的碎骨片暂存于生理盐水中。然后将等量的骨粉按照设计的分组填充到上颌窦的圆形骨窗中,使充满骨窗,再将留取的骨片复位于骨窗口。最后分层对位缝合。术后密切观察,在兔臀部肌肉注射青霉素和链霉素,并在术区涂抹金霉素软膏,以预防感染,连续用药3 d。
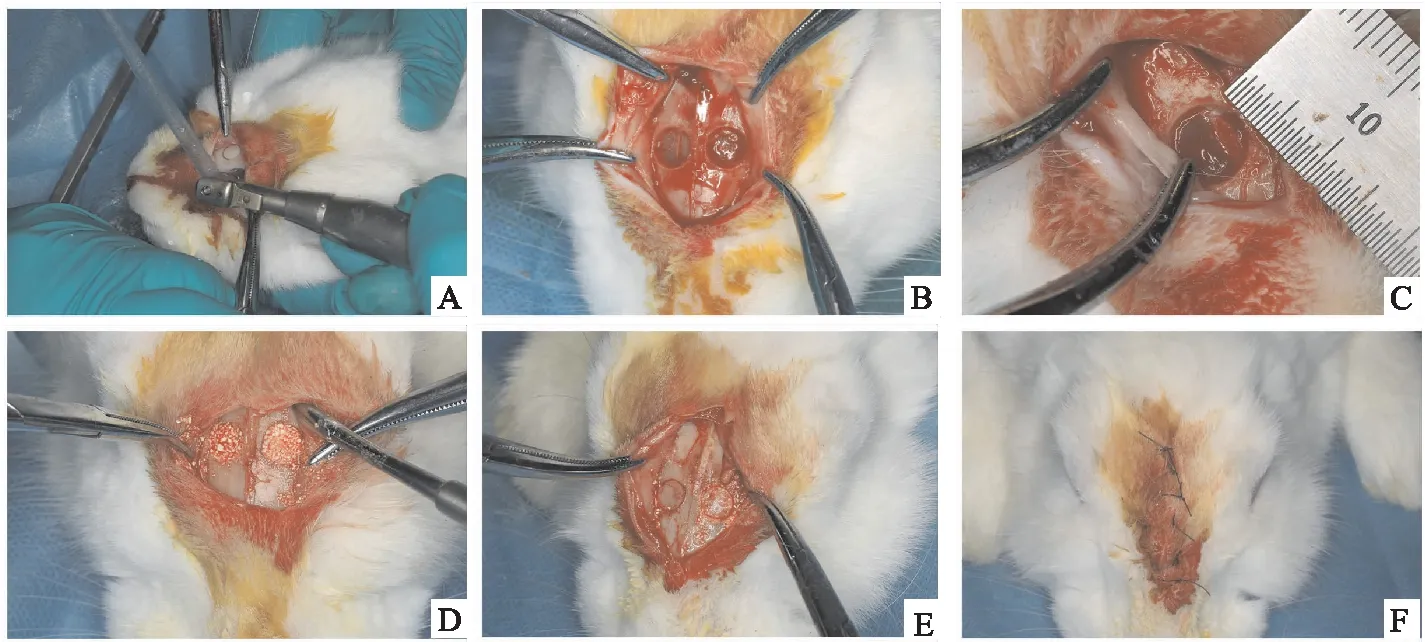
图1 兔上颌窦开窗术及骨粉填充过程a:环钻制备圆形骨窗;B:双侧骨窗制备完成;C:圆形缺损直径5 mm;D:填充骨粉;E:骨片复位于骨窗处;F:对位缝合
1.6.2Micro-CT分析 应用Micro-CT评估兔上颌窦开窗植骨后3个月,各材料组的新骨形成情况。取3种材料的上颌窦样本各3份行Micro-CT扫描,通过分析系统获得描述新骨质量和数量的参数,如骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数(Tb.N)、骨小梁分离度(Tb.Sp)、骨密度(BMD)。
1.6.3组织学分析 取其余9份上颌窦样本制作不脱钙硬组织切片进行组织学观察及分析。对修剪后的组织块行脱水、浸塑、包埋处理,在感兴趣区域用硬组织切片机切出数个10 μm的薄片,并用Goldner三色法染色。结果判读:细胞核呈蓝紫色,矿化骨呈绿色,非矿化骨呈橙红色。使用正置白光拍照显微镜、全景切片扫描仪和扫描浏览软件(CaseViewer2.4)进行组织学观察及图像采集。
2 结果
2.1 牙源性BCP的物相分析及元素分析结果X线衍射结果显示,离体牙经上述方法烧结后,成为由HA和β-TCP组成的双相磷酸钙陶瓷。见图2。定量分析显示HA ∶β-TCP比值约为7 ∶3。元素分析结果显示钙磷元素比为1.627 ∶1。
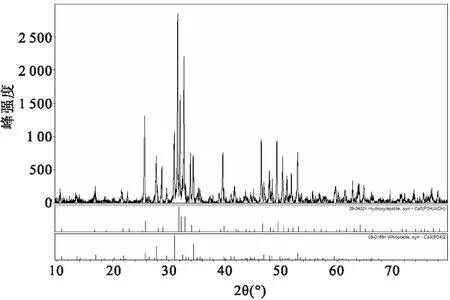
图2 牙源性烧结材料的X线衍射图
2.2 材料的表面形貌图3为材料表面具有代表性特征的SEM图像。该牙源性BCP主要呈现两种表面特征,一种是较光滑的一面,上有牙本质小管开口样的交通孔隙,形状大小不一,以圆形和椭圆形为主,其间还存在着一些裂隙样的孔隙,可能是烧结过程中数个小孔连接形成,形成更丰富的交通孔隙;另一种表面略粗糙,密集分布着的1 μm左右的颗粒样结构,外形不规则,部分呈现为数个小颗粒结合的形态。作为对照,Bio-Oss和β-TCP材料的表面形貌也被观察分析,Bio-Oss表面较为平整,放大图像显示表面呈不规则条索状、纤维状。β-TCP材料完全由不规则球状和短棒状的小颗粒连接而成,交通孔隙较复杂。

图3 三种骨替代材料的扫描电镜图A:牙源性BCP;B:Bio-Oss;C:β-TCP;1:×64;2:×200;3:×1 000;4:×2 000
2.3 动物大体观察术中所有样本均未观察到上颌窦膜穿孔。术后3 d切口附近有轻微肿胀,抗生素治疗后,肿胀逐渐消退,动物饮食等正常,无动物死亡,伤口愈合良好。
2.4 Micro-CT检测结果Micro-CT扫描图像显示窦腔内可见由新骨与残留颗粒组成的穹隆状突起(图4)。部分标本骨窗基本愈合,部分标本中复位在骨窗的骨片与周围骨壁还未完全愈合生长到一起,并伴有一定程度的凹陷。在牙源性BCP组和Bio-Oss材料组,新骨与残留材料颗粒混合良好,新骨均匀分布在部分降解的材料颗粒之间。而在β-TCP材料组,因β-TCP降解过快,材料大部分已降解,而新骨形成速率未能跟上,在窦骨粉填充区域内部,形成了空腔。BV/TV、BMD、骨小梁结构参数等指标的数据如表1所示。三种材料的统计学分析结果显示(图5),β-TCP组的BV/TV小于BCP组(F=6.691,P<0.05),而上述两组与Bio-Oss组之间的BV/TV,差异无统计学意义。Tb.Th和BMD在这三组之间的差异无统计学意义。BCP组的Tb.N大于β-TCP组(F=6.184,P<0.05),而与Bio-Oss组之间差异无统计学意义。BCP组的Tb.Sp小于Bio-Oss(F=19.44,P<0.05)和β-TCP组(F=19.44,P<0.01),差异有统计学意义。
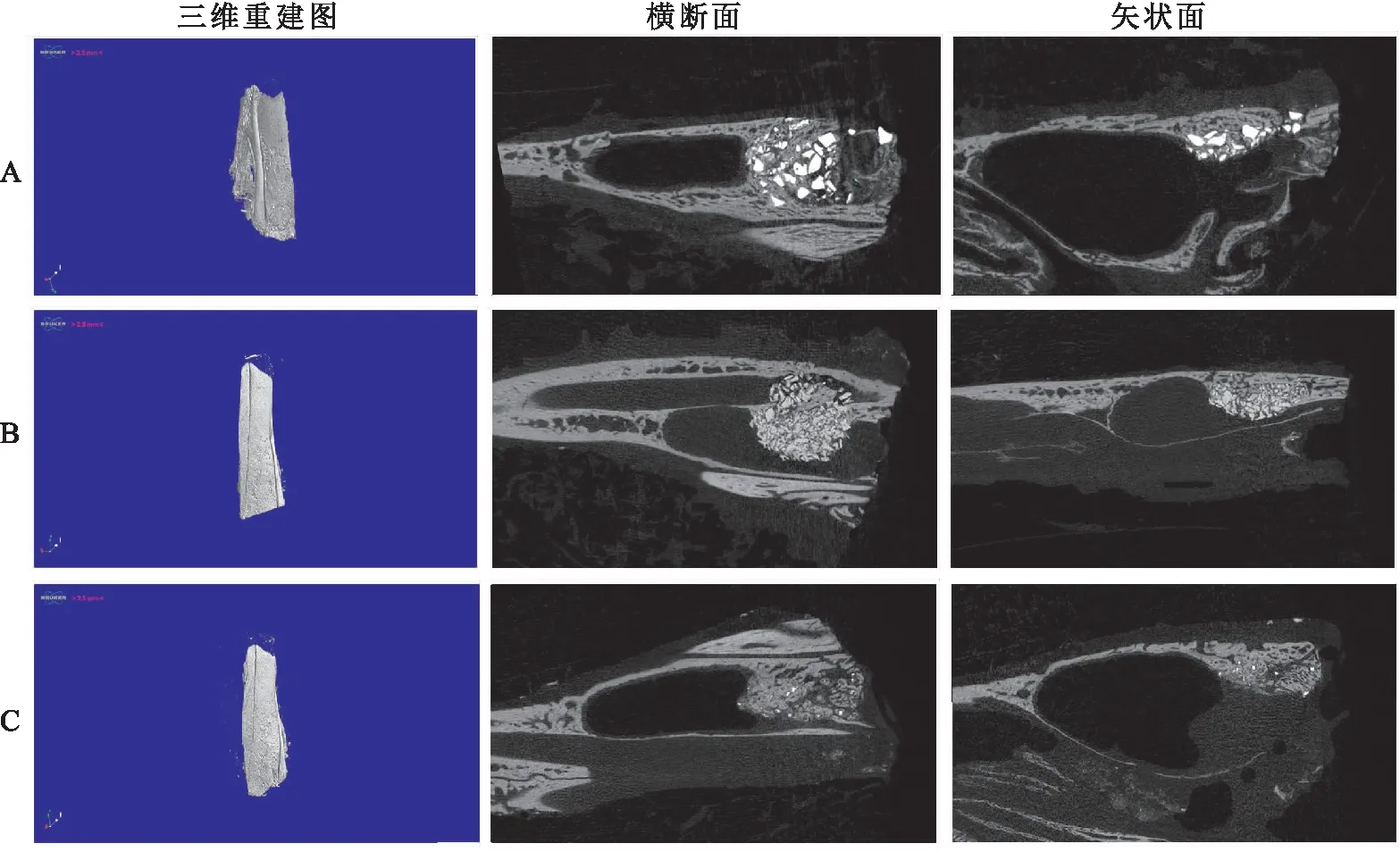
图4 Micro-CT检测的扫描图像A:牙源性BCP;B:Bio-Oss;C:β-TCP
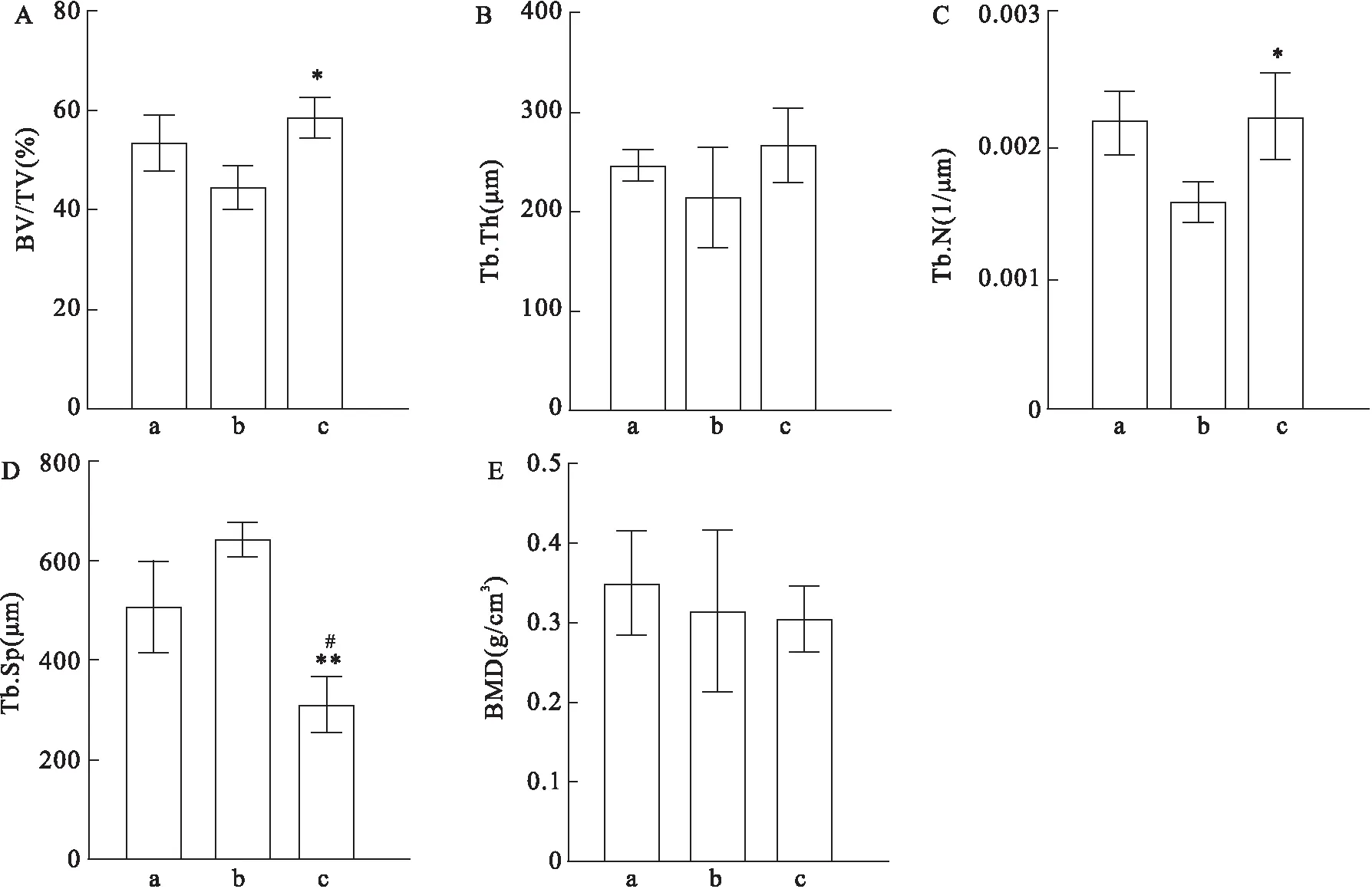
图5 Micro-CT检测结果的统计学分析A:BV/TV;B:Tb.Th;C:Tb.N;D:Tb.Sp;E:BMD;a:Bio-Oss;b:β-TCP;c:BCP;与β-TCP组比较:*P<0.05,**P<0.01;与Bio-Oss组比较:#P<0.05
表1 Micro-CT分析各指标的值
2.5 不脱钙硬组织切片观察组织学图像显示了术后3个月上颌窦内骨粉填充区Goldner三色染的结果(图6)。三种材料的骨抬高区均呈穹隆状突起,但是BCP组和Bio-Oss组的突起更明显,该区域内新骨形成均匀,新骨与材料表面密切接触,一些不规则的材料表面可能是由于材料颗粒的降解造成的。而β-TCP组,由于材料降解过快,新骨形成速率稍慢,在提升区域内可见较大的空腔,可能是由此引起的空间塌陷,导致β-TCP组的骨提升高度较低。图中可见,在骨粉颗粒间形成了深绿色的矿化程度较高的新骨和浅绿色的低矿化度新骨,具有骨小梁结构。低矿化度骨存在编织状骨小梁;而高矿化度骨是板层状骨,代表骨已成熟。在部分低矿化度的新骨表面观察到了黄色的成骨细胞。在Bio-Oss组,材料颗粒和新骨之间还夹杂着部分橙红色区域,是未矿化的类骨质。
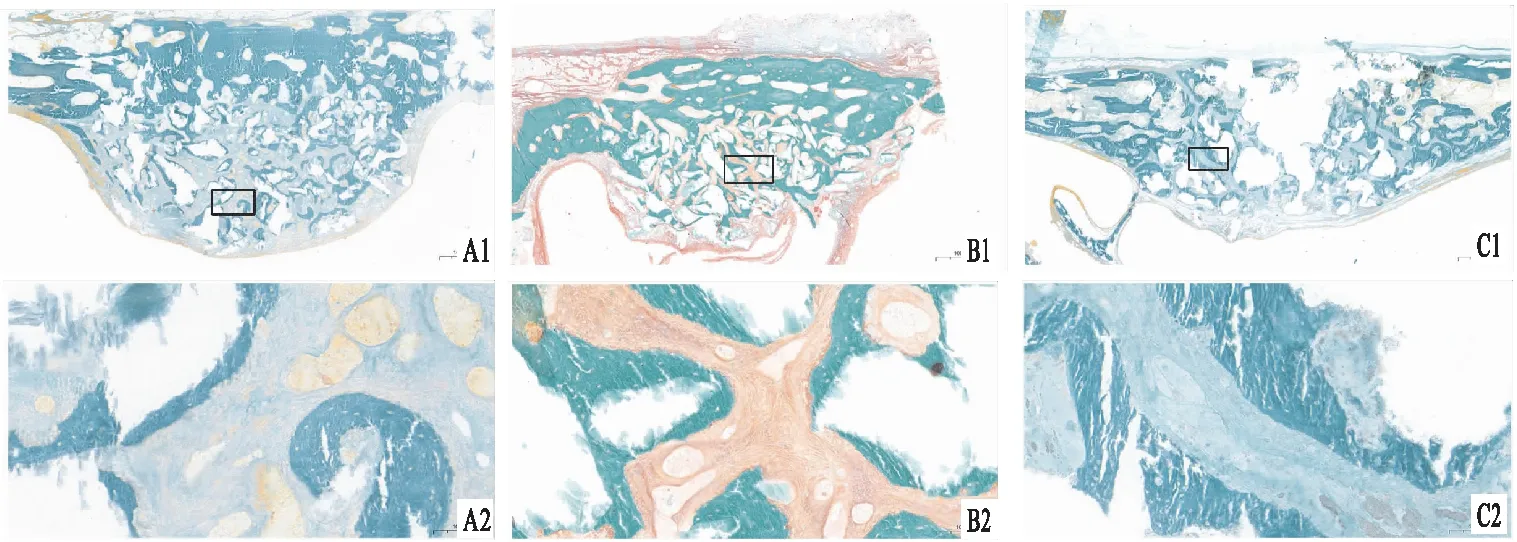
图6 不脱钙硬组织切片Goldner染色A:牙源性BCP;B:Bio-Oss;C:β-TCP;1:×1.5;2:上图方框区域放大图像 ×15
3 讨论
在临床种植修复中广泛应用的骨替代材料是Bio-Oss骨粉,其理化性质与人体骨组织相似,且保留了天然小牛骨的多孔结构,但是其价格昂贵且难以完全降解吸收。在对骨替代材料的广泛研究中,自体牙应用技术逐渐被重视。但是自体牙骨替代材料在临床上的应用也是受限制的,因为这需要患者恰有智齿或难以通过治疗、修复保存下来的患牙需要拔除。而且,同种异体或异种的牙源性骨替代材料的安全性仍待研究验证。有研究[8-9]表明,脱矿牙本质基质(DDM)具有骨传导性和骨诱导性;对自体牙行脱水、脱脂、脱矿、冻干、环氧乙烷消毒等处理后可以得到自体牙骨移植材料(AutoBT)[10];牙齿高温煅烧处理后制成牙粉可用于骨再生[7],且煅烧去除了有机成分,消除了免疫排斥的风险。有研究[11]表明AutoBT在临床应用中成骨能力强,可以维持种植体的稳定性。本研究将另一种牙骨移植材料烧结牙粉应用在上颌窦模型中,再与临床常用的Bio-Oss和β-TCP材料的骨重建效果作对比,为牙源性骨替代材料的临床应用提供新的依据。
本研究采用烧结技术制备了由70%的HA和30%的β-TCP组成的牙源性BCP支架。高温煅烧处理完全去除了牙齿中的有机物,其无机成分与骨类似,而且制作成本低。牙源性BCP的特点是具有HA和β-TCP在同一颗粒内的存在和均匀分布,具有相互连接的孔隙,细胞先在材料表面黏附和增殖,随着材料颗粒的生物降解,细胞会增殖长入材料的内部。
制备方法及原材料的差异会影响磷酸钙陶瓷的形状、孔隙和表面形貌等,这些因素都可能影响其成骨能力[12-13]。本研究中的牙源性BCP在扫描电镜下的图像显示出牙本质小管开口样孔隙和颗粒样结构这两种特征。有研究[14]表明,具有良好表面特性和丰富交通孔隙的磷酸钙陶瓷有利于细胞的黏附增殖,可以促进矿物质的沉积和蛋白质的吸附,从而影响骨再生效果。
术后3个月的影像学和组织学图像都显示,BCP和Bio-Oss材料更适合作为上颌窦区域的骨替代材料,而β-TCP材料降解过快,不易维持空间稳定。Micro-CT的数据分析表明,该牙源性BCP具有更高的骨体积分数,更多的新骨形成,骨小梁的微结构分析也显示BCP组的新骨质量更佳。
在上颌窦区域的植骨术中,受解剖结构的限制,其植骨材料的应用也有别于其他骨缺损。与具有多面骨壁的缺损相比,上颌窦区植骨后,骨替代材料往往只能贴合于周壁和底壁,而其成骨最初可能是从周壁或底壁开始,然后呈向心性进展,逐步取代骨替代材料。本研究中,β-TCP组的组织学结果(图6C)也证实了这一点,靠近骨窗周围骨壁的新骨形成量更多,其新骨密度也更大,而骨窗中心区域可见大块的材料颗粒聚集。不过在BCP和Bio-Oss组却未观察到这种分布趋势,其新骨形成更均匀。当然,该BCP材料来源于人离体牙,Bio-Oss材料来源于小牛骨,它们应用在兔上颌窦中获得了良好成骨效果,但是由于种族差异和解剖结构差异等,该材料应用在人体上的效果仍有待进一步研究。
BCP材料植入体内后,β-TCP部分迅速被吸收,提供成骨空间,而HA部分可以存在较长时间,增加体积的稳定性。BCP的降解率介于纯HA和纯β-TCP之间,而不同HA/β-TCP比例的双相磷酸钙已在骨缺损修复中被广泛研究及临床应用[15]。在后续的研究中,可制备不同HA/β-TCP比例的牙源性BCP,更深入地研究牙源性烧结BCP的性能及它在上颌窦中的成骨效果和稳定骨重建体积的效果等。

