MicroRNAs在骨髓间充质干细胞成软骨分化中的作用
谢犇 杨杜斌 秦庆庆 王一坤 阳庆林 王勇平,2*
1.兰州大学第一临床医学院,甘肃 兰州 730000 2.兰州大学第一医院骨科,甘肃 兰州 730000
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)最早由Friedenstein等[1]于1970年在豚鼠骨髓中发现,直到1991年Caplan提出了“间充质干细胞”这一术语才统一了概念[2]。BMSCs是一种未充分分化的类中胚层细胞,在特定条件下可分化为成骨细胞、软骨细胞、脂肪细胞等,具有取材方便、对机体损伤小、免疫源性小等优点[3]。MicroRNA(MiR)最早由Lee等发现[4],是一种大小为19到25个核苷酸的内源性小RNA,存在于动物、植物和一些病毒中。MiR通过碱基配对靶向mRNA的3′端,导致mRNA失稳并且抑制其翻译,一种MiR可以靶向数百个mRNA,影响许多基因的表达,进而调控包括分化在内的多种细胞活动[5]。
软骨组织没有血液、淋巴管和神经,其营养依赖于周围组织的扩散,根据软骨组织的组成和功能,可以将其分为透明软骨、纤维软骨以及弹性软骨。透明软骨广泛存在于膝关节等滑膜关节的关节面,其基质富含糖胺聚糖(GAGs)和高度粘附的胶原纤维(主要是II型胶原(COLII)),GAGs与核心蛋白形成蛋白多糖(主要为aggrecan)[6]。Shiraishi等[7]研究发现MiR-486-3p、MiR-148b等的表达水平的改变与BMSCs成软骨分化息息相关。此外,还有大量研究表明BMSCs成软骨分化过程中伴随多种MiR表达水平的改变[8-12]。
1 促进骨髓间充质干细胞成软骨分化的MicroRNA
王浩等[13]发现MiR-23a转染大鼠BMSCs可导致其软骨分化相关基因如Sry相关高迁移率组合基因9(Sox9)、COLII、aggrecan的表达上调,而软骨肥大相关基因COLX表达下调,进一步研究表明MiR-23a能促进Sox9表达而抑制Runx表达,以上结果表明MiR-23a可能通过上调Sox9及下调Runx2促进大鼠BMSCs成软骨分化。也有其他研究发现小分子物质H-89可诱导MiR-23b的表达进而抑制PKA信号通路促进人BMSCs软骨分化[14]。陈祁青等[15]通过预测MiR、信号通路及靶基因说明右归饮可能通过上调MiR-24-3p,进而阻断MAPK信号通路促进大鼠BMSCs成软骨分化。Tian等[16]使用MiR-30a模拟物转染到大鼠BMSCs后发现COLII和aggrecan的mRNA和蛋白表达水平显著升高,阿利新蓝染色强度增强,MiR-30a可通过直接靶向负调控Delta-like 4(DLL4,Notch信号家族的配体)促进大鼠BMSCs成软骨分化。Mao等[17]发现在人BMSCs成软骨分化过程中外泌体MiR-92a-3p的表达水平升高,MiR-92a-3p可使BMSCs软骨增殖相关基因表达增高,并抑制WNT5A的表达,这表明MiR-92a-3p可能直接靶向WNT5A调控BMSCs成软骨分化。此外该作者还发现MiR-95-5p可能直接靶向抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)2/8促进BMSCs成软骨分化[18]。
Xiao等[19]发现在BMSCs软骨分化过程长链非编码RNA HOX反义基因间RNA髓系1变体1(HOTAIRM1-1)负调控MiR-125b的表达,且HOTAIRM1-1可抑制JNK/MAPK/ERK通路的活化,而MiR-125b可靶向骨形态发生蛋白受体2(bone morphogenetic protein receptor 2,BMPR2)调控BMSCs成软骨分化。Mahboudi等[20]使用MiR-140转染的人BMSCs中COLII和aggrecan的基因表达增加,这表明MiR-140是一种有效的BMSCs软骨分化诱导因子。此外也有研究[21]表明RALA(一个小GTPase)是MiR-140的靶点,且RALA在蛋白水平上调控Sox9。Barter等[22]的试验表明MiR-140-5p是人BMSCs成软骨分化过程中的正向调控因子,MiR-140-5p可以调控多个靶点并且可正向调控Wnt信号通路。刘波等[23]发现MiR-155转染可升高大鼠BMSCs中Sox9、COLⅡ、aggrecan基因表达,降低COLX基因表达。Yang等[24]的研究表明MiR-210-3p可上调COLII和Sox9的mRNA和蛋白水平促进大鼠BMSCs成软骨分化,且与HIF-3α信号通路相关。
Lin等[25]发现过表达MiR-335-5p可增加小鼠BMSCs软骨形成标记基因的表达,MiR-335-5p靶向Sox9的负调控因子Daam1和ROCK1,同时靶向DKK1以增加β-catenin/TCF活性。Chen等[26]发现周期性牵张应力(CTS)可上调大鼠BMSCs成软骨分化过程中MiR-365表达,荧光素酶检测显示HDAC4是MiR-365的直接靶点,且有体内研究表明CTS治疗和MiR-365过表达可促进BMSCs软骨分化。此外,也有其他研究[27]证实MiR-365是人BMSCs成软骨分化中的主要调控因子。
张庆金等[28]发现MiR-410转染显著增加了人BMSCs中Sox9、透明质酸合成酶2(Has2)的mRNA和蛋白质水平,促进了其成软骨分化。Zhang等[29]发现在人BMSCs成软骨分化过程中MiR-410升高,MiR-410转染后COLII、Sox9、aggrecan和Has2的mRNA和蛋白水平升高,进一步研究表明MiR-410可直接靶向Wnt3a激活Wnt信号通路促进人BMSCs成软骨分化。Wu等[30]的研究说明了褪黑素可上调MiR-526b-3p和MiR-590-5p的表达,这两种MiR可靶向SMAD7增强SMAD1的磷酸化,促进人BMSCs成软骨分化。Li等[31]的研究表明MiR-8485可靶向抑制糖原合成酶激酶(GSK)3B的表达,并靶向DACT1激活Wnt/β-catenin通路促进人BMSCs成软骨分化。
2 抑制骨髓间充质干细胞成软骨分化的MicroRNA
Shen等[32]发现MiR-23c模拟物转染可使大鼠BMSCs蛋白多糖沉积减少,ACAN和COL2A1的mRNA和蛋白表达下降,MiR-23c可结合并负向调控成纤维细胞生长因子(FGF)2,这表明MiR-23c可通过抑制FGF2抑制大鼠BMSCs成软骨分化。Huang等[33]发现在大鼠BMSCs成软骨分化过程中MiR-26b的表达水平显著下调,转染MiR-26b siRNA上调了COLII和aggrecan的表达,进一步研究表明MiR-26b可直接靶向Wnt负调控Wnt/β-catenin信号通路抑制大鼠BMSCs成软骨分化。Guérit等[34]发现MiR-29a是人BMSCs成软骨分化过程中下调最多的MiR之一,MiR-29a过表达抑制了软骨细胞特异性标志物的表达,荧光素酶检测发现FOXO3A蛋白是MiR-29a的直接靶点。Zhang等[35]的试验表

表1 促进BMSCs成软骨分化的MicroRNATable 1 microRNAs that stimulating the differentiation of BMSCs
明MiR-30a可通过靶向Sox9对BMSCs软骨分化起负向调控作用。陈松等[36]发现MiR-90a转染可导致大鼠BMSCs中GAG明显减少,这表明MiR-90a可能抑制大鼠BMSCs成软骨分化。Zhou等[37]发现MiR-99a在大鼠BMSCs早期软骨分化过程中增加,MiR-99a敲低可促进蛋白多糖沉积并增加ACAN和COL2A1的表达;进一步研究表明MiR-99a通过早期靶向BMPR2负调控大鼠BMSCs成软骨分化。
Shu等[38]发现lncRNA UCA1可下调MiR-145-5p和MiR-124-3p的表达并促进BMSCs成软骨分化,结合荧光素酶检测提示MiR-145-5p和MiR-124-3p可能分别靶向SMAD5和SMAD4抑制人BMSCs成软骨分化。Zhang等[39]发现在大鼠BMSCs软骨分化过程中MiR-130b首先增加,然后急剧减少,MiR-130b抑制剂可促进BMSCs成软骨分化,其研究表明MiR-130b可能通过靶向Sox9抑制大鼠BMSCs软骨分化。Xu等[40]发现MiR-134在大鼠BMSCs成软骨分化过程显著下调,抑制MiR-134可促进BMSCs成软骨分化,后续试验表明MiR-134可能通过靶向SMAD6负调控大鼠BMSCs成软骨分化。Tian等[41]的研究表明MiR-143-3p模拟物转染可导致大鼠BMSCs蛋白多糖沉积及ACAN、COL2A1水平降低,且MiR-143-3p可靶向并负向调控BMPR2。Yang等[42]发现在小鼠BMSCs软骨分化过程中MiR-145降低,过表达MiR-145后COLII、aggrecan等的mRNA水平降低,结合荧光素酶检测说明MiR-145可靶向Sox9负调控因子小鼠BMSCs成软骨分化。
Lolli等[43]发现MiR-221表达水平降低可增加人BMSCs中软骨形成标志物的表达,且MiR-221受到Slug转录因子的正向调控。闫继红等[44]发现MiR-221-3p/222-3p在人BMSCs软骨分化后期表达明显降低,使用反义MiR-221-3p/222-3p转染人BMSCs可导致硫酸软骨素以及COLⅡ蛋白及mRNA表达明显上调,这表明MiR-221-3p/222-3p可能抑制人BMSCs成软骨分化。Yoshizuka等[45]的研究表明抑制MiR-222可促进人BMSCs中COL2A1、aggrican和Sox9的表达促进成软骨分化,即MiR-222可能抑制人BMSCs成软骨分化。Zheng等[46]发现过表达circATRNL1可逆转了MiR-338-3p抑制人BMSCs的软骨分化的作用。
Baek等[47]的研究表明MiR-449a可能通过靶向sirtuin 1(SIRT1)和淋巴增强结合因子-1(LEF-1)抑制人BMSCs成软骨分化。Anderson等[48]发现在肥大软骨细胞中MiR-483显著下调,MiR-483过表达降低了人BMSCs软骨细胞基因表达,并导致TGF-β通路成员SMAD4下调,以上结果表明MiR-483可能通过抑制SMAD4负调控人BMSCs成软骨分化。Chen等[49]发现过表达MiR-485-5p可减少小鼠BMSCs软骨表面标记基因的表达,而当MiR-485-5p被抑制时,则出现相反的结果,这表明MiR-485-5p可抑制小鼠BMSCs成软骨分化。Lee等[50]的研究表明MiR-495可直接靶向Sox9抑制人BMSCs成软骨分化。Zhou等[51]发现MiR-615-3p在大鼠BMSCs成软骨分化过程中表达下调,过表达MiR-615-3p后COL2A1、COL10A1等的mRNA表达量降低,且Sox9蛋白表达下调,这表明MiR-615-3p可能通过下调Sox9抑制大鼠BMSCs成软骨分化。
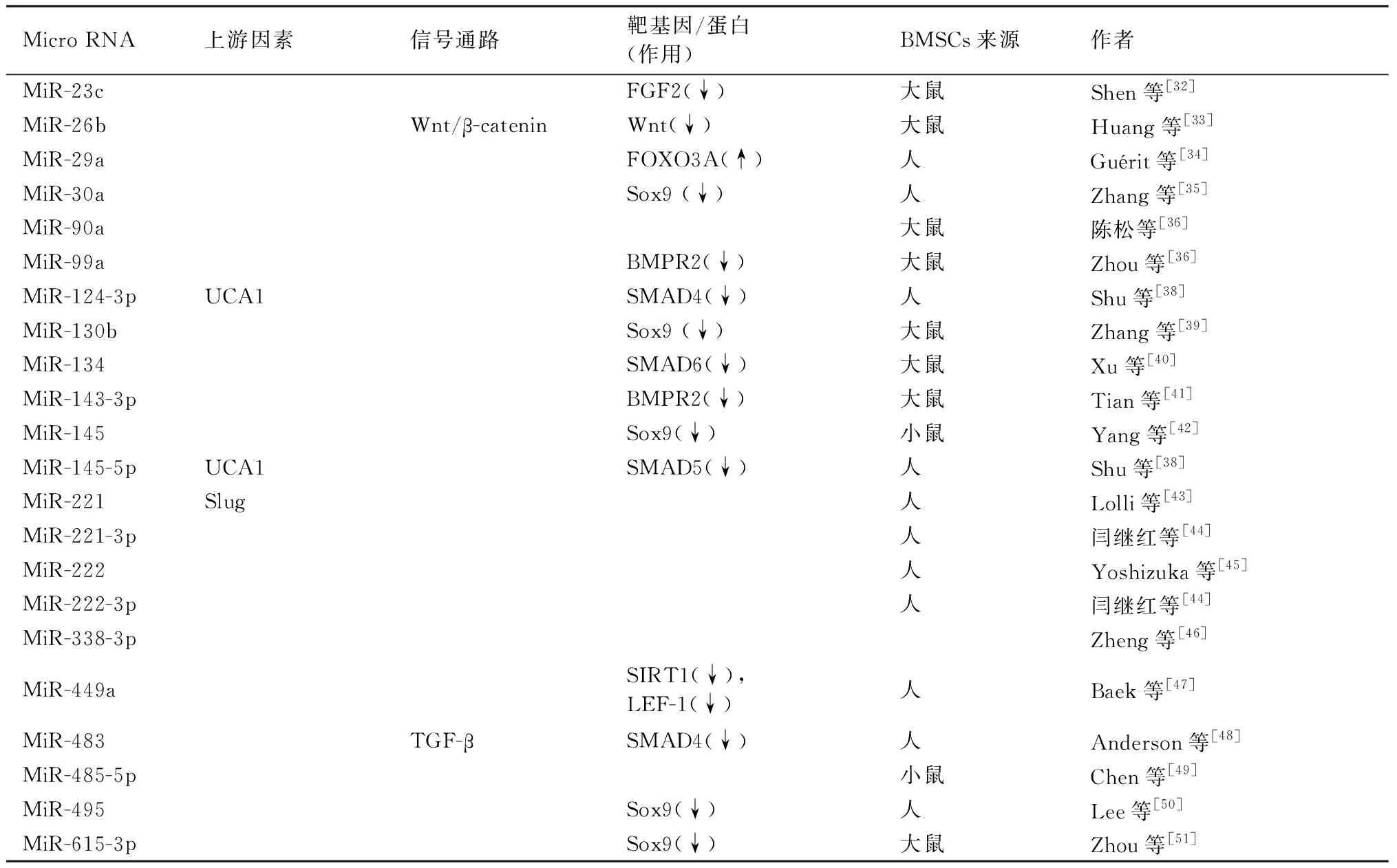
表2 抑制BMSCs成软骨分化的MicroRNATable 2 microRNAs that inhibiting the differentiation of BMSCs
3 其他
除上述对BMSCs成软骨分化作用较为明确的MiR外,Guérit等[52]发现MiR-574-3p在人BMSCs成软骨分化过程的早期上调,且其与Sox9直接结合,随后的研究证实体外和体内操纵MiR-574-3p表达的上调和下调均抑制了人BMSCs成软骨分化。此外,也有研究表明MiR-29b对BMSCs成软骨分化既有支持作用,也可能有抑制作用[53]。
4 总结
综上所述,MiR作为调控因子在BMSCs成软骨分化过程中发挥着重要的作用,不同的MiR作用于不同的靶点进而起到促进或抑制BMSCs成软骨分化的作用,在BMSCs成软骨分化过程中涉及多种MiR,其作用的靶点与通路互相交织,形成了复杂的调控网。因此进一步研究MiR的靶基因及BMSCs成软骨分化的分子机制有着重要意义,同时应对MiR的上游调控因素有更加深入的研究,以在MiR水平精准调控BMSCs成软骨分化。随着分子生物学的不断发展以及基础研究的不断深入,MiR调控BMSCs成软骨分化的作用及具体机制将会更加清晰,这将为软骨损伤等疾病的提供理论依据和治疗措施,即MicroRNA靶向治疗。

