基于高通量测序的巨菌草根系固氮菌群组成及其促生性能分析
陈小红, 张 雪, 刘家敏, 李 晶, 林标声,,4
(1.龙岩学院生命科学学院,福建 龙岩 364012;2.福建农林大学生命科学学院,福建 福州 350002;3.国家菌草工程技术研究中心,福建 福州 350002;4.预防兽医学与生物技术福建省高等学校重点实验室,福建 龙岩 364012)
菌草技术是“以草代木”发展起来的中国特有技术[1].该技术已推广至全球100多个国家,在中国“脱贫攻坚战”中发挥了重要作用.巨菌草(Pennisetumgiganteum)是菌草中最重要的代表,其隶属于禾本科(Poaceae)狼尾草属(Pennisetum),最早于2005年从南非夸纳省引进,至今在中国已有26年的种植历史[2].目前,巨菌草主要在中国西部的青海、新疆、内蒙古等地的沙漠、盐碱地和沙地等种植,其产量高(最高可达150 t·hm-2左右)、植株高大(最高可达十几米)、抗逆性强,是防风固沙、水土保持的优良草种[3-4].巨菌草在此类贫瘠地生长旺盛,且能显著增加土壤微生物群落多样性,提高土壤肥力,推测可能是其中与植物互作的固氮菌在起作用[5-6].有关巨菌草固氮菌的研究主要集中在内生固氮菌的菌群组成、分离及鉴定方面[7-8],而其根系固氮菌还未见报道.因此,本研究采用高通量测序技术(high-throughput sequencing)分析巨菌草根系固氮菌群组成,研究其主要固氮菌的促生性能,以期为挖掘巨菌草根系固氮菌资源、提高菌草生物质产量及研发微生物固氮菌肥提供依据.
1 材料与方法
1.1 材料
菌草:采自福建省龙岩市龙岩学院作物种植基地.
玉米种子:苏科甜1506品种,由山东寿禾种业有限公司提供.
培养基:Ashby无氮培养基,用于固氮菌株的筛选,具体配方见文献[9],固体培养基加2%琼脂;无机磷和有机磷培养基,用于固氮菌的解磷能力试验,具体配方见文献[10];CAS培养基,用于检测菌株产铁载体能力,具体配方见文献[11].
试剂盒:ELISA试剂盒、细菌吲哚乙酸(indole-3-acetic acid, IAA)ELISA试剂盒,购自上海羽朵生物科技有限公司;OMEGA试剂盒,购自北京诺博莱德科技有限公司.
1.2 方法
1.2.1 样本采集及高通量测序分析 在种植基地,按S型原则进行布点,选取5株间距大于1 m的巨菌草作为取样点.小心挖掘每个取样点的巨菌草植株的完整根系,抖落大块土壤,收集根系表面虚土作为根表土壤样本;采用灭菌小刀刮取抖土后的植株根表,所刮取物质作为根表样本;同时,取距植株根1 cm左右的土壤作为根围土壤样本.5个取样点同一类型样本装入同一无菌塑料袋中,混合均匀后封口,待用.
按照OMEGA试剂盒说明书提取各样本细菌基因组总DNA,选择360 bp片段作为各样本固氮功能基因nifH的PCR扩增片段.引物序列为nifH-F(5′-AAAGGYGGWATCGGYAARTCCACCAC-3′)/nifH-R(5′-TTGTTSGCSGCRTACATSGCCATCAT-3′).PCR反应体系(25 μL):5×GC Buffer 5 μL,5×Reaction buffer 5 μL,DNA模板2 μL,上游引物(10 μmol·L-1)1 μL,下游引物(10 μmol·L-1) 1 μL,dNTP(2.5 mmol·L-1) 2μL,Q5 DNA Polymerase(2 U·μL-1) 0.25 μL和ddH2O 8.75 μL.PCR反应条件:98 ℃,2 min;98 ℃,15 s;55 ℃,30 s;72 ℃,30 s;35个循环;72 ℃,5 min.所得目的基因片段经1%(质量分数)琼脂糖凝胶电泳检测,纯化回收后经高通量测序平台(Miseq-Illumina)进行序列测定和分析(委托北京奥维森生物科技有限公司完成),采用CD-HIT分类方法对所得序列进行归类,通过序列丰度分析各样本的固氮菌群组成[12].此外,根据属水平上的丰度信息,利用R软件(vegan包)进行主成分分析(principal component analysis, PCA),比较各样本间固氮菌群的相似性[13].
1.2.2 固氮菌的分离与纯化 用灭菌小刀刮取根表样品1 g,放入9 mL无菌水中;用无菌铲子分别取根表土壤、根围土壤样本10 g,放入90 mL无菌水中;各样本混合均匀,制成菌悬液,分别进行梯度稀释后,取0.1 mL菌液涂布于无氮培养基中,30 ℃倒置培养24~48 h,统计各样本固氮菌落数.每个样品取样3次,求平均值.
分别挑选各样本中菌落数占比较高、长势旺盛的5个典型菌落,记录各菌落的基本形态特征,并测定固氮酶活性(ELISA试剂盒测定).选择固氮酶活性较高的菌株,通过平板划线法在无氮固体培养基中进行纯化后保存,待用[14].
1.2.3 固氮菌株的筛选 聚类分析:将所挑选的菌株接入无氮培养基中培养至对数生长期,收集各菌株菌液,按谭志远等[15]的方法提取菌液的全细胞蛋白,通过SDS-PAGE全细胞蛋白电泳聚类分析确定所挑选菌株的类群关系.
生理生化特性的鉴定:按照文献[16]的方法测定.
溶磷性能的测定:将分离菌分别接种于无机磷和有机磷培养基中,通过溶磷圈大小评定其溶磷性能[10].
产铁载体能力的测定:将分离菌采用点接种法接种于CAS培养基中,通过溶解圈大小判定其产铁载体能力[11].
1.2.4 所筛选固氮菌的16S rDNA序列鉴定 采用细菌通用引物27F对所筛选固氮菌株的16S rDNA序列进行鉴定.PCR反应总体系50 μL:模板DNA 2 μL,2×TsingKE Master Mix 25 μL,上游引物(10 μmol·L-1) 1 μL,下游引物(10 μmol·L-1)1 μL和ddH2O 21 μL.PCR反应程序:94 ℃,10 min;94 ℃,30 s;55 ℃,30 s;72 ℃, 1.5 min;30个循环;72 ℃,10 min.所得序列经NCBI 数据库比对,用DNAMAN V6软件构建同源关系树,确定菌株分类地位[17].
1.2.5 所筛选固氮菌的促生性能测定 水培玉米促生试验[18]:将玉米种子用0.1%(质量分数)升汞表面消毒30 min后浸泡催芽3~4 d,挑选芽长势一致的玉米种子,将其浸泡在对数生长期(浓度约为108CFU·mL-1)的固氮菌培养液中,浸泡时间12~20 h,以浸泡清水为对照.将各处理组的玉米种子置于50 mL无菌水中培养,每组6个塑料杯,每杯1粒,培养10 d.记录各组玉米幼苗的株高、根长、分根数.
盆栽玉米促生试验[19]:将玉米种子表面消毒后浸泡催芽、出苗,挑选长势基本一致的幼苗,置于固氮菌培养液(108CFU·mL-1)中浸泡12~20 h,以浸泡清水为对照.将各处理组幼苗移栽至已灭菌的土壤中,每组6盆,每盆1株,移栽5 d后再次浇灌5 mL左右菌液,10 d后统计玉米苗株高.
2 结果与分析
2.1 巨菌草根系的固氮菌群组成
3个样本固氮功能基因nifH的PCR扩增结果如图1所示,各样本序列大小均为360 bp左右.经高通量测序平台测序,3个样本共获得4万~5万多条Index完全匹配的有效序列,再采用CD-HIT分类方法对所获得的序列进行归类注释,结果如图2所示.门分类水平上,各样本中丰度最高的菌均为变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria),放线菌门(Actinobacteria)、螺旋体门(Spirochaetes)、硬壁菌门(Bacteroidetes)、拟杆菌门(Firmicutes)、酸杆菌门(Acidobacteria)等在不同样本也有少量分布(图2A).属分类水平上,丰度较高的菌为慢生根瘤菌属(Bradyrhizobium)、芽孢杆菌属(Bacillus)、科萨克氏菌属(Kosakonia)、固氮螺菌属(Azospirillum)和克雷伯氏菌属(Klebsiella),其中,根表的固氮菌群种类和丰度明显高于其他两个样本(图2B).此外,PCA表明,3个样本的固氮菌群组成差别较大(图3).

M.DL5 000 plus DNA marker.图1 根系各样本nifH基因扩增Fig.1 Amplification of nifH gene in root samples

图2 门(A)和属(B)水平上根系各样本主要固氮菌的组成Fig.2 Composition of main nitrogen-fixing bacteria from root samples at the phylum level (A) and genus level (B)
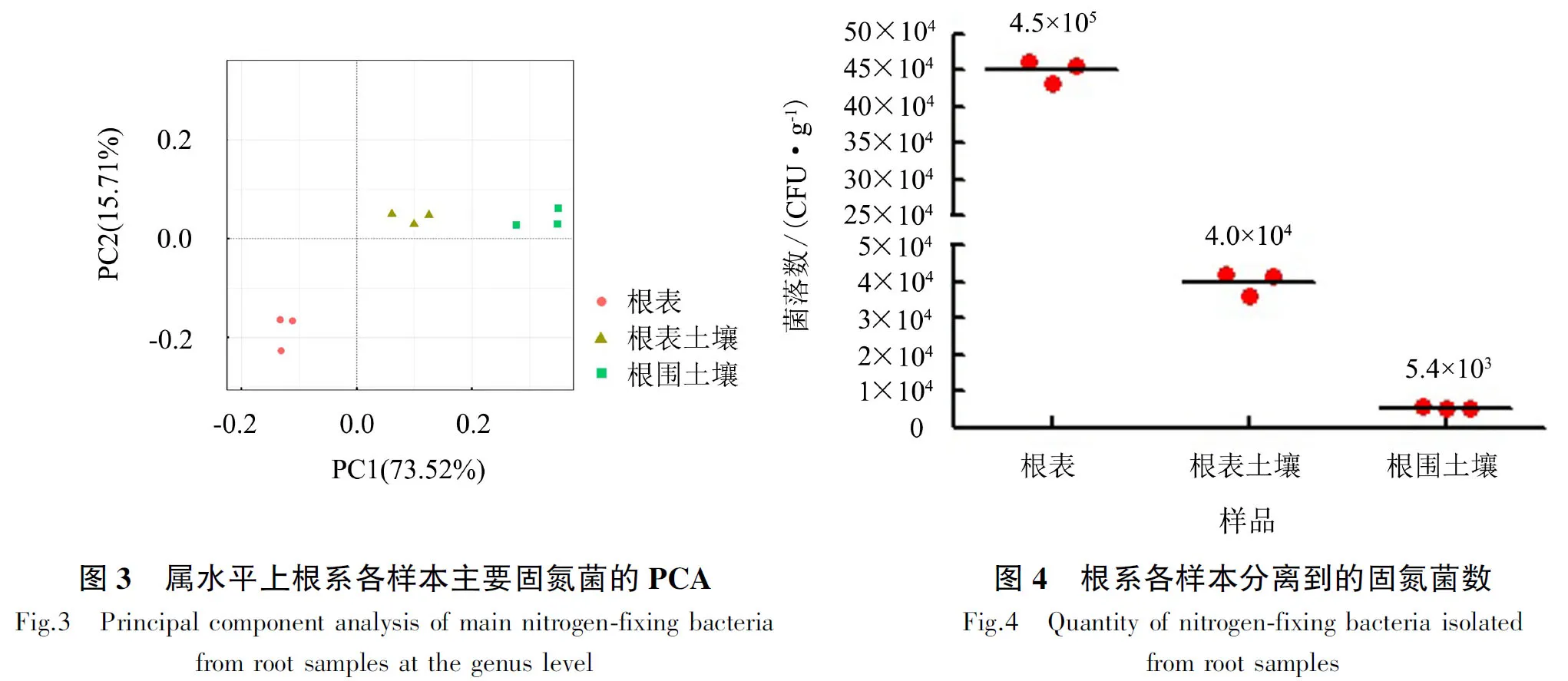
2.2 巨菌草根系的固氮菌分离数
巨菌草根系各样本固氮菌分离数见图4,从根表、根表土壤、根围土壤分别分离到4.5×105、4.0×104、5.4×103CFU·g-1固氮菌.其中,根表固氮菌含量最为丰富,与高通量测序结果一致.
2.3 巨菌草根系主要固氮菌的筛选与鉴定
2.3.1 固氮菌的基本形态特征和固氮酶活性 从3个样本中各挑选5个占比较高、长势旺盛的典型菌落,其菌落形态和固氮酶活性如表1所示.

表1 固氮菌株菌落形态特征及固氮酶活性Table 1 Nitrogenase activity and morphological characteristics of consortium of nitrogen-fixing bacteria
2.3.2 固氮菌SDS-PAGE全细胞蛋白电泳聚类分析 经SDS-PAGE全细胞蛋白电泳聚类分析(图5),所筛选的15株固氮菌可分为7个类群.

图5 根系各样本分离固氮菌的SDS-PAGE全细胞蛋白电泳聚类分析Fig.5 Cluster analysis on whole cell proteins of nitrogen-fixing bacteria isolated from root samples by SDS-PAGE electrophoresis
2.3.3 固氮菌的生理生化特性及溶磷和产铁载体能力 结合聚类分析和固氮酶活性结果,挑选7个代表菌株进行生理生化特性及溶磷和产铁载体能力测定,结果如表2所示.除9#菌株外,其他菌株均具有产氨能力.其中,2#和4#菌株在生长代谢过程中能分解蛋白胨中的色氨酸产生吲哚(吲哚试验),能分解有毒的过氧化氢(过氧化氢酶试验),能将硝酸盐还原成亚硝酸盐和氨(NO3-还原试验),且具有较强产铁载体能力和溶磷能力.因此,对2#和4#菌株做进一步鉴定,并用于后续促生试验.

表2 固氮菌的生理生化特性及溶磷和产铁载体能力1)Table 2 Physiological and biochemical characteristics, phosphorus-dissolving and iron carrier-producing capacities of nitrogen-fixing bacteria
2.3.4 固氮菌的16S rDNA序列鉴定 对代表菌株2#和4#进行PCR扩增,得到的条带大小在1 600 bp左右(图6).将其纯化后送检测序,得到的16S rDNA序列与NCBI下载的同源序列进行比对,并构建同源关系树(图7).结果表明,2#菌株为科萨克氏菌(Kosakoniaradicincitans),4#菌株为枯草芽孢杆菌(Bacillussubtilis),其同源性均为100%.

M.DL2 000 plus DNA marker.图6 2#和4#固氮菌PCR扩增电泳结果Fig.6 Electropherogram of PCR amplified 16S rDNA from nitrogen-fixing bacteria 2# and 4#

图7 2#(A)和4#(B)固氮菌16S rDNA基因序列同源关系树Fig.7 Phylogenetic tree of nitrogen-fixing bacteria 2# (A) and 4# (B) based on 16S rDNA sequencing
2.4 巨菌草根系固氮菌的促生性能
如表3所示,与对照组相比,经过2种固氮菌处理的水培玉米幼苗株高、根长、分根数均有一定程度的增加,其中,2#处理组的株高、分根数及4#处理组的分根数与对照组差异达显著水平(P<0.05).2#和4#固氮菌处理的盆栽玉米株高均显著增加(P<0.05).

表3 2#和4#固氮菌的促生性能1)Table 3 Growth-promoting effect of nitrogen-fixing bacteria 2# and 4#
3 讨论
目前,针对土壤根系固氮菌的研究主要集中在豆科植物[20],而有关禾本科植物巨菌草根系固氮菌的报道较少.本试验采用高通量测序技术研究了巨菌草根系固氮菌群的分布情况,结果表明:巨菌草根系存在丰富的固氮菌群,但根表、根表土壤和根围土壤3个样本的菌群分布差异较大;蓝藻菌门和变形菌门为巨菌草根系固氮菌的主要门类;慢生根瘤菌属、芽孢杆菌属、科萨克氏菌属为核心属.而本团队前期研究表明,巨菌草中存在丰富的内生固氮菌群,其中,克雷伯氏菌属细菌占比最高[12].这表明巨菌草根系固氮菌群组成和分布与内生固氮菌有较大区别.通过无氮培养基从巨菌草根表、根表土壤和根围土壤中分别分离获得4.5×105、4.0×104和5.4×103CFU·g-1固氮菌,根表的固氮菌群种类和数量明显高于其他两个样本.这表明相对于土壤,固氮菌可能更趋向富集于植物根表,以增强与植物的互作效应,促进植物生长;根表可成为巨菌草根系固氮菌特定种类的重要来源.从3个样本中分离到15株固氮菌,经SDS-PAGE全细胞蛋白电泳聚类分析将其分为7个类群,结合生理生化特性及溶磷和产铁载体能力测定,最终选定2#和4#菌株作为巨菌草根系的代表固氮菌.经16S rDNA序列鉴定,2#和4#菌株分别为科萨克氏菌和枯草芽孢杆菌;经玉米水培和盆栽试验验证,这两株菌株均具有一定的促生性能,有利于玉米株高、根长、分根数的增加.科萨克氏菌和枯草芽孢杆菌是近年来报道较多的对玉米具有良好促生作用的根际固氮菌[21-22],研究主要集中在这两种菌的生物学特性和促生性能,有关其实际固氮效率和安全性能还有待进一步研究.

