马来腈修饰的钡离子荧光传感器
(德州学院 化学化工学院,山东 德州 253023)
随着社会发展,金属离子污染问题已引起全球的共同关注,亦是我国经济和社会可持续发展所面临的问题之一。例如铅、镉、汞等金属在工业生产中具有广泛的应用,当以阳离子形式随工业废水排放到自然界后,对整个水系污染严重,给生态系统和人类生存环境造成巨大危害。与有机污染物不同,金属离子不能被降解,一旦被排放到环境中就很难自消除,且在食物链的生物放大作用下,可成千倍地富集,最后进入人体导致重金属中毒,对身体造成严重伤害。因此,工业废水金属离子的去除非常必要,发展高效、便捷的水中金属离子检测方法对化学化工、环境科学及生命科学等具有重要意义。
在诸多检测方法中,荧光检测已成为研究的热点之一[1-2]。与其他分析测试技术相比,荧光分子探针具有选择性好、成本低、易操作等优点,且通常以独立的分子状态分散于被检测体系中并发出检测信号,在单分子水平上实现了原位、实时检测,分析结果灵敏、精确[3-5]。基于不同的检测需求,人们已制备了数目众多、功能各异的荧光分子探针[6-8]。但目前已报道的Ba2+荧光分子探针较少[9-10],开发灵敏、易于制备的检测Ba2+的荧光分子探针是当前各监测领域的迫切需求。
在荧光分子探针构筑过程中,离子受体设计一般选择含较强配位能力的N、O、S等原子的基团作为金属离子结合位点,通过特定连接方式使其与信号基团桥连,得到灵敏检测金属离子性能的荧光分子探针[11-13]。易于合成的亚胺(—C=N—)基团具有较强的金属配位能力,与荧光基团连接后的p-π共轭作用可增加荧光分子的共轭性;当—C=N—基团中氮原子与金属离子配位后,可导致荧光分子共轭度变化,从而表现出灵敏的光谱信号变化[14-15]。鉴于此,结合二氨基马来腈对金属离子较强的络合性能[16-17],本实验用二氨基马来腈和对氰基苯甲醛合成氰基苯-马来腈希夫碱化合物,并探讨其对金属离子的荧光检测性能,特别是对Ba2+的荧光“关-开”检测性能。
1 实验部分
1.1 试剂与仪器
所用试剂均为市售分析纯或化学纯,未经过进一步提纯;实验所用各种金属盐由上海国药试剂公司提供;核磁共振氢谱(hydrogen nuclear magnetic resonance,HNMR)用Bruker DPX 400 MHz 核磁谱仪测试;元素分析用Elementar Vavio El Ш分析仪测试;红外光谱(infrared spectroscopy,IR)用傅立叶变换红外光谱仪测试;紫外吸收光谱用U-4100光谱仪完成;稳态荧光在日立F-4500荧光光度计上操作。试样在1.00 cm 石英荧光杯中测量,所有实验均在25 ℃下操作。
1.2 对氰基苯-马来腈希夫碱荧光分子探针的制备

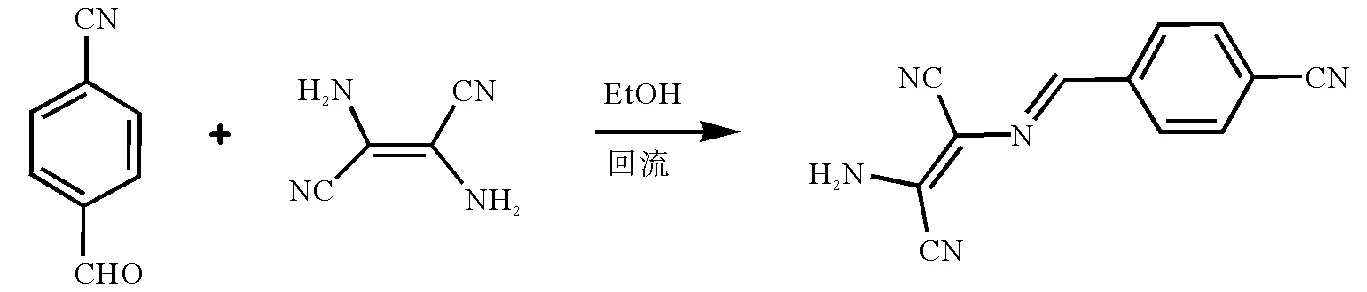
图1 对氰基苯-马来腈希夫碱分子合成示意图Fig. 1 Synthesis of p-cyanobenzaldehyde-diaminomaleonitrile-based Schiff compound
1.3 光谱实验溶液配制
称取0.2 mmol的对氰基苯-马来腈希夫碱,将其移入10 mL容量瓶后用5%水-乙腈混合溶剂定容配制成浓度为2×10-3M的母液;准确称取一定量的Zn(NO3)2·6H2O、CdCl2·5/2H2O、MnCl2·4H2O、CuCl2·2H2O、NiCl2·6H2O、Pb(NO)2、CoCl2·6H2O、FeCl3·7H2O、CaCl2、BaCl2、NaCl、Mg(SO4)2、AlCl3、KCl等金属盐溶于5%水-乙腈混合溶剂中,配成2×10-3M的金属盐母液。根据紫外吸收光谱,确定氰基苯-马来腈希夫碱最适测试浓度为40 μM;量取0.2 mL 2×10-3M马来腈希夫碱荧光分子的母液并置于10 mL容量瓶中,根据不同比例量取一定量的金属盐溶液分别放入上述容量瓶中,用5%水-乙腈混合溶剂稀释至10 mL。20 min后测定所配溶液的紫外吸收及荧光发射光谱,研究对氰基苯-马来腈希夫碱对所测金属离子的光谱学响应。
2 结果与讨论
2.1 金属离子选择性
为了研究对氰基苯-马来腈希夫碱化合物对金属离子的选择识别特性,以Li+、Na+、K+、Ca2+、Mg2+、Ba2+、Co2+、Pb2+、Mn2+、Ni2+、Cd2+、Cu2+、Zn2+、Al3+、Fe3+等金属离子作为研究对象,分别测试了该化合物在浓度为40 μM的5%水-乙腈混合溶剂中与10倍当量的不同金属离子混合后的荧光发射光谱性质。如图2所示,对氰基苯-马来腈希夫碱化合物在435 nm位置有一弱荧光发射峰;加入10倍当量的Ba2+后,其在435 nm的荧光发射明显增加、发射强度增加到1.92倍,同时伴随着19 nm红移到454 nm;其他金属离子如Li+、Na+、K+、Ca2+、Mg2+、Co2+、Pb2+、Mn2+、Ni2+、Cd2+、Cu2+、Zn2+、Al3+、Fe3+等加入后,该化合物在435 nm处最大荧光发射基本没有变化。上述数据表明对氰基苯-马来腈希夫碱化合物对Ba2+离子具有明显的荧光增强响应,具有荧光“关-开”型识别Ba2+的潜能。
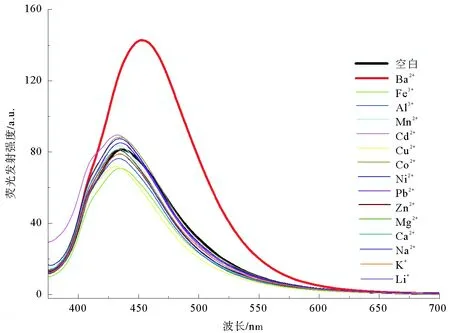
图2 对氰基苯-马来腈与不同金属离子作用后的荧光发射光谱Fig. 2 Fluorescence emission of p-cyanobenzaldehyde-diaminomaleonitrile-based compound after adding different metal ions
2.2 光谱滴定实验
鉴于对氰基苯-马来腈化合物对Ba2+的明显光谱学响应,在该化合物浓度为40 μM的5%水-乙腈混合溶剂中分别加入不同浓度的Ba2+,测试荧光发射光谱性质。如图3(a)所示:随着溶液中加入Ba2+的量从0增加到10倍当量时(浓度从40增加到400 μM),对氰基苯-马来腈在435 nm处最大荧光发射强度逐渐增强,并慢慢红移到454 nm;继续增加Ba2+浓度至20倍当量,其荧光发射光谱基本不变。根据Benesi-Hildebrand方程,加入的Ba2+在40~400 μM范围内,1/(F-Fmin)和1/[Ba2+]之间呈现良好的线性关系(y=0.000 352 595+0.077 31x,R2=0.999 35),F和Fmin分别为不同Ba2+浓度和未加Ba2+时的荧光强度,y=1/(F-Fmin),x=1/[Ba2+]。表明对氰基苯-马来腈与Ba2+之间可能为1∶1络合关系,如图3(b)。此外,还进行了对氰基苯-马来腈和Ba2+之间的荧光Job′s plot实验,横坐标[Ba2+]/([Ba2+]+[对氰基苯-马来腈化合物])为混合体系Ba2+的摩尔分数,纵坐标为对氰基苯-马来腈在454 nm处荧光发射强度,如图3(c)。由该图可清楚看到,在Ba2+摩尔分数为0.5处荧光最强,再次证实了对氰基苯-马来腈与Ba2+之间1∶1的络合关系,显示了二者之间可能的络合方式,如图3(d)[18]。对氰基苯-马来腈分子中氨基、亚胺基团较强的金属络合能力,结合Ba2+独特的电子结构特征,二者之间形成较稳定的配合物,抑制了对氰基苯-马来腈分子内转动等,导致其荧光发射增强。基于上述荧光滴定实验中对氰基苯-马来腈与Ba2+线性关系,根据公式D=3б/k(б是空白溶液标准偏差,样本数n=3;k是探针荧光发射强度与Ba2+浓度关系曲线的斜率),得出该探针化合物对Ba2+的检测底限为4.2 μM[19-20],显示对氰基苯-马来腈对Ba2+具有灵敏的检测潜能。
2.3 金属离子竞争实验
为了排除其他金属离子的干扰,在5%水-乙腈混合溶剂中,浓度为40 μM的对氰基苯-马来腈中同时加入10倍当量的Ba2+和其他不同金属离子,测试其荧光发射及紫外吸收光谱。如图4所示,马来腈希夫碱荧光分子中加入10倍当量的Ba2+后,其在454 nm位置有一强的荧光发射;当把Li+、Na+、K+、Ca2+、Mg2+、Co2+、Pb2+、Mn2+、Ni2+、Cd2+、Cu2+、Zn2+、Fe3+、Al3+等金属离子加入对氰基苯-马来腈-Ba2+混合体系后,其荧光发射光谱几乎没有变化,且混合体系的紫外吸收光谱也几乎没有变化,表明即使Ba2+与其他金属离子共存时,对氰基苯-马来腈仍对Ba2+表现出良好的选择检测性能。

图4 对氰基苯-马来腈中Ba2+与其他金属离子共存时的光谱Fig. 4 Optical properties of p-cyanobenzaldehyde-diaminomaleonitrile-based compound under the coexistence of Ba2+ with other metal ions
2.4 抗酸性光谱学研究
鉴于对氰基苯-马来腈化合物中含有对质子敏感的亚胺氮原子,研究了该化合物在浓度为40 μM的5%水-乙腈混合溶剂中分别加入不同当量比例HCl时的光谱学性质。如图5(a)所示,随着加入HCl浓度增加,从0增到10,甚至500倍当量(pH=7~4.8)时,对氰基苯-马来腈化合物荧光发射光谱没有明显变化。之后,对氰基苯-马来腈化合物中加入10倍HCl和Ba2+时的荧光发射光谱,如图5(b)所示,对氰基苯-马来腈化合物中加入10倍当量的HCl时,其荧光发射光谱基本没有变化;但对氰基苯-马来腈-HCl-Ba2+(三者当量比1∶10∶10))混合体系荧光增强且红移,与对氰基苯-马来腈-Ba2+混合体系荧光光谱类似,表明该化合物具有识别酸性环境(pH=4.8~7)下Ba2+的潜能。
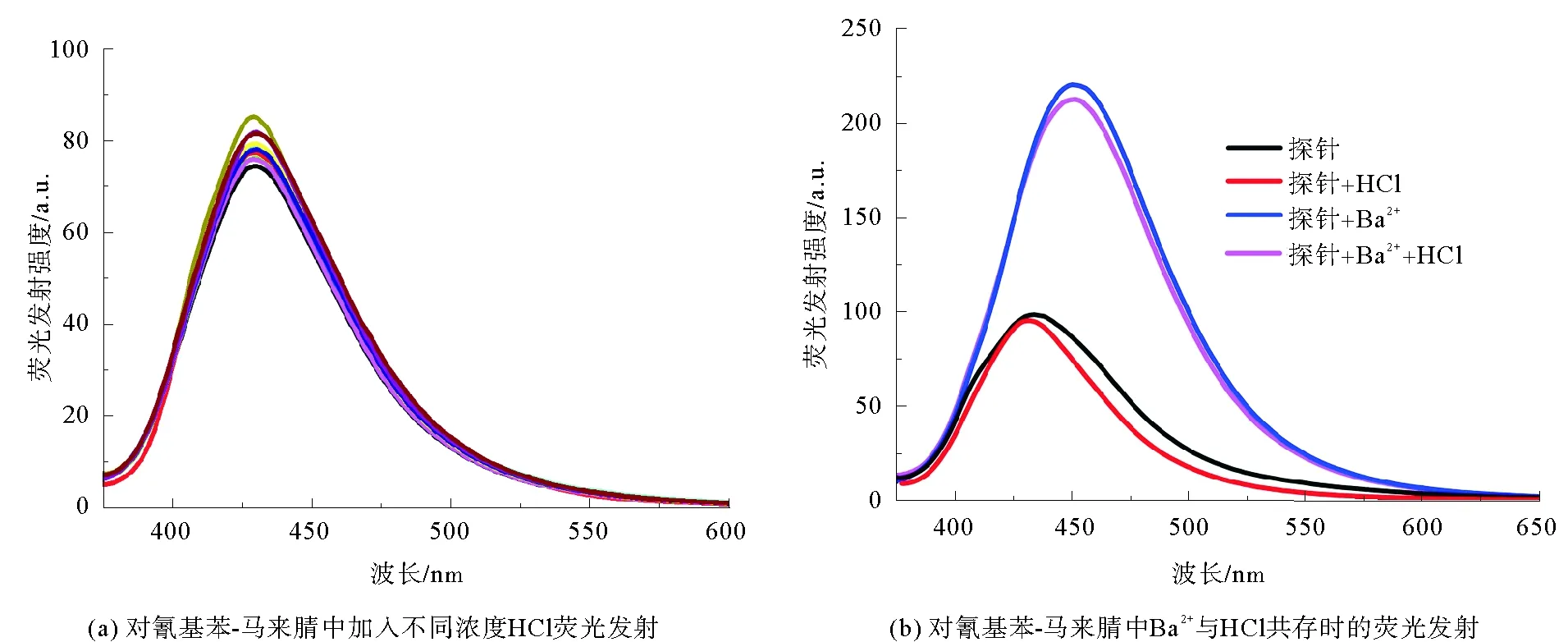
图5 对氰基苯-马来腈在不同浓度HCl及HCl与Ba2+共存时的荧光发射光谱Fig. 5 Fluorescence changes of p-cyanobenzaldehyde-diaminomaleonitrile-based compound along with the increasing HCl or HCl-Ba2+ coexistence
3 实际水样检测
为了进一步探索对氰基苯-马来腈化合物在实际水样中对Ba2+的应用潜力,采集了德城区域徒骇河和自来水2种实际水样,通过膜预处理除去悬浮物,并通过原子吸收光谱法确定所取水样中没有Ba2+,然后在实际水样中加入不同量的Ba2 +,计算其回收率。结果如表1所示,对氰基苯-马来腈化合物对Ba2+的回收率为99%~102%,表明对氰基苯-马来腈化合物对实际水样中Ba2+的分析检测具有较高的准确度及广泛的应用前景[21]。
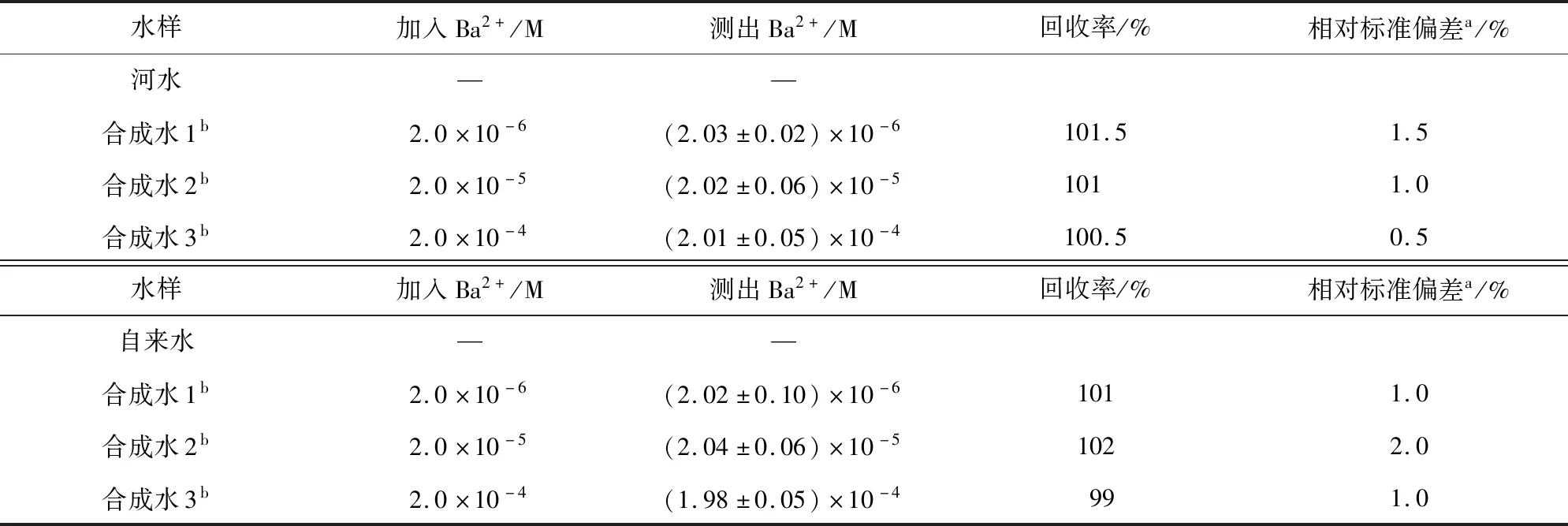
表1 对氰基苯-马来腈对河水或自来水中钡离子实际检测性能Tab. 1 Detection of p-cyanobenzaldehyde-diaminomaleonitrile-based compound for Ba2+ from river/tap water samples
4 结论
研究了对氰基苯-马来腈希夫碱荧光分子对不同金属离子的光谱学识别性能。通过详细的光谱学性质研究得知:对氰基苯-马来腈希夫碱中加入Li+、Na+、K+、Ca2+、Mg2+、Co2+、Pb2+、Mn2+、Ni2+、Cd2+、Cu2+、Zn2+、Al3+、Fe3+等金属离子时,其荧光发射光谱学性质基本不变;Ba2+存在时,该化合物荧光发射强度增加了1.92倍,同时发生了19 nm红移,表现出对Ba2+良好的识别响应,检测底限为4.2 μM;且Ba2+在金属离子竞争及抗酸实验中具有出良好的竞争性。这些性质赋予对氰基苯-马来腈希夫碱灵敏检测中性及酸性环境中Ba2+的潜能。实际样品中的应用表明,对氰基苯-马来腈希夫碱可有效地用于实际水样中Ba2+的检测。

