梧州茶树种质资源的遗传多样性及亲缘关系分析
王留彬,黄丽蕴,滕翠琴,吴立赟,成浩,于翠平*,王丽鸳*
梧州茶树种质资源的遗传多样性及亲缘关系分析
王留彬1,黄丽蕴2,滕翠琴2,吴立赟1,成浩1,于翠平2*,王丽鸳1*
1. 中国农业科学院茶叶研究所/国家茶树改良中心,浙江 杭州 310008;2. 梧州市农业科学研究所,广西 梧州 543003
基于SSR标记对梧州六堡镇群体种和南渡镇野生大茶树种质资源的遗传多样性和亲缘关系进行了分析,并筛选出用于该种质资源鉴别的核心分子标记。研究结果如下:(1)17对SSR引物在供试材料中共扩增得到98个等位基因,每对SSR引物扩增的等位位点为3~8个,平均每个位点5.764 7个等位基因;(2)从17个SSR分子标记中筛选出8个核心标记组合即可区分每份种质资源;(3)六堡镇茶树种质资源的平均等位基因数(A)、基因型数、基因多样性(H)、多态性信息含量(PIC)分别为4.647 1、7.000 0、0.675 4、0.628 3,高于南渡镇野生大茶树种质资源,与栽培种茶树群体接近;(4)聚类分析表明,六堡镇茶树群体部分种质资源单独聚为一类,部分与云南的大叶种茶树,少量与浙江、贵州地方栽培种聚为一类;而南渡镇野生茶树种质资源单独聚为一类,仅有2个六堡镇的种质材料散落其间。综上所述,梧州茶树种质资源丰富,遗传多样性较高,研究结果为进一步开发和利用该资源奠定了基础。
SSR标记;遗传多样性;梧州市;茶树
广西地处华南地区,与云南、贵州相邻地区被认为是茶树的次生起源中心,凭借优越的生态和地理条件,蕴含十分丰富的茶树资源[1]。近年来,广西茶园面积和茶叶产量增长迅速,2019年,茶园面积为77.3 khm2,茶叶总产量为8.28万t[2],2020年,茶园面积达到91.3 khm2,茶叶总产量9.13万t[3]。课题组前期调查发现广西梧州市具有较多种类的群体种茶树资源,伴随产业的崛起,六堡茶群体种的重要性越发凸显。邱瑞瑾等[4]和覃秀菊等[5]分别研究了梧州市六堡茶群体种资源的分布和叶片显微结构。滕翠琴等[6]在梧州市南渡镇发现了集中成片的野生大茶树群落,并对其表型特征、生长环境等进行了调查。这些独特的种质资源在茶叶生产应用、品种创新以及维持物种多样性等方面具有重要的意义。目前,使用DNA分子标记对上述种质资源的研究尚少。
SSR分子标记作为群体遗传多样性和亲缘关系分析中的有效工具,已在茶树遗传学分析中广泛使用。如:Tan等[7]使用30对SSR标记分析了128份中国主栽无性系茶树品种间的遗传关系,证实了40余对茶树品种的亲子关系。周斌等[8]利用15对SSR引物对50份雷波县野生茶树资源进行了遗传多样性和亲缘关系分析,推测雷波地区附近可能是四川野生茶树的发源中心。余书平等[9]使用14对SSR标记对浙江开化县不同种质资源进行了分析,发现开化县茶树种质资源遗传多样性丰富。本研究通过17对SSR引物,分析了梧州六堡镇和南渡镇两个地区茶树种质资源遗传多样性,筛选出鉴定该种质资源的核心SSR标记。比较了两地区茶树种质资源的遗传信息和亲缘关系,并与多个栽培种进行比较,旨在解析梧州茶树种质资源的分子遗传背景,为将来梧州市优异资源的收集、保护和科学利用提供研究基础。
1 材料与方法
1.1 材料
19个无性系栽培(ZP)品种(表1)种植于中国农业科学院茶叶研究所嵊州基地,分别编号1~19,作为对照品种。以梧州市六堡镇(LB)大中村(111°22′E,23°48′N)的13个六堡茶群体种资源和梧州市南渡镇(ND)天龙顶(110°51′E,22°42′N,海拔600~700 m)采集的12个野生大茶树种质资源为试验材料,梧州市六堡镇大中村13个六堡茶群体种资源编号为20~32,叶片多样性较高,大、小叶类均有,以中叶类为主。梧州市南渡镇天龙顶的12个野生大茶树种质资源编号为33~44,树型为乔木型。所用材料详细信息及编号见表1。
1.2 DNA提取及检测
DNA的提取使用植物基因组提取试剂盒[DP350,天根生化科技(北京)有限公司],并使用超微量分光光度计(Nano Drop ND-1000,赛默飞世尔科技公司)检测DNA浓度和纯度,使用1%琼脂糖凝胶电泳检测DNA的完整性,对DNA质量不高或条带不清楚的DNA样品重新提取。将每份样品DNA稀释到30 ng·μL-1,放置于–20℃冰箱保存备用。
1.3 候选SSR引物的PCR扩增
从课题组已设计的SSR引物中[10]挑选多态性高、条带清晰的17对SSR引物(引物序列均已上传至NCBI)用于本试验,具体引物信息见表2。PCR反应体系:Reaction Mix 5.0 μL(含DNA Polymerase、2×PCR Buffer、MgCl2和dNTP),模板DNA 2.0 μL,Primer-F、Primer-R(10 ng·μL-1)各0.2 μL,加ddH2O至10 μL。PCR循环参数:94℃预变性4 min;94℃变性30 s,52~58℃退火30 s,72℃延伸30 s,共计35个循环;72℃延伸10 min;4℃保存。

表1 供试材料信息
1.4 扩增产物的PAGE电泳和银染显色
PCR扩增使用垂直电泳仪(CBS MGV-202-33,电压120 V,时间90 min)进行10%的聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE),具体配制方法参照文献[11]。电泳结束后进行银染显色,并用保鲜膜将胶片保存,拍照记录。
1.5 数据处理
将电泳图中位于目的片段范围内的清晰条带,依据分子量大小依次记作A、B、C、D……,因条带大小不同,基因型分别记录为AA、AB、BB、AC、AD、CD等(单一条带为纯合基因型,两个条带为杂合基因型),条带缺失记为“-”,计入Excel表,建立起原始基因型数据矩阵。利用GenAlEx 6.5.0.3软件[12]进行基因频率、杂合度、标记鉴别力等一系列遗传参数的运算。具体方法参照文献[9]处理方法。根据样本的基因型数据,将其转换成PowerMarker v3.25软件[13]要求的数据格式。基于“Nei.1983”计算样本间的遗传距离并进行UPGMA进化树构建。使用FigTreev1.2.4软件绘制UPGMA进化树。
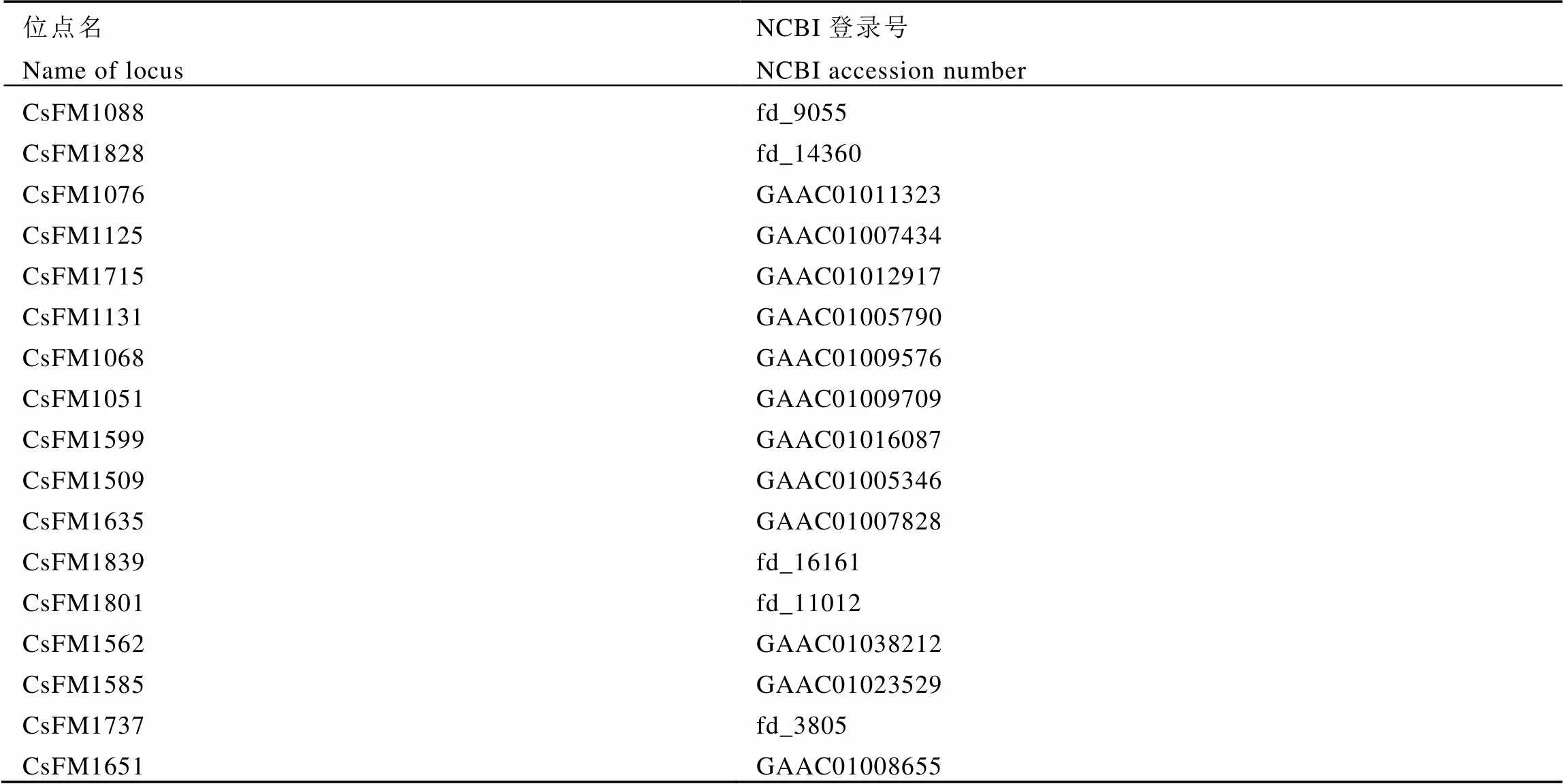
表2 17对SSR引物信息
2 结果与分析
2.1 44份茶树种质SSR标记多态性分析
本研究使用的17对引物呈现出较高水平的多态性(表3)。除3对引物(CsFM1051、CsFM1839、CsFM1562)扩增目的片段的成功率较低外,其余引物几乎均能在所有样品中成功扩增出目的片段。总体来看,17对SSR引物共获得98条等位基因,每对SSR引物扩增出的等位位点为3~8个,平均每个位点检测到5.764 7个等位基因,平均有效等位位点数为3.772 2个。在这些SSR分子标记中,CsFM1076扩增出的等位基因最少,仅3个。引物CsFM1131、CsFM1801、CsFM1585、CsFM1651、CsFM1715扩增的等位基因为7~8个,这5对引物的有效位点(Ne)均超过4个,说明它们在样品中扩增多态性较好,具有较强的鉴别能力。17对引物扩增位点的多态性信息含量(PIC)为0.315 7~0.803 9,平均值为0.655 1,也说明本研究选用的SSR引物多态性较好。
2.2 标记的鉴别能力
对基因分型数据进行复合位点分析,非同一概率值(PE)使用GenAlEx 6.5.0.3软件分析得到。结果如表4所示,17个SSR位点的PE-1值范围在0.172 8~0.654 7,平均值为0.478 2;PE-2值的范围在0.062 7~0.481 5,平均值为0.312 2;PE-3的范围为0.285 9~0.830 6,平均值为0.651 3。如图1所示,当17个SSR位点组合后,2个随机样本基因型组合不同的PE-1为1.000 0;若缺失1个位点和去除1个纯合位点时,2个随机样本基因型组合不同的概率PE-2和PE-3分别为0.998 7和1.000 0,该结果表明本研究选用的标记多态性较高,用17个SSR标记完全可以鉴定出所选用的每一份种质材料。
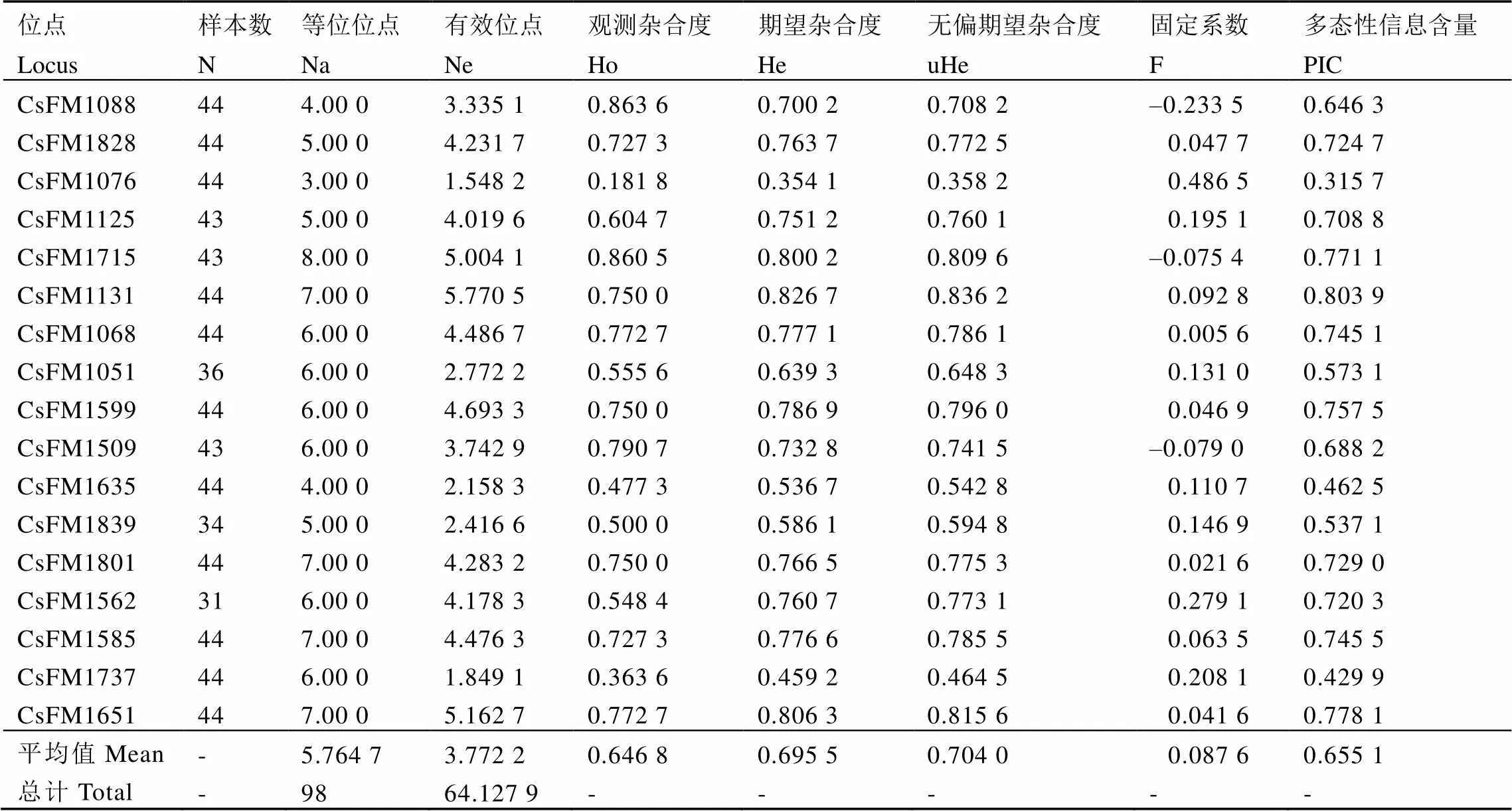
表3 17对SSR标记的遗传参数
研究结果显示,选用的SSR标记增多(图1),其PE值显著增加,材料的鉴定准确性亦显著提高。数据显示当选用8个核心标记时,PE-1、PE-2、PE-3分别超过了0.99、0.96、0.99,即可成功鉴别出每一份材料,因此将PE值排名最高的8个标记作为鉴定该种质资源的核心标记,分别是CsFM1828、CsFM1715、CsFM1131、CsFM1068、CsFM1599、CsFM1801、CsFM1585、CsFM1651。
2.3 2个不同地区茶树群体的遗传多样性
梧州的六堡镇大中村和南渡镇云龙顶相距约133 km。为探明两地茶树种质资源遗传多样性与遗传距离的差异,本研究将上述二地取样采集的茶树资源分别作为单独群体,并以19个栽培品种作为对照,进行遗传多样性分析。结果显示(表5),六堡镇茶树群体平均等位基因数为4.647 1个,基因型数为7.000 0,基因型多样性为0.675 4,杂合度为0.664 7,多态性信息含量为0.628 3。六堡镇茶树群体的平均等位基因、基因型数、基因多样性和多态性信息含量均接近于栽培种。南渡镇野生茶树群体的平均等位基因数(4.294 1)、基因型数(5.823 5)、基因多样性(0.600 9)、多态性信息含量(0.558 0)均小于六堡镇茶树群体,仅杂合度(0.664 9)略高于六堡镇茶树群体。
基于群体之间的遗传距离(表6),利用UPGMA聚类分析发现,六堡镇茶树群体与栽培种遗传距离最近为0.129 3,被聚为一类;南渡镇的野生茶树群体与他们的遗传距离较远(图2)。由此表明六堡镇茶树群体与栽培种亲缘关系较近,南渡镇茶树群体与六堡镇茶树群体、栽培种均有一定的遗传距离,这与南渡镇的茶树群体是野生大茶树的研究结果相一致。
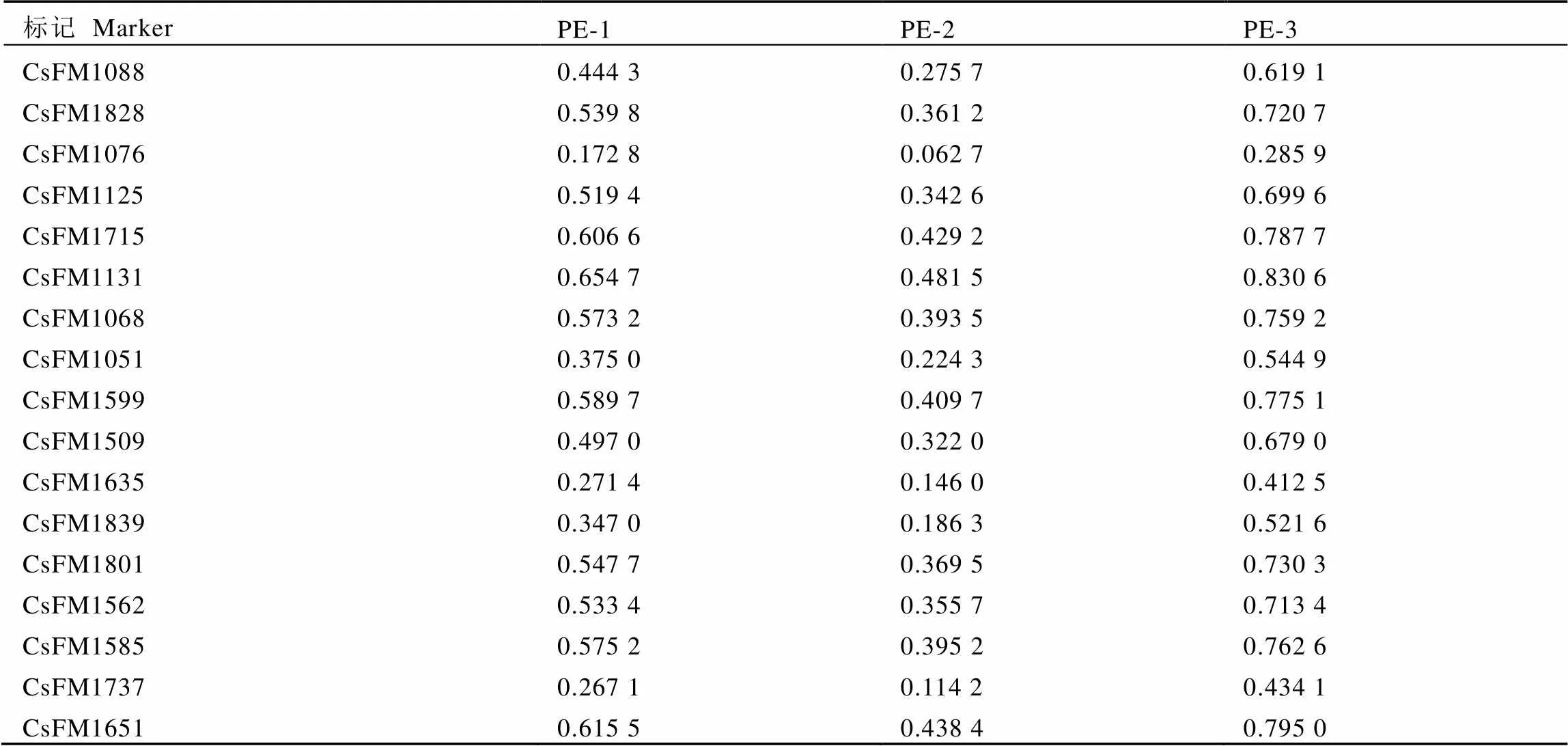
表4 17个SSR数据的PE值
注:PE-1表示位点未缺失时的PE值,PE-2表示缺失1个位点时的PE值,PE-3表示去除1个纯合位点的PE值。下同
Note: PE-1 represents PE value when one of locus is missing, PE-2 represents PE value when one locus is missing, PE-3 represents PE value when one of homozygous locus is removed. The same below
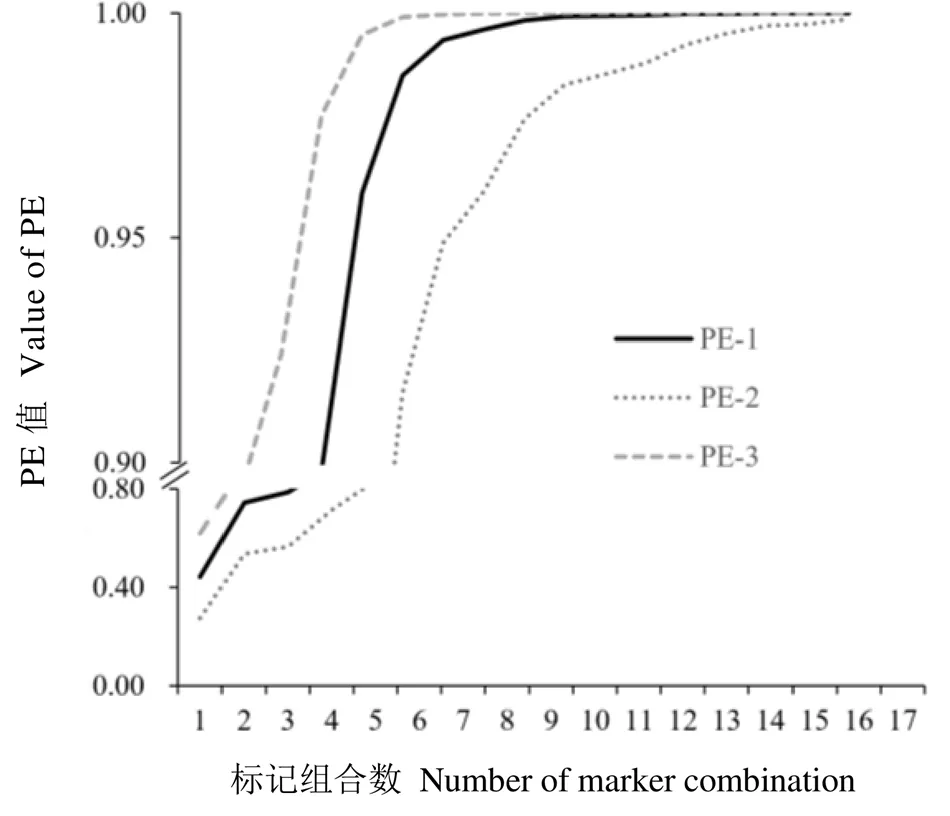
图1 不同标记组合数的PE值
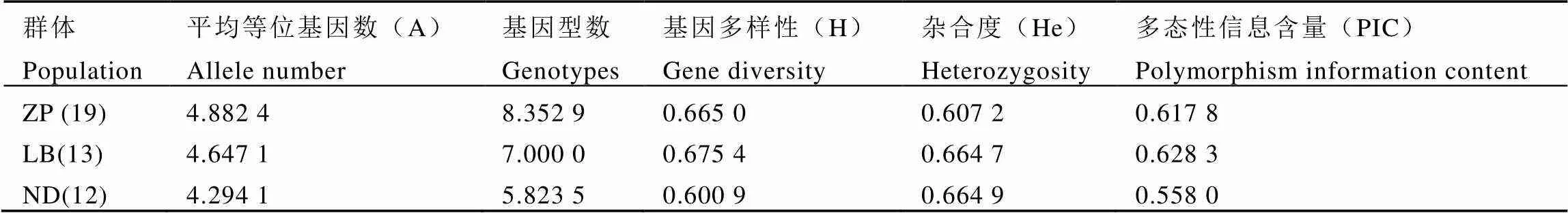
表5 3个茶树群体的遗传多样性分析
注:LB,六堡镇茶树群体;ND,南渡镇茶树群体;ZP,栽培种。下同
Note: LB, Tea plant populations in Liubao town. ND, Tea plant populations in Nandu town. ZP, Cultivar. The same below

表6 3个茶树群体的遗传距离

图2 3个茶树群体UPGMA聚类图
2.4 茶树种质资源个体间的聚类分析
为进一步了解梧州市茶树种质资源的遗传学地位,根据17对SSR引物扩增数据统计结果,基于Nei's遗传距离,采用UPGMA法聚类得到茶树聚类树状图,将茶树资源大致分为5个类群(图3)。其中类群1主要是六堡镇的LP2、LP3、LP4、LP5,说明它们具有较为相近的遗传背景。类群2主要为茶树栽培种,迎霜是福鼎大白茶和云南大叶种的杂交子代,它们具有亲缘关系[14],在本研究中聚在一类。类群3由部分六堡镇的种质资源和几个栽培种聚类而成,如LP9、LP1、LP8和大叶种的紫娟、英红1号、英红9号。类群4中,LP11、LP12和云抗10号,LP6、LP7、黔眉419和中黄1号分别聚在一类。类群5主要是来自南渡镇的野生大茶树,仅有2个六堡镇的LP10、LP13和南渡镇群体聚在一类。
3 讨论
3.1 梧州茶树种质资源的遗传多样性
茶树种质资源及遗传育种研究以遗传多样性为基础,茶树的遗传多样性研究已从最早的形态学标记转变为分子标记[15]。SSR分子标记技术已广泛使用在茶树遗传多样性及种质鉴定研究等方面[9]。徐礼羿等[16]使用8个核心SSR标记即可成功识别200份以上的茶树种质资源。本研究使用的17对标记即部分来源于上述SSR标记,部分来源于Tan等[7]开发的SSR标记,选取的17对引物均具有多态性。基于复合位点的非同一性分析发现,选用8个核心SSR标记组合时,便可实现对本研究的44份材料的准确识别。多态性信息量(PIC)为评价引物多态性的重要指标,当PIC>0.5时,该位点为高度多态位点;当0.25<PIC≤0.5时,该位点为中度多态位点;当PIC≤0.25时,该位点为低度多态位点[17];本研究使用的引物平均PIC为0.655 1,PIC>0.5的有14对,占总引物的82.35%;其余3对引物为0.25<PIC≤0.5,说明筛选的SSR标记具有较高的多态性,可较好地应用于茶树遗传图谱的构建、遗传多样性和亲缘关系分析等研究。
本研究以梧州市六堡镇群体种和南渡镇野生大茶树的种质为研究材料,通过DNA分子标记和聚类分析较为全面地研究了两地茶树资源的遗传多样性水平和亲缘关系。目前针对上述种质资源的研究较少,仅有周炎花等[18]选取了数个六堡镇茶树品种进行了研究,发现其遗传多样性较高。本研究发现六堡镇茶树群体种遗传多样性丰富(H:0.675 4,PIC:0.628 3),甚至超过栽培品种(H:0.665 0,PIC:0.617 8),这与本研究调查的六堡镇茶树群体表型特征多样性相符合;在聚类分析中,4个六堡镇群体种(LP2、LP3、LP4、LP5)单独聚为类群1,推测它们具有独特的遗传背景。以上结果表明,六堡镇群体种遗传多样性丰富,具有优异资源选育的潜力。
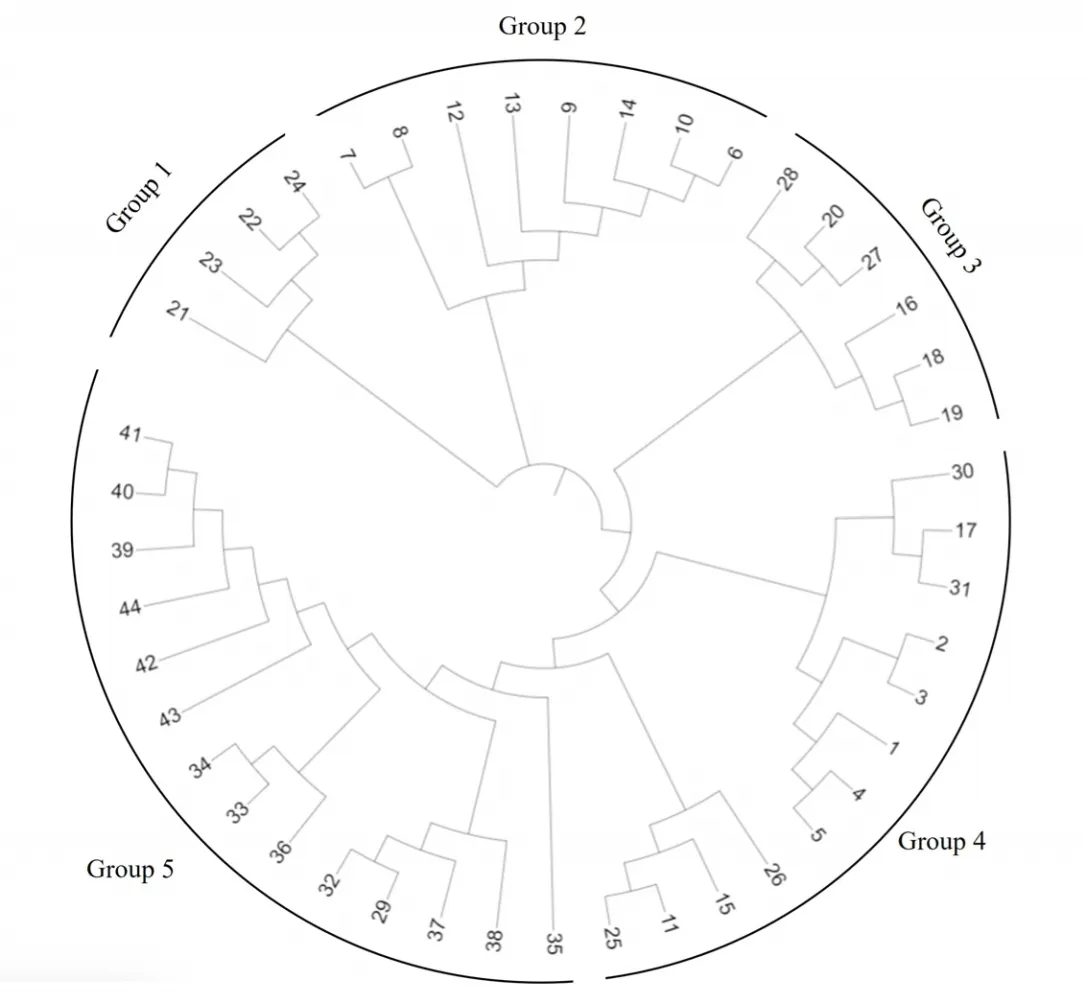
图3 茶树种质资源聚类分析
滕翠琴等[6]通过对野生大茶树的资源调查,发现南渡镇的野生大茶树是梧州市内面积最大的野生茶树资源。我们将从该地收集到的12个种质资源单独分析,发现其遗传多样性水平(H:0.600 9,PIC:0.558 0)接近云南茶树资源的遗传多样性水平(H:0.609,PIC:0.578),高于四川茶树资源的遗传多样性水平(H:0.525,PIC:0.492)[19],且杂合度(He:0.664 9)高于云南西双版纳地区野生茶树的杂合度(He:0.353)[20]。据此推断南渡镇野生大茶树的遗传多样性较高,具有非常重要的利用价值,为深入研究该地区野生大茶树提供了良好的种质资源。该地区野生大茶树的起源、分类是有待今后进一步探究的科学问题。
3.2 梧州市茶树种质资源的亲缘关系分析
基于Nei′s遗传距离,本研究中的44份供试茶树种质资源被分为5个类群,其中六堡镇茶树群体在5个类群中均有分布。如在类群3中,LP9、LP1、LP8、紫娟、英红1号和英红9号聚在了一起。在类群4中LP11、LP12和云抗10号聚在一起。紫娟和云抗10号均是大叶种茶树品种[14],英红1号和英红9号是由广东省农业科学院从云南省大叶种种质资源()中选育出来的茶树品种,同属于大叶种茶树品种[21]。在形态调查中也发现LP9、LP1、LP8、LP11、LP12具有大叶种茶树品种的表型特征,表明它们具有一定的亲缘关系。在其他类群中,六堡镇茶树群体与浙江、贵州等地的中小叶栽培种茶树具有较近的亲缘关系。
聚类分析结果表明,南渡镇天龙顶野生古茶树群体单独聚在一起,并与六堡镇的茶树种质资源和栽培种茶树具有一定的遗传距离,这与前人研究结果一致[22-23]。在个体聚类分析中,仅有来自六堡镇的LP10、LP13和南渡镇的天龙顶野生古茶树聚在了一起。这些研究结果表明野生种与栽培茶树品种在亲缘关系上存在较大的差异性。周斌等[8]同样发现雷波野生茶树与栽培种在亲缘关系上存在较大差异。前人的研究表明,基因交流是导致居群间茶树种质资源遗传分化的主要原因,长期的基因交流,会导致茶树资源分化程度较低,遗传多样性下降[24]。从本研究的结果看,南渡镇野生大茶树与六堡镇茶树群体、栽培种亲缘关系都差异较大,说明群体之间的基因交流较少,仍存在一定程度的分化。南渡镇野生大茶树群落周围树林密布,环境复杂,而茶树主要依靠昆虫授粉[23],推测复杂的环境和地理距离使该野生大茶树群落内长期自交。这有可能是该群体遗传多样性低于六堡镇茶树群体和栽培种遗传多样性的原因。
3.3 梧州市茶树种质资源的保护
本研究表明,梧州市茶树种质资源丰富,遗传多样性高,具有非常重要的利用价值。如六堡镇的部分茶树种质和南渡镇野生茶树资源与栽培种茶树亲缘关系较远,使用该群体的材料与栽培种茶树进行杂交育种可能会产生较好的杂种优势[25],这在茶树品种多样性方面具有积极的作用。此外由于市场需求,野生茶价格日益增高,导致对野生茶树过度和破坏性采摘,从而影响野生茶树资源的遗传多样性和种群规模。因此,需要进一步对梧州市内的茶树种质资源进行保护,如对该地区的野生优质资源进行扦插扩繁种植,建立资源圃持久保存等。
[1] 王新超, 陈亮, 杨亚军. 广西茶树资源生化成分多样性分析[J]. 植物遗传资源学报, 2010, 11(3): 309-314.
Wang X C, Chen L, Yang Y J. Biochenical diversity analysis of tea germplasms in Guangxi [J]. Journal of Plant Genetic Resources, 2010, 11(3): 309-314.
[2] 韦静峰, 刘晓东. 广西茶产业发展历程与展望[J]. 广西农学报, 2019, 34(4): 65-73.
Wei J F, Liu X D. The development course and prospect of Guangxi tea industry [J]. Journal of Guangxi Agriculture, 2019, 34(4): 65-73.
[3] 宁夏, 孔令政, 黄艳芳, 等. 乡村振兴背景下广西茶叶产业发展研究[J]. 热带农业科学, 2021, 41(8): 125-132.
Ning X, Kong L Z, Huang Y F, et al. Development of tea industry in Guangxi under the background of rural revitalization [J]. Chinese Journal of Tropical Agriculture, 2021, 41(8): 125-132.
[4] 邱瑞瑾, 龙志荣, 于翠平, 等. 六堡茶群体种资源的调查、开发和保护[J]. 中国茶叶加工, 2020(3): 15-19, 26.
Qiu R J, Long Z R, Yu C P, et al. Investigation, development and protection of population resources of Liupao tea [J]. China Tea Processing, 2020(3): 15-19, 26.
[5] 覃秀菊, 李凤英, 何建栋, 等. 广西茶树新品种品系叶片解剖结构特征与特性关系的研究[J]. 中国农学通报, 2009, 25(10): 36-39.
Qin X J, Li F Y, He J D, et al. The relations between the blade anatomical structure and characters of the new tea varieties in Guangxi [J]. Chinese Agricultural Science Bulletin, 2009, 25(10): 36-39.
[6] 滕翠琴, 邱瑞瑾, 于翠平, 等. 岑溪市野生古茶树资源特征与开发利用现状调查[J]. 南方农业, 2020, 14(4): 45-48.
Teng C Q, Qiu R J, Yu C P, et al. Investigation on the characteristics and exploitation of wild ancient tea tree resources in Cenxi city [J]. South China Agriculture, 2020, 14(4): 45-48.
[7] Tan L Q, Peng M, Xu L Y, et al. Fingerprinting 128 Chinese clonal tea cultivars using SSR markers provides new insights into their pedigree relationships [J]. Tree Genetics & Genomes, 2015, 11(5): 1-12.
[8] 周斌, 王留彬, 徐新涛, 等. 雷波野生茶树遗传多样性及亲缘关系分析[J]. 云南农业大学学报(自然科学), 2020, 35(1): 122-129.
Zhou B, Wang L B, Xu X T, et al. Analysis of genetic diversity and genetic relationship of Leibo wild tea resources [J]. Journal of Yunnan Agricultural University (Natural Science), 2020, 35(1): 122-129.
[9] 余书平, 徐礼羿, 吴荣梅, 等. 浙江开化县茶树种质资源的遗传多样性及亲缘关系分析[J]. 茶叶科学, 2020, 40(3): 341-351.
Yu S P, Xu L Y, Wu R M, et al. Genetic and phylogenetic analysis for resources offrom Kaihua County in Zhejiang Province [J]. Journal of Tea Science, 2020, 40(3): 341-351.
[10] Tan L Q, Wang L Y, Xu L Y, et al. SSR-based genetic mapping and QTL analysis for timing of spring bud flush, young shoot color, and mature leaf size in tea plant () [J]. Tree Genetics & Genomes, 2016, 12(3): 1-13.
[11] 黄丹娟. 我国茶树优良品种遗传多样性分析及指纹图谱构建[D]. 北京: 中国农业科学院, 2016.
Huang D J. Genetic diversity and fingerprinting of Chinese improved tea cultivars [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[12] Smouse P E, Whitehead M R, Peakall R. An informational diversity framework, illustrated with sexually deceptive orchids in early stages of speciation [J]. Molecular Ecology Resources, 2015, 15(6): 1375-1384.
[13] Liu K, Muse S V. PowerMarker: an integrated analysis environment for genetic marker analysis [J]. Bioinformatics, 2005, 21(9): 2128-2129.
[14] 黄海涛, 余继忠, 郑旭霞, 等. 茶树杂交新品系‘杭茶15号’的选育[J]. 茶叶, 2018, 44(3): 121-124.
Huang H T, Yu J Z, Zheng X X, et al. New tea cultivar ‘Hangcha 15’ breeding by hybrid [J]. Journal of Tea, 2018, 44(3): 121-124.
[15] 罗亦纾, 张霞, 毛君林, 等. 35份重庆大茶树种质资源遗传多样性的SSR分析[J]. 分子植物育种, 2019, 17(19): 6549-6557.
Luo Y S, Zhang X, Mao J L, et al. Analysis of genetic diversity in 35 ancient tea accessions from chongqing with SSR markers [J]. Molecular Plant Breeding, 2019, 17(19): 6549-6557.
[16] 徐礼羿, 王丽鸳, 苏静静, 等. 云南双江勐库大叶种茶树基因型和种群结构分析[J]. 植物遗传资源学报, 2019, 20(4): 1052-1064.
Xu L Y, Wang L Y, Su J J, et al. Genotyping and genetic structure analysis for 235 tea plant (var. assamica cv. MengKu-dayecha) in Shuangjiang of Yunnan Province [J]. Journal of Plant Genetic Resources, 2019, 20(4): 1052-1064.
[17] 李赛君, 雷雨, 段继华, 等. 基于EST-SSR的祁门种群体遗传多样性和亲缘关系分析[J]. 茶叶科学, 2015, 35(4): 329-335.
Li S J, Lei Y, Duan J H, et al. Analysis of genetic diversity and relationship of Qimen population of tea plants based on EST-SSR markers [J]. Journal of Tea Science, 2015, 35(4): 329-335.
[18] 周炎花, 乔小燕, 马春雷, 等. 广西茶树地方品种遗传多样性和遗传结构的EST-SSR分析[J]. 林业科学, 2011, 47(3): 59-67.
Zhou Y H, Qiao X Y, Ma C L, et al. Genetic diversity and structure of tea landraces from Guangxi based on EST-SSR analysis [J]. Scientia Silvae Sinicae, 2011, 47(3): 59-67.
[19] Yao M Z, Ma C L, Qiao T T, et al. Diversity distribution and population structure of tea germplasms in China revealed by EST-SSR markers [J]. Tree Genetics & Genomes, 2012, 8(1): 205-220.
[20] 杨金玲. 西双版纳地区古茶树种质资源的遗传多样性分析[D]. 昆明: 云南大学, 2018.
Yang J L. Genetic diversity analysis of ancient tea plants in Xishuangbanna area [D]. Kunming: Yunnan University, 2018.
[21] 卢嘉丽, 王冬梅, 苗爱清, 等. 英红1号、英红9号和祁门茶树芽叶中嘌呤生物碱和茶多酚的HPLC-DAD-MS/MS分析[J]. 中山大学学报(自然科学版), 2009, 48(1): 72-75.
Lu J L, Wang D M, Miao A Q, et al. HPLC-DAD-MS/MS analysis of purine alkaloids and tea polyphenols in young leaves of Yinghong1, Yinghong 9 and Qimen cultivars [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2009, 48(1): 72-75.
[22] 彭靖茹, 李朝昌, 檀业维, 等. 基于SSR分子标记的广西德保县和隆林县野生古茶树聚类分析[J]. 南方农业学报, 2019, 50(1): 1-7.
Peng J R, Li C C, Tan Y W, et al. Clustering analysis for wild ancient tea germplasm resources in Debao County and Longlin County, Guangxi based on SSR molecular markers [J]. Journal of Southern Agriculture, 2019, 50(1): 1-7.
[23] 黄厚宸, 蒋维昕, 梁彩霞, 等. 广西六堡茶古茶树及其子代遗传多样性的EST-SSR标记分析[J]. 分子植物育种, 2021, 19(7): 2410-2418.
Huang H C, Jiang W X, Liang C X, et al. EST-SSR-based analysis on genetic diversity of ancient Liupao tea trees and their progeny in Guangxi [J]. Molecular Plant Breeding, 2021, 19(7): 2410-2418.
[24] Yeh F C. Population genetic analysis of co-dominant and dominant marker and quantitative traits [J]. Belgian Journal of Botany, 1997, 130: 129-157.
[25] 姚雪倩, 叶乃兴. 杂种优势在茶树育种中的应用[J]. 茶叶学报, 2016, 57(3): 113-118.
Yao X Q, Ye N X. Application of heterosis for breeding tea plants [J]. Acta Tea Sinica, 2016, 57(3): 113-118.
Genetic and Phylogenetic Analysis for Germplasm Resources offrom Wuzhou City
WANG Liubin1, HUANG Liyun2, TENG Cuiqin2, WU Liyun1, CHENG Hao1, YU Cuiping2*, WANG Liyuan1*
1. National Centre for Tea Improvement, Tea Research Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 2. Wuzhou Institute of Agricultural Science, Wuzhou 543003, China
Based on the SSR markers, the genetic diversity and genetic relationship of the germplasm resources of tea plants from Liubao town and Nandu town were fully analyzed in this study. The core molecular markers for the efficient identification of these germplasm resources were successfully screened. The main results show that: (1) 98 alleles were amplified from 17 pairs of SSR primers, and each pair of SSR primers amplified 3-8 alleles, with an average of 5.764 7 alleles per locus. (2) Totally 8 core markers were selected from 17 SSR markers to distinguish each germplasm resource. (3) The average number of alleles (4.647 1), genotypes per marker (7.000 0), genetic diversity (0.675 4), and the polymorphic information content (0.628 3) of native tea trees in Liubao town were higher than wild tea trees in Nandu, and close to the cultivated population. (4) Cluster analysis shows that the majority germplasm resources from Liubao town were clustered together except for several tea plants grouped with large-leaf tea cultivars from Yunnan province and a few resources were grouped into the same cluster with tea cultivars from Zhejiang and Guizhou provinces. The wild tea germplasm resources from Nandu town were grouped into the same cluster with two germplasm materials from Liubao town.In conclusion, it was showed that there are rich tea germplasmresources with high genetic diversity in Wuzhou city. This study might lay a solid foundation for the further studies to develop and utilize these tea resources.
SSR marker, genetic diversity, Wuzhou city,
S571.1
A
1000-369X(2022)05-601-09
2022-03-23
2022-06-13
财政部和农业农村部:国家现代农业产业技术体系(CARS-19)、浙江省农业新品种选育重大专项(2021C02067-7)、创新驱动发展专项(桂科AA20302018-5)
王留彬,男,博士研究生,主要从事茶树种质资源与育种研究。*通信作者:yucp2018@163.com;wangly@tricaas.com

