不同来源ATP表征冷鲜羊肉新鲜度
苏媛媛,张德权,古明辉,张春娟,2,李少博,郑晓春,陈丽
不同来源ATP表征冷鲜羊肉新鲜度

1中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193;2宁夏大学食品与葡萄酒学院,银川 750021
【目的】通过系统研究冷鲜羊肉不同来源的三磷酸腺苷(adenosine triphosphate,ATP。包括肉中ATP、微生物ATP、肉表面ATP)在贮藏期间的变化规律,筛选能够表征冷鲜羊肉新鲜度变化的ATP指标,构建菌落总数和挥发性盐基氮预测模型,探究冷鲜羊肉新鲜度的预测新方法。【方法】以小尾寒羊背最长肌为试验材料,在空气密封包装0℃条件下分别贮藏0、1、3、5、7、9、11、13、15、17和21 d,分析冷鲜羊肉贮藏期间新鲜度指标(pH、色泽、挥发性盐基氮、菌落总数)与3种来源ATP(肉中ATP、微生物ATP、肉表面ATP)的变化,利用数据统计评价不同来源ATP的变化规律,并构建新鲜度指标的预测模型。【结果】冷鲜羊肉贮藏期间新鲜度指标菌落总数、挥发性盐基氮均呈现上升趋势,并均在贮藏17 d时超过国家标准限值;肉中ATP呈现不断下降趋势,微生物ATP与肉表面ATP均呈现上升趋势,与新鲜度指标变化趋势保持一致;冷鲜羊肉贮藏期间,肉中ATP、微生物ATP、肉表面ATP含量与菌落总数、挥发性盐基氮的相关系数()分别为-0.399、0.910、0.943和-0.357、0.725、0.907。肉表面ATP预测冷鲜羊肉菌落总数的最优模型为Boltzmann拟合模型,其公式为TVC(lg cfu/g)=7.649-4.069/(1+exp(x-5.807)/0.632)(2=0.903,<0.001),肉表面ATP预测冷鲜羊肉挥发性盐基氮的最优模型为Expedc1拟合模型,其公式为TVB-N(mg/100 g)=2.493*exp(x/3.745)+3.057(2=0.888,<0.001)。【结论】本研究明确了冷鲜羊肉表面ATP与菌落总数、挥发性盐基氮存在显著正相关性,确证了肉表面ATP可以作为冷鲜羊肉新鲜度表征指标;并构建了菌落总数和挥发性盐基氮最优预测模型,为冷鲜羊肉新鲜度快速检测提供了新的思路。
冷鲜羊肉;肉表面ATP;预测模型;新鲜度
0 引言
【研究意义】我国是肉类生产与消费大国,据国家统计局公布数据显示,2021年全国鲜、冷藏肉产量累计值高达3 298万 t,比2020年同比增长了24.5%[1],说明肉类产业正在不断地蓬勃发展,但冷鲜肉高蛋白质、高水分含量的特性导致其在流通贮藏过程中极易受到微生物侵染而腐败变质,产生食品安全和食品资源浪费等问题。新鲜度是评价冷鲜肉品质的重要指标,直接影响产品的货架期,但传统检测方法,如平板计数法、感官检测法等操作繁琐、耗时长、易受主观因素影响[2],因此,研发肉品新鲜度快速检测方法十分必要。【前人研究进展】三磷酸腺苷(ATP)是存在于各种微生物中的主要生物能源物质,含量相对稳定,能够反映活体微生物的数量[3]。ATP生物发光法是指在荧光素酶的催化下,细菌细胞内释放的ATP与荧光素反应产生生物荧光,进一步通过荧光检测仪等实时监测生物发光强度。ATP生物发光法由于检测快速、成本低、耗时短、操作简单等优点[4-8]而日益得到应用,比如检测桌面清洁度、医疗器械清洁度、饮用水卫生等[4,9-10]。Bautista[11]早在1999年就提出ATP生物荧光法在牛、猪、禽类熟食品检测方面的应用,指出菌落总数与微生物ATP荧光值之间相关系数在0.800—0.950。舒柏华等[12]利用线性模型构建冷鲜肉微生物ATP荧光对数值与菌落总数的相关性,得出其相关系数为0.980。RATPHITAGSANTI等[13]利用ATP荧光技术检测芽孢杆菌系统建立的菌落总数的预测模型相关系数均约0.900。WADHAWAN等[14]研究水凝胶珠中大肠杆菌ATP发光对数值与单一菌种数,得出其线性相关系数为0.940—0.960。李海月[15]通过在猪肉表面接种肠致病性大肠埃氏杆菌,建立ATP发光强度与菌落浓度的关系,其线性相关系数为0.950。DA BAUTISTA等[16]利用ATP生物荧光法检测禽类胴体表面清洁度,通过回归分析得出表面ATP发光强度对数值与菌落总数相关系数为0.670。OTO等[17]通过荧光光谱检测猪肉表面清洁度,利用偏最小二乘回归法建立猪肉表面ATP含量与菌落总数之间的模型,其效果良好(2=0.940—0.970)。以上研究均证明ATP与菌落总数之间存在显著正相关性,从而在一定程度上可实现对肉品新鲜度的检测。但是,食品的复杂体系在很大程度上限制了ATP生物荧光法在食品新鲜度检测方面的应用,尤其是对于冷鲜肉新鲜度的检测。【本研究切入点】冷鲜肉体系复杂,冷鲜肉中ATP根据取样手段,可分为肉中ATP、微生物ATP和肉表面ATP。其中,肉中ATP为冷鲜肉中总ATP含量;微生物ATP仅包含冷鲜肉中微生物的ATP含量;肉表面ATP是通过涂抹拭子取样获得的,包括微生物ATP和部分体细胞ATP,上述3种ATP含量在冷鲜肉贮藏期间的变化及其与新鲜度之间的关系缺乏系统报道。【拟解决的关键问题】本研究拟系统通过探究冷鲜羊肉不同来源ATP在贮藏期间的变化规律,筛选能够表征冷鲜羊肉新鲜度变化的ATP,构建菌落总数和挥发性盐基氮预测模型,为冷鲜羊肉新鲜度的检测方法提供新思路。
1 材料与方法
试验于2021年9月至2022年1月在中国农业科学院农产品加工研究所实验室进行。
1.1 材料与主要试剂
羊肉来源:北京二商穆香源清真肉类食品有限公司选取胴体重、饲养条件相近、性别相同、健康无病的小尾寒羊共6只,屠宰后4℃冷却成熟24 h后,从胴体上取下两侧背最长肌,3 h内运回实验室待用。
主要试剂:三磷酸双磷酸酶(上海源叶生物科技有限公司)、ATP二钠、Trixon-100(北京长峰科远科技发展有限公司)、轻质氧化镁(北京普益华科技有限公司)、平板计数琼脂(北京陆桥技术股份有限公司)、BacTiter-Glo™ Microbial Cell Viability Assay(北京照生莱博商贸有限公司)、ATP含量检测试剂盒(北京高教研科技有限公司)。
1.2 仪器与设备
Testo 205便携式pH计(德国德图公司),无菌采样拭子/棉签试管(北京大宏利辉生物科技中心),SpectraMax190全波长酶标仪(美国Molecular Devices公司),CM-600D色差计(柯尼卡-美能达办公系统(中国)有限公司),JYH-66恒温恒湿培养箱(上海跃进医疗器械有限公司),垂直单向流洁净工作台(苏州安泰空气技术有限公司),SQ810C 高压蒸汽灭菌器(上海雅马拓科技贸易有限公司),KJELTEC 2300全自动凯氏定氮仪(丹麦FOSS集团有限公司),DHP-600恒温恒湿培养箱(天津市中环实验电炉有限公司)。
1.3 试验设计
取双侧背最长肌,均匀分割,约200 g/块。每条背最长肌分割为6块,共计制得6×2×6=72个样品,每个样品分装并使用PP5聚丙烯塑料盒进行空气密封包装(包装盒规格23 cm×13 cm×4 cm,包装膜厚度100 μm,透氧性<2 cm3∙m-2·d-1,透湿性<5 g∙m-2·d-1,大约400 mL气体空间)后,于(0±0.5)℃条件下贮藏0、1、3、5、7、9、11、13、15、17、19和21 d;处理当天开始,每个测量时间点随机取出6个样品进行试验,测定其色泽、菌落总数、挥发性盐基氮等新鲜度指标及肉中ATP含量、微生物ATP含量、肉表面ATP含量的变化情况。
1.4 新鲜度指标测定
1.4.1 pH 参考Szerman等[18]的方法,用便携式pH计进行pH测定,pH计探头插入肉块深度约为2 cm,选取3个不同位置进行测定,结果取平均值。
1.4.2 色泽 参考LI等[19]的方法,用色差计对肉色指标进行测定。在每个样品表面随机选择4个位点进行测定,结果取平均值。L*值表示肌肉的亮度,a*值表示肌肉的红度值,b*表示肌肉的黄度值。
1.4.3 菌落总数(TVC) 菌落总数的检测采用《GB4789.2—2016 食品安全国家标准食品微生物学检验菌落总数测定》中规定的方法进行测定。
1.4.4 挥发性盐基氮(TVB-N) 挥发性盐基氮的检测采用国标《GB5009.228—2016食品安全国家标准食品中挥发性盐基氮的测定》中规定的自动凯氏定氮法进行测定。
1.5 冷鲜羊肉ATP含量
1.5.1 冷鲜羊肉中ATP含量 称取0.100 g肉样,加入1.500 mL ATP提取液,冰上匀浆后,4℃、8 000×离心10 min后,取上清液1 mL加入500 µL三氯甲烷,混匀,4℃、1 000×离心3 min后,取上清液待测。在340 nm处测定吸光度值A1,然后将测试样品放入37℃恒温培养箱3 min后,在340 nm处测定吸光度值A2。根据公式计算肉中ATP含量,公式如下:肉中ATP含量(µmol∙g-1)=(A2-A1)/((A2标准管-A1标准管)/C标准)×V/W,式中,ATP标准液为5 mg ATP加入0.826 mL ATP提取液得到,V表示加入的ATP提取液体积(mL),W表示肉样质量(g)。
1.5.2 微生物ATP含量 首先建立标准曲线,超纯水溶解ATP二钠配置成10-2mol∙L-1的标准溶液,再分别稀释成10-6—10-12mol/L浓度的ATP工作液。依次取上述不同浓度ATP工作液100 µL加入酶标板内,加入等体积BacTiter-GloTM检测液,混匀后即刻检测。其次进行样本处理:
(1)体细胞ATP清除:取测定菌落总数的匀浆液1 mL,加入0.200%的聚乙二醇辛基苯基醚(TritonX- 100)和0.100%的三磷酸腺苷双磷酸酶(apyrase)混合液1 mL,在室温下孵育10 min。然后置于沸水浴中1 min以灭活apyrase。
(2)ATP检测:将上述处理后的检样放置至室温,离心(3 000×,5 min),取100 µL上清液加入酶标板中,加入等体积BacTiter-GloTM检测液,混匀后即可检测。用无菌生理盐水作空白对照,按标准曲线法计算ATP含量。
1.5.3 肉表面ATP含量 取冷鲜羊背最长肌200 g,使用6只无菌涂抹拭子在肉块表面选定好的6个区域(5 cm2)按照圆形模板涂抹20 s左右,混装入无菌袋,加入90 mL生理盐水制成原液。均质拍打处理后,取100 µL上清液利用BacTiter-GloTM微生物细胞活性检测试剂盒进行肉表面ATP的测定。
1.6 数据处理方法
数据使用Excel 2013软件整理,采用XLSTAT插件对TVC、TVB-N、冷鲜羊肉不同来源ATP进行画图趋势分析;采用IBM SPSS 21.0软件中Duncan’s多重检验进行显著性分析,结果以“平均值±标准差”表示;采用IBM SPSS 21.0软件中的Pearson相关性分析冷鲜羊肉不同来源ATP与TVC、TVB-N的相关性;采用Origin 2019对TVC、TVB-N以及不同来源ATP数据进行数学模型拟合,建立预测模型。
2 结果
2.1 冷鲜羊肉贮藏期间新鲜度指标变化趋势
2.1.1 冷鲜羊肉贮藏期间色泽和pH的变化 肉色和pH均可在一定程度上表征肉品新鲜度。随贮藏时间延长,L*值、a*值、b*值均呈现先上升后下降趋势。L*值与肉样表面自由水的多少有关系,贮藏前期,肉表面渗水使肉样对光的反射能力增强,L*值增大。L*值最高点出现在贮藏15 d,其值为45.55。生鲜羊肉在贮藏15 d后,L*值呈现下降趋势。在贮藏初期,氧合肌红蛋白的含量增加,使肉样呈现鲜红色,随贮藏时间延长,a*值不断升高,在贮藏第7天时,a*值出现峰值,其值为14.53。在贮藏后期,a*值呈现下降趋势。b*值和氧合肌红蛋白与肌红蛋白的相对比值有关,比值越大,b*值越大[20]。贮藏前期,冷鲜羊肉与氧气结合,肌红蛋白被氧化生成氧合肌红蛋白,b*值不断升高,其最高点出现在贮藏15 d,b*值为13.71。贮藏后期,肉色劣变,b*值呈现下降趋势并在后期趋于稳定。
冷鲜羊肉pH随着贮藏时间的延长,整体先上升后趋于稳定。冷鲜羊肉在贮藏0—11 d,pH逐渐上升,贮藏11 d时pH显著升高(<0.05)。贮藏11 d后,羊肉pH出现波动,但整体趋于平稳,在21 d时,羊肉pH为6.02(表1)。
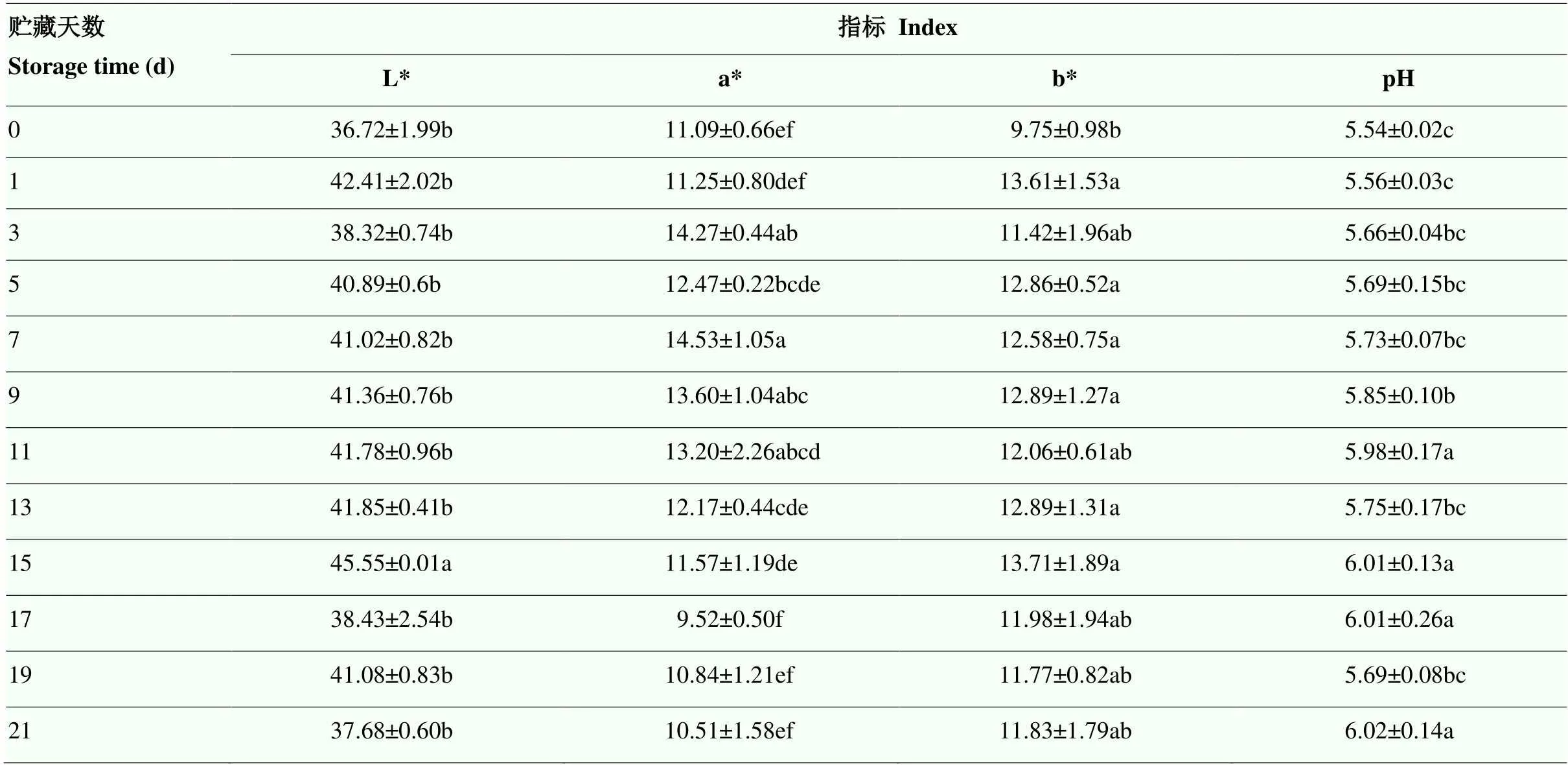
表1 冷鲜羊肉贮藏期间色泽和pH的变化
不同小写字母表示不同贮藏时间差异显著(<0.05)
Different lowercase letters indicate significant difference at different storage time (<0.05)
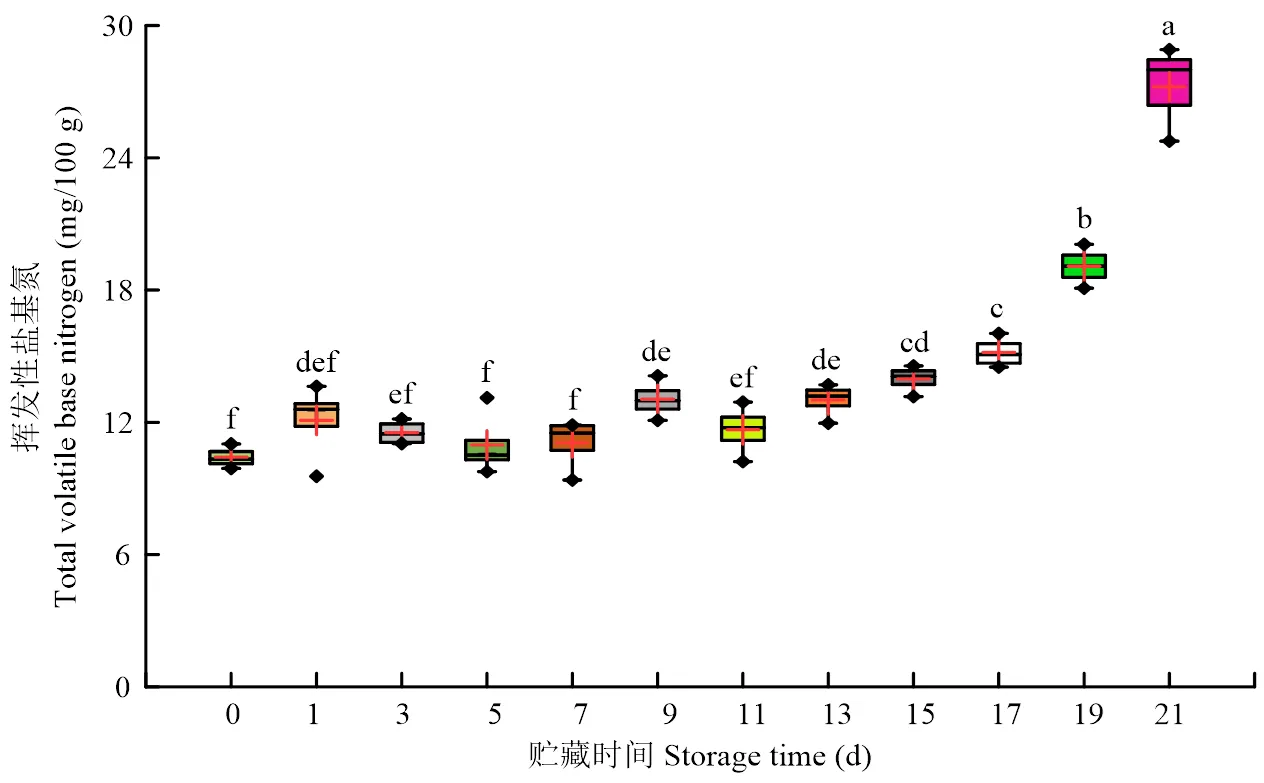
2.1.2 冷鲜羊肉贮藏期间TVB-N和TVC的变化 冷鲜羊肉TVB-N在贮藏期间整体呈上升趋势(图1)。在贮藏15 d内TVB-N呈缓慢上升趋势(>0.05),贮藏17 d后上升趋势显著。TVB-N在贮藏17 d时为15.170 mg/100 g,超过国家标准《GB2707—2016食品安全国家标准鲜(冻)畜、禽产品》中规定的限值15 mg/100 g,冷鲜羊肉已不能食用。冷鲜羊肉贮藏期间TVC的结果如图2所示,冷鲜羊肉TVC随贮藏时间延长显著上升,由初始菌落总数3.180 lg CFU/g上升至贮藏21 d的7.100 lg CFU/g。冷鲜羊肉贮藏17 d时TVC为6.160 lg CFU/g,已经超过6 lg CFU/g,这与羊肉贮藏过程中TVB-N的变化情况相符。
2.2 冷鲜羊肉贮藏期间不同来源ATP含量变化
2.2.1 ATP含量变化 冷鲜羊肉贮藏期间肉中ATP浓度的变化结果如图3所示,随贮藏时间延长,冷鲜羊肉中ATP含量在贮藏3 d后显著下降(<0.05),贮藏5—21 d冷鲜羊肉ATP含量差异不显著(>0.05),以较低水平保持平稳。
不同小写字母表示不同贮藏时间差异显著(P<0.05)。下同
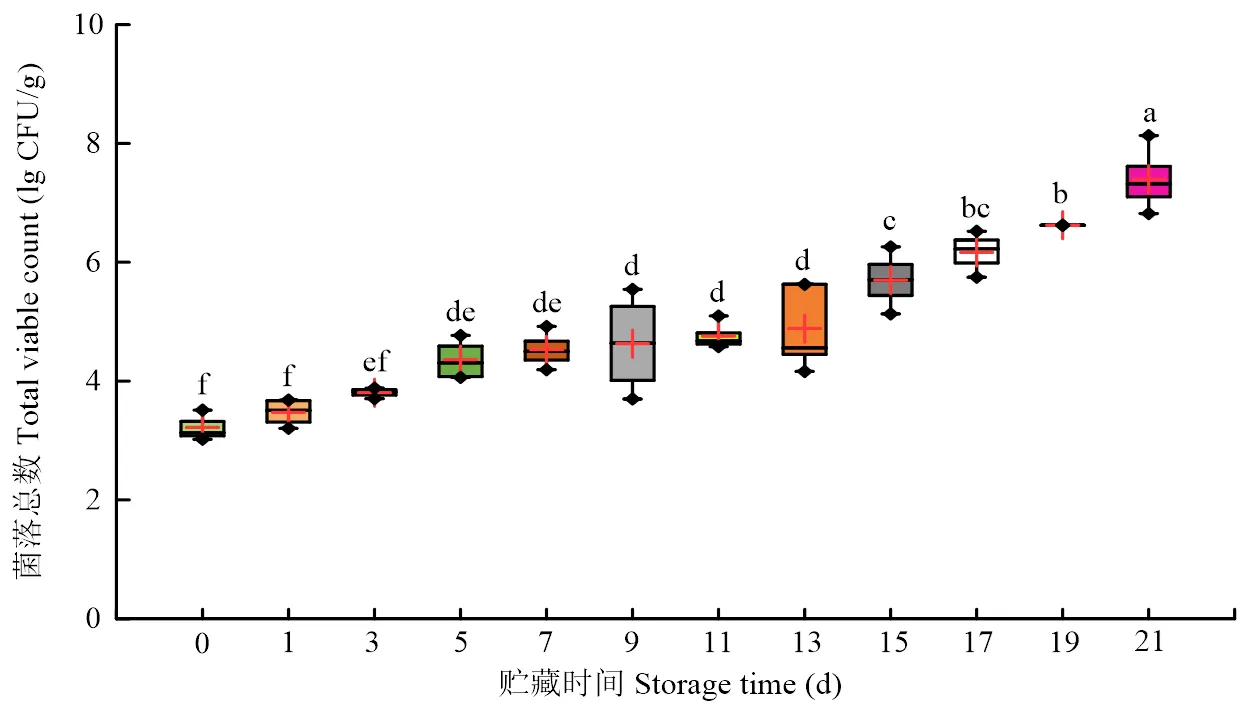
图2 冷鲜羊肉贮藏期间菌落总数变化
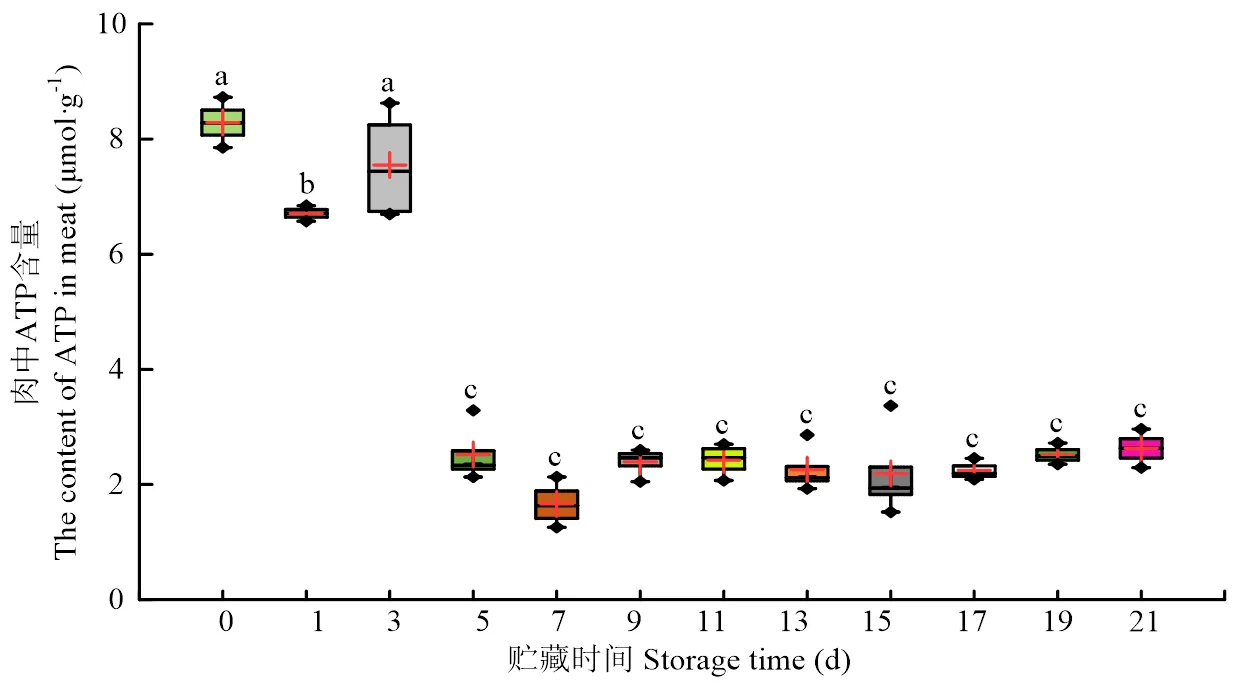
图3 冷鲜羊肉贮藏期间肉中ATP含量变化
2.2.2 冷鲜羊肉贮藏期间微生物ATP和肉表面ATP含量变化 制备ATP系列浓度分别为1011、1010、109、108、107、106、105、104和103fmol/L的标准工作液并测定其发光强度,以ATP浓度的对数值lg(ATP)为横坐标,以相应发光强度的对数值lg(RLU)为纵坐标,所得标准曲线见图4,标准曲线方程为=0.389+2.542(2=0.995)。
随着贮藏时间延长,微生物ATP含量和肉表面ATP含量均呈上升趋势(<0.05);贮藏0 d时微生物ATP含量为10-1.260fmol/L,肉表面ATP含量为102.750fmol/cm2。微生物ATP在贮藏15 d时显著上升,含量为103.340fmol/L。肉表面ATP在贮藏17 d时显著上升,含量为106.425fmol/L。贮藏21 d时微生物ATP含量与肉表面ATP含量均达到最大值,分别为103.990fmol/L和107.014fmol/cm2(图5、图6)。
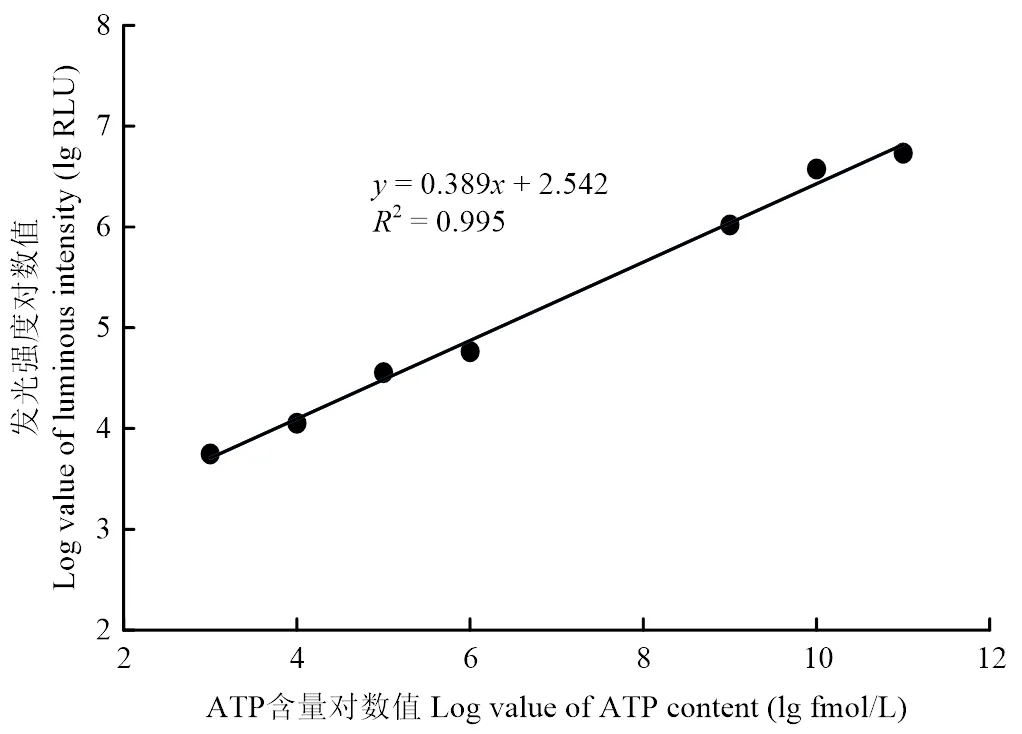
图4 ATP标准曲线
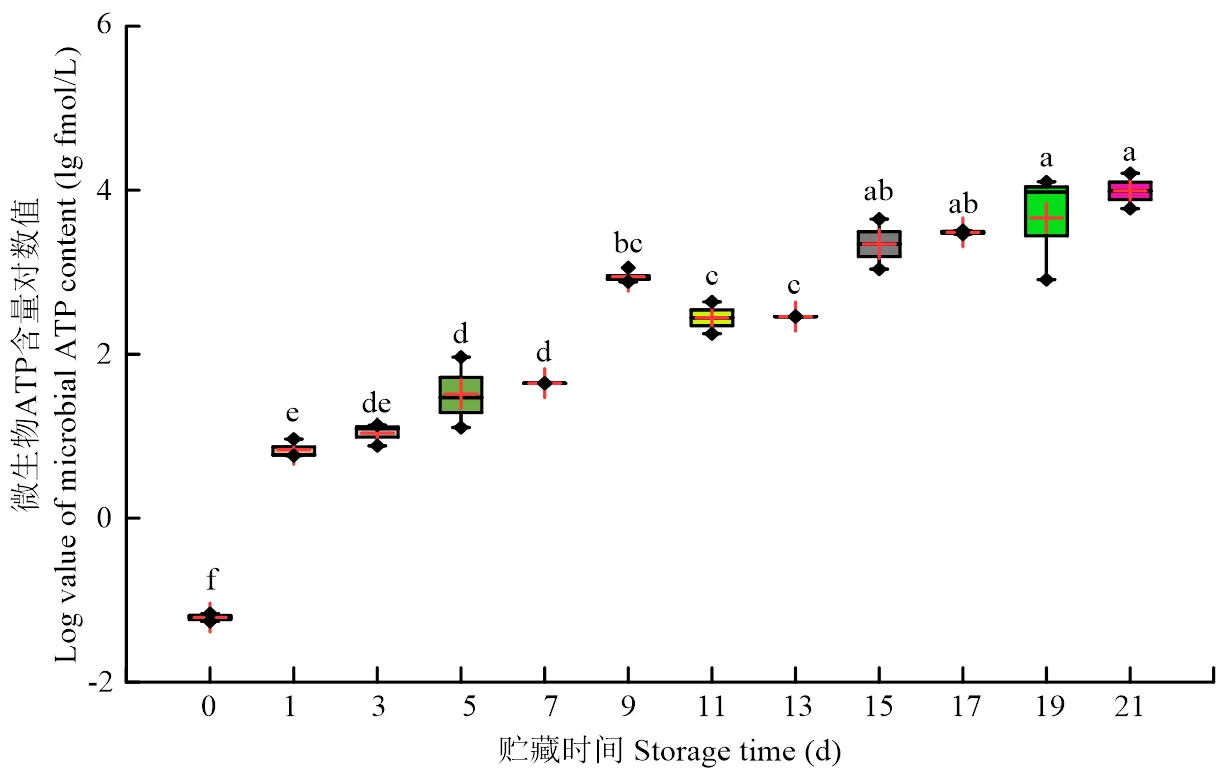
图5 冷鲜羊肉贮藏期间微生物ATP含量变化

图6 冷鲜羊肉贮藏期间肉表面ATP含量变化
2.3 冷鲜羊肉不同来源ATP与TVC、TVB-N的关系
为分析冷鲜羊肉不同来源ATP与新鲜度指标的相关性,采用皮尔逊相关分析,得出冷鲜羊肉中ATP、微生物ATP、肉表面ATP含量分别和TVC、TVB-N的相关系数()(表2)。TVC与TVB-N之间的相关系数为0.965,这也表明二者之间存在强相关性,证明冷鲜羊肉贮藏过程中微生物数量与TVB-N之间存在密切联系。微生物ATP和肉表面ATP含量与TVC相关性较强,相关系数分别为0.910和0.943,说明冷鲜羊肉ATP和肉表面ATP含量可以在一定程度上反映TVC值。微生物ATP和肉表面ATP含量与TVB-N也存在较强的相关性,相关系数分别为0.725和0.907,说明微生物ATP和肉表面ATP含量在一定程度上反映TVB-N的含量。通过比较微生物ATP、肉表面ATP分别与TVC、TVB-N的相关系数,得出肉表面ATP与二者之间相关系数更高,均达到0.900以上。综上,冷鲜羊肉表面ATP含量与新鲜度各指标密切相关,具有用于表征羊肉新鲜度的潜力,但其表征规律及预测模型有待进一步确证。
2.4 冷鲜羊肉TVC预测模型构建
为进一步探究冷鲜羊肉表面ATP预测羊肉TVC的规律,建立利用冷鲜羊肉表面ATP含量预测冷鲜羊肉TVC的数学模型。根据冷鲜羊肉表面ATP与TVC的变化散点图分布特征可知,二者之间的关系呈现S形上升趋势,因此本研究尝试使用Origin中专门的S型拟合工具(Sigmoidal)将冷鲜羊肉表面ATP含量与TVC的共72组数据进行拟合[21],同时以线性方程为参照,拟合结果如表3所示,其中利用S型拟合方程预测TVC的精度均大于线性方程。
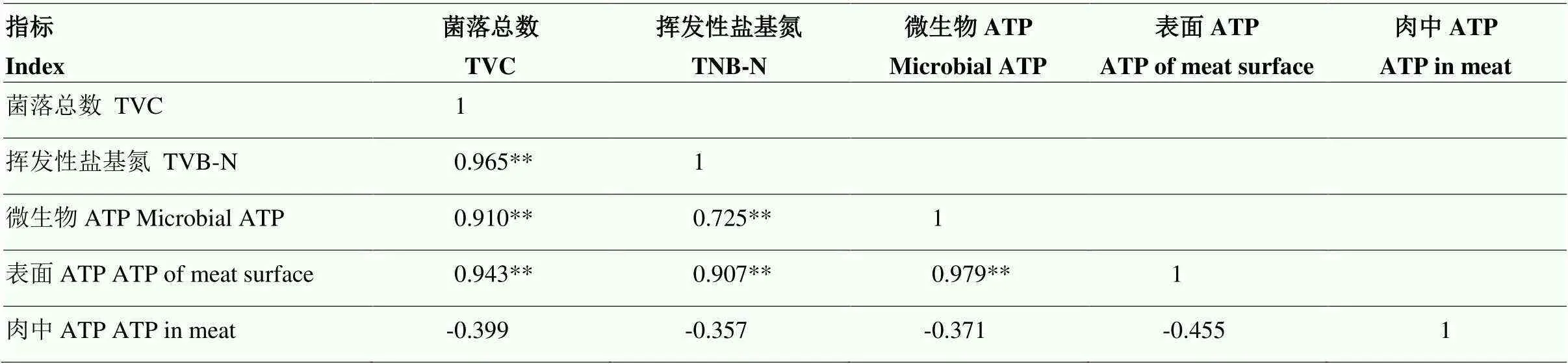
表2 相关性分析
-表示呈负相关,**表示在0.01水平(双侧)上显著相关
- indicates a negative correlation, ** indicates a significant correlation at the 0.01 level (two sides)

表3 模型拟合
根据不同拟合模型2值的比较,利用Boltzmann构建的肉表面ATP含量与TVC的预测模型较好,对得到的肉表面ATP含量与TVC数据进行拟合,结果如图7-a所示,拟合方程为:
=7.649-4.069/(1+exp(-5.807)/0.632)(2=0.903)
式中,为冷鲜羊肉TVC(CFU/g)的对数值;为冷鲜羊肉表面ATP含量(mol∙cm-2),数学模型线性良好。
Boltzmann模型参数物理意义表示如下[21]:A1表示曲线下平台的数值,A2表示曲线上平台的数值,x0表示(A1+A2)/2时对应横坐标的值。结合表面ATP含量与TVC变化趋势,得出利用Boltzmann数学模型预测TVC时,其中A2可用来表示检测TVC最大值,A1表示检测TVC最小值,0表示检测TVC最大值和最小值平均值的一半时,对应的肉表面ATP含量。
为了验证模型的预测效果,比较TVC实测值与预测值之间的关系,将其线性关系绘制如图7-b,二者呈现较好的线性关系(=0.943)。本研究条件下,冷鲜羊肉贮藏到17 d时,羊肉表面ATP含量为105.980fmol/cm2,代入建立的预测模型,得出TVC为6.250 lg cfu/g,真实值为6.160 lg cfu/g,二者数值接近,证明数学模型较为可靠。

图a表示冷鲜羊肉表面ATP预测TVC的Boltzmann拟合模型,图b表示拟合模型中TVC实测值与预测值之间的线性关系
2.5 冷鲜羊肉TVB-N预测模型构建
为进一步探究冷鲜羊肉表面ATP预测羊肉TVB-N的规律,利用冷鲜羊肉表面ATP含量构建了预测TVB-N的数学模型,根据冷鲜羊肉表面ATP与TVB-N的变化散点图分布特征可知,二者之间的关系呈现指数型上升趋势。因此,本研究尝试使用Origin中的指数型(Exponential)模型对冷鲜羊肉表面ATP含量与TVB-N之间共72组数据进行拟合,以线性方程为参照,拟合结果如表4所示,其中利用指数型拟合方程预测TVB-N的精度均大于线性方程。
根据不同拟合模型2值的比较,发现利用ExpDec1构建的肉表面ATP含量与TVB-N的预测模型较好,对得到的肉表面ATP含量与TVB-N进行拟合,结果如图8-a所示,拟合方程为:
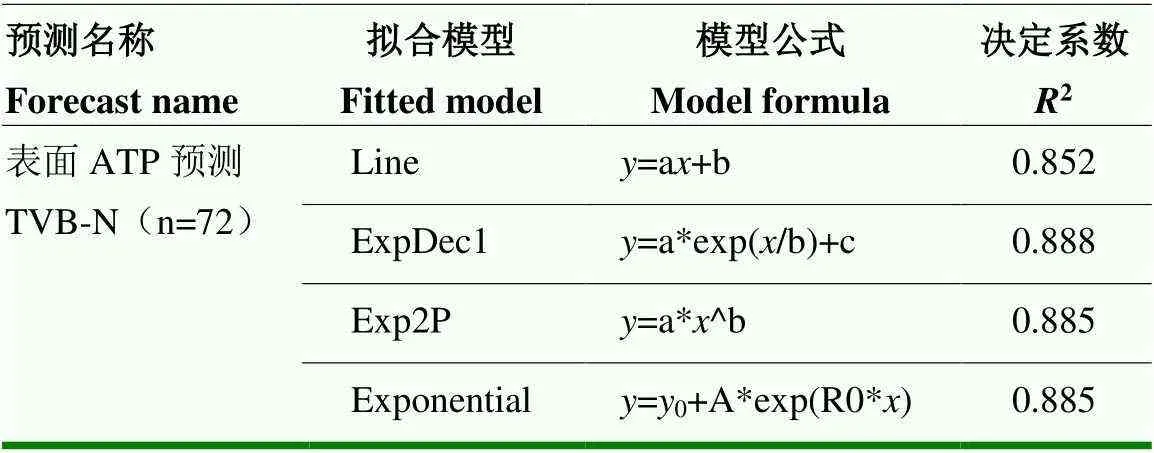
表4 模型拟合

图a表示冷鲜羊肉表面ATP预测TVB-N的Expdec 1拟合模型,图b表示拟合模型中TVB-N实测值与预测值之间的线性关系
=2.493*exp(/3.745)+3.057(2=0.888)
式中,为冷鲜羊肉TVB-N(mg/100 g);为冷鲜羊肉表面ATP含量(mol∙cm-2),数学模型良好。
羊肉TVB-N实测值与预测值之间的相关关系如图8-b所示,其相关系数为0.942,二者显著相关,证明预测模型可靠。本研究中,冷鲜羊肉贮藏到17 d时,此时羊肉表面ATP含量为105.980fmol/cm2,代入建立的预测模型,得出TVB-N为15.030 mg/100 g,真实值为15.170 mg/100 g,二者数值相近,再次证明数学模型较为可靠。
3 讨论
目前,冷鲜羊肉新鲜度检测手段存在操作繁琐、耗时长、成本高等问题[22-23],亟需探寻冷鲜羊肉新鲜度的快速检测方法。
3.1 冷鲜羊肉贮藏期间新鲜度变化
贮藏前期,冷鲜羊肉表面渗水增加使肉样对光的反射能力增强,且包装盒中氧气充足,肌红蛋白与氧气结合生成氧合肌红蛋白,肉色呈现鲜红色。在冷鲜羊肉贮藏过程中,微生物数量不断上升,蛋白质在微生物、酶等的作用下,产生氨(NH3)、胺类(R-NH2)等含氮的碱性有毒物质,它们以TVB-N的形式存在于肉中,随着贮藏时间的延长,胺类等代谢物积累导致冷鲜羊肉的TVB-N在贮藏过程中显著上升[24],贮藏后期pH也随之不断上升,此时不利于氧合肌红蛋白的生成,肌红蛋白和氧合肌红蛋白含量持续下降,并且高铁肌红蛋白含量不断积累,冷鲜羊肉变成暗红色,此外,细菌的大量繁殖也会促进高铁肌红蛋白的形成,所以在贮藏后期羊肉鲜红色变浅,色泽劣变[25]。本研究中样品贮藏17 d时,冷鲜羊肉TVB-N和TVC超过国家标准规定的限值,可推测0℃贮藏条件下,冷鲜羊肉贮藏期可达17 d。
3.2 冷鲜羊肉贮藏期间不同来源ATP变化规律
在冷鲜羊肉贮藏期间,无氧糖酵解可以产生少量ATP,但是肌肉收缩、离子运输、蛋白降解等一些途径都会消耗ATP[26-28],所以随着贮藏时间的延长,ATP含量整体呈逐渐下降的趋势。任驰[29]研究表明冷鲜羊肉在4℃贮藏条件下,冷鲜羊肉ATP含量在0—1 d急速下降,在贮藏后期1—5 d保持平稳状态,但在温度更低的贮藏条件下,冷鲜羊肉中ATP降解内源酶的作用被抑制,延缓了ATP的降解速度,这与本研究ATP整体呈现下降的趋势一致。本研究的0℃贮藏条件下,冷鲜羊肉中ATP含量消耗速度更为缓慢,具体表现为在贮藏后期5—21 d,ATP含量呈现平稳状态,这也与YOSHIHIRO等[30]得出的结果相一致。
随着冷鲜羊肉贮藏时间的延长,微生物数量不断上升,因此冷鲜羊肉微生物ATP在贮藏期间也呈现显著上升趋势,这与LIU等[31]的研究结果一致。而冷鲜羊肉表面ATP是通过涂抹法从冷鲜羊肉表面得到的ATP,是评估冷鲜羊肉表面清洁度的重要指标。本研究发现冷鲜羊肉表面ATP含量随着贮藏时间的延长也呈现不断上升趋势,这与OSHITA等[32]的研究结果一致,但二者之间在进行比较时,发现贮藏开始时肉表面ATP初始含量值较高,而随着贮藏时间的延长,肉表面ATP含量与微生物ATP含量差距缩小,可能是由于通过涂抹法取样得到的肉表面ATP包含部分体细胞ATP,但贮藏后期体细胞ATP含量显著下降,肉表面ATP含量大部分由微生物ATP构成。从研究结果发现微生物ATP和肉表面ATP与TVC、TVB-N呈现相同的变化规律,且相关性良好,具有表征冷鲜羊肉新鲜度的潜力。
3.3 冷鲜羊肉不同来源ATP预测羊肉新鲜度指标
近些年来有研究表明,肉表面ATP有表征肉品新鲜度的潜力。BAUTISTA等[16]利用ATP生物荧光法检测禽类胴体表面清洁度,通过回归分析得出表面ATP发光强度对数值与TVC相关系数为0.670。OTO等[17]通过荧光光谱检测猪肉表面清洁度,构建的猪肉表面ATP含量与TVC之间的模型,其效果良好(2=0.940—0.970)。而本研究通过分析冷鲜羊肉中ATP、微生物ATP和肉表面ATP与TVC、TVB-N之间的相关系数,表明微生物ATP与羊肉表面ATP均可在一定程度上表征羊肉新鲜度,也可得出冷鲜羊肉表面ATP含量与TVC、TVB-N之间存在更强的相关性,且肉表面ATP含量的前处理手段要明显优于检测微生物ATP含量,本研究也充分印证羊肉表面ATP与羊肉新鲜度存在明显的关联性,但具体相关关系如何有待于进一步明确。
构建肉表面ATP与新鲜度指标的表征方程是利用肉表面ATP表征新鲜度的必要条件。HIROAKI SHIRAI等[33]利用激发发射矩阵光谱学检测猪肉表面清洁度,利用偏最小二乘回归法建立了猪肉表面ATP含量与TVC之间的模型(2=0.840)。OTO等[34]利用荧光光度计检测猪肉的100 mL棉签样本观察到ATP含量与TVC之间的线性关系良好(2=0.960)。本研究结果发现,在整个贮藏过程中,肉表面ATP含量与菌落总数并不呈现标准的线性关系,从散点图观察,二者可能呈现指数关系。因此,本研究分别构建了肉表面ATP含量与菌落总数变化之间的3种“S型”模型,结果发现利用Boltzmann模型拟合效果最好,TVC实测值与模型预测值相关系数高达0.943,表明模型较为可靠,可应用于未知样品的检测,同时也发现肉表面ATP在104—108fmol/cm2范围内与TVC呈线性关系,而整个TVC预测模型并不呈现普遍的线性趋势,可能原因是冷鲜羊肉贮藏前期,羊肉体细胞ATP含量较多,表面ATP中包含大部分的体细胞ATP;而在贮藏后期,冷鲜羊肉体细胞ATP被消耗,表面ATP含量中更多来自于活体微生物,这也与本研究中贮藏后期羊肉微生物ATP与肉表面ATP之间含量的差距缩小得出的结论保持一致。
另一方面,本研究利用肉表面ATP构建了TVB-N的指数型ExpDec1预测模型,发现TVB-N实测值与预测值相关系数高达0.943,模型较为可靠。而以肉表面ATP含量为纽带,结合预测TVC的Boltzmann模型和TVB-N的ExpDec1交叉推导发现,当TVC值为6时,代入TVC预测方程得出肉表面ATP含量为106.040fmol/cm2,将此肉表面ATP含量代入TVB-N的预测模型中,得出TVB-N的含量为15.560 mg/100 g,超过国家标准。说明利用羊肉表面ATP建立的TVC与TVB-N的预测模型对于冷鲜肉是否腐败的预测判定结果一致,表明羊肉表面ATP可以应用于未知样品的新鲜度预测。
4 结论
冷鲜羊肉贮藏过程中,肉中ATP含量呈现下降趋势,微生物ATP含量、表面ATP含量均呈现上升趋势。冷鲜羊肉贮藏期间,肉中ATP、微生物ATP、肉表面ATP含量与TVC和TVB-N的相关系数()分别为-0.399、0.910、0.943和-0.357、0.725、0.907,因此,冷鲜羊肉表面ATP可作为表征冷鲜羊肉新鲜度的重要因子。
利用肉表面ATP预测冷鲜羊肉TVC的最优模型为TVC(lg cfu/g)=7.649-4.069/(1+exp(-5.807)/0.632);利用肉表面ATP预测冷鲜羊肉TVB-N的最优模型为TVB-N(mg/100 g)=2.493*exp(/3.745)+3.057。系统证实了利用冷鲜羊肉表面ATP可以实现冷鲜羊肉新鲜度的快速预测。
[1] 中国冷藏肉行业发展现状分析与投资趋势研究报告(2022-2029年). 观研报告网, https://www.sohu.com/a/521800223_121222943, 2022- 02-10.
Development and investment trends of frozen meat industry in China (2022-2029).https://www.sohu.com/a/521800223_121222943, 2022- 02-10.
[2] 张晋豪, 王浩东, 邵良婷, 徐幸莲, 王虎虎. 生鲜肉新鲜度快速新型表征技术研究进展. 食品科学, 2022, 43(13): 210-217.
ZHANG J H, WANG H D, SHAO L T, XU X L, WANG H H. Progress and trends in rapid novel technologies for characterization of fresh meat freshness: A review. Food Science, 2022, 43(13): 210-217. (in Chinese)
[3] HYUN B, CHA H G, LEE N, YUM S, BAEK S H, SHIN K. Development of an ATP assay for rapid onboard testing to detect living microorganisms in ballast water. Journal of Sea Research, 2018, 133: 73-80. doi: 10.1016/j.seares.2017.03.003.
[4] TRŠAN M, VEHOVC M, SEME K, SRČIČ S. Evaluation of ATP bioluminescence for monitoring surface hygiene in a hospital pharmacy cleanroom. Journal of Microbiological Methods, 2020, 168: 105785. doi: 10.1016/j.mimet.2019.105785.
[5] SCIORTINO C V, GILES R A. Validation and comparison of three adenosine triphosphate luminometers for monitoring hospital surface sanitization: A Rosetta Stone for adenosine triphosphate testing. American Journal of Infection Control, 2012, 40(8): e233-e239. doi: 10.1016/j.ajic.2012.04.318.
[6] SHAMA G, MALIK D J. The uses and abuses of rapid bioluminescence-based ATP assays. International Journal of Hygiene and Environmental Health, 2013, 216(2): 115-125. doi: 10.1016/j. ijheh.2012.03.009.
[7] AMODIO E, DINO C. Use of ATP bioluminescence for assessing the cleanliness of hospital surfaces: a review of the published literature (1990-2012). Journal of Infection and Public Health, 2014, 7(2): 92-98. doi: 10.1016/j.jiph.2013.09.005.
[8] ROADY L. The role of ATP luminometers in infection control. Infection Control and Hospital Epidemiology, 2015, 36(11): 1367. doi: 10.1017/ice.2015.209.
[9] ZHANG K J, PAN R J, ZHANG T Q, XU J, ZHOU X Y, YANG Y L. A novel method: Using an adenosine triphosphate (ATP) luminescence– based assay to rapidly assess the biological stability of drinking water. Applied Microbiology and Biotechnology, 2019, 103(11): 4269-4277. doi: 10.1007/s00253-019-09774-3.
[10] HAMMES F, GOLDSCHMIDT F, VITAL M, WANG Y, EGLI T. Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments. Water Research, 2010, 44(13): 3915-3923. doi: 10.1016/j.watres.2010.04.015.
[11] BAUTISTA D A. ATP Bioluminescence. Encyclopedia of Food Microbiology. 2nd ed. 2014: 97-104. doi: 10.1016/B978-0-12-384730- 0.00013-6.
[12] 舒柏华, 孙丹陵, 王胜利, 徐顺清. 肉类食品细菌污染生物发光快速分析技术研究. 中国公共卫生, 2003, 19(4): 483-484. doi: 10.3321/j.issn: 1001-0580.2003.04.049.
SHU B H, SUN D L, WANG S L, XU S Q. Rapid bioluminescent technique to detect bacteria in meat. Chinese Journal of Public Health, 2003, 19(4): 483-484. doi: 10.3321/j.issn: 1001-0580.2003.04.049. (in Chinese)
[13] RATPHITAGSANTI W, PARK E, LEE C S, WU R Y A, LEE J. High-throughput detection of spore contamination in food packages and food powders using tiered approach of ATP bioluminescence and real-time PCR. LWT-Food Science and Technology, 2012, 46(1): 341-348. doi: 10.1016/j.lwt.2011.09.003.
[14] WADHAWAN T, MVEVOY J, PRUSS B M, KHAN E. Assessing tetrazolium and ATP assays for rapid in situ viability quantification of bacterial cells entrapped in hydrogel beads. Enzyme and Microbial Technology, 2010, 47(4): 166-173. doi: 10.1016/j.enzmictec.2010.05. 003.
[15] 李海月. ATP荧光技术快速检测8种常见食源性致病菌研究[D]. 郑州: 河南工业大学, 2017.
LI H Y. Study on rapid detection of eight kinds of food-born Pathogen by Luminescence method [D]. Zhengzhou: Henan University of Technology, 2017. (in Chinese)
[16] BAUTISTA D A, SPRUNG D W, BARBUT S, GRIFFITHS M W. A sampling regime based on an ATP bioluminescence assay to assess the quality of poultry carcasses at critical control points during processing. Food Research International, 1997, 30(10): 803-809. doi: 10.1016/ S0963-9969(98)00049-0.
[17] OTO N, OSHITA S, MAKINO Y, KAWAGOE Y, SUGIYAMA J, YOSHIMURA M. Non-destructive evaluation of ATP content and plate count on pork meat surface by fluorescence spectroscopy. Meat Science, 2013, 93(3): 579-585. doi: 10.1016/j.meatsci.2012.11.010.
[18] SZERMAN N, RAO W L, LI X, YANG Y, VAUDAGNA S R, DE QUAN ZHANG. Effects of the application of dense phase carbon dioxide treatments on technological parameters, physicochemical and textural properties and microbiological quality of lamb sausages. Food Engineering Reviews, 2015, 7(2): 241-249. doi: 10.1007/s12393- 014-9092-9.
[19] LI X, ZHANG Y, LI Z, LI M, LIU Y, ZHANG D. The effect of temperature in the range of -0.8 to 4℃ on lamb meat color stability. Meat Science, 2017, 134: 28-33. doi: 10.1016/j.meatsci.2017.07.010.
[20] 王柏辉, 韩利伟, 王德宝, 杜瑞, 刘畅, 要铎, 任军, 靳烨. 绒山羊宰后成熟过程中羊肉品质和风味的变化分析. 食品工业科技, 2020(8): 230-235.
WANG B H, HAN L W, WANG D B, DU R, LIU C, YAO D, REN J, JIN Y. Analysis of change of quality and flavor in cashmere goat meat during postmortem aging. Science and Technology of Food Industry, 2020(8): 230-235. (in Chinese)
[21] 罗晓蓉, 陈晨枫, 丁欲晓, 徐炜新. 基于Origin软件正确评定韧脆性转变温度. 物理测试, 2010, 28(2): 37-39, 43. doi: 10.13228/j. boyuan.issn1001-0777.2010.02.005.
LUO X R, CHEN C F, DING Y X, XU W X. Evaluation of ductile-brittle transition temperature based on origin software. Physics Examination and Testing, 2010, 28(2): 37-39, 43. doi: 10.13228/j. boyuan.issn1001-0777.2010.02.005. (in Chinese)
[22] 柏松, 杨英. 食品微生物检验检测中的新技术研究. 现代食品, 2019(10): 173-175.
BAI S, YANG Y. Study on new technologies in food microbial inspection and detection. Modern Food, 2019(10): 173-175. (in Chinese)
[23] SKOTTRUP P D, NICOLAISEN M, JUSTESEN A F. Towards on-site pathogen detection using antibody-based sensors. Biosensors & Bioelectronics, 2008, 24(3): 339-348. doi: 10.1016/j.bios.2008.06. 045.
[24] 胡斐斐, 钱书意, 黄峰, 姜薇, 强宇, 江峰, 胡海梅, 李侠, 张春晖. 低压静电场辅助短期冻藏对猪肉品质的影响. 中国农业科学, 2021, 54(9): 1993-2005.
HU F F, QIAN S Y, HUANG F, JIANG W, QIANG Y, JIANG F, HU H M, LI X, ZHANG C H. Effect of low voltage electrostatic field-assisted short-term frozen storage on quality of pork. Scientia Agricultura Sinica, 2021, 54(9): 1993-2005. (in Chinese)
[25] 杜曼婷, 李培迪, 李欣, 李铮, 陈丽, 田建文, 张德权. 冰温贮藏结合不同包装方式对羊肉品质的影响. 食品工业科技, 2016, 37(14): 324-328, 343.
DU M T, LI P D, LI X, LI Z, CHEN L, TIAN J W, ZHANG D Q. Effects of controlled freezing point combined with package on mutton quality during storage. Science and Technology of Food Industry, 2016, 37(14): 324-328, 343. (in Chinese)
[26] Hudson N J. Mitochondrial treason: A driver of pH decline rate in post-mortem muscle? Animal Production Science, 2012, 52(12): 1107-1110. doi: 10.1071/AN12171.
[27] HUFF LONERGAN E, ZHANG W G, LONERGAN S M. Biochemistry of postmortem muscle-lessons on mechanisms of meat tenderization. Meat Science, 2010, 86(1): 184-195. doi: 10.1016/j. meatsci.2010.05.004.
[28] ALIANI M, FARMER L J, KENNEDY J T, MOSS B W, GORDON A. Post-slaughter changes in ATP metabolites, reducing and phosphorylated sugars in chicken meat. Meat Science, 2013, 94(1): 55-62. doi: 10.1016/j.meatsci.2012.11.032.
[29] 任驰. 贮藏温度和时间对宰后羊肉蛋白质磷酸化的影响[D]. 北京: 中国农业科学院, 2019.
REN C. Effects of storage temperature and time on protein phosphorylation in postmortem ovine muscle [D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[30] YOSHIHIRO Y, MORIHIKO S, FUMIO K, MASAO K. Effects of storage temperature on postmortem changes of ATP and its related compounds and freshness indices in oyster tissues. Fisheries Science, 1994, 60(2): 217-223. doi: 10.2331/fishsci.60.217.
[31] LIU Z N, ZHONG Y H, HU Y, YUAN L, LUO R, CHEN D, WU M, HUANG H, LI Y X. Fluorescence strategy for sensitive detection of adenosine triphosphate in terms of evaluating meat freshness. Food Chemistry, 2019, 270: 573-578. doi:10.1016/j.foodchem.2018.07.041.
[32] OSHITA S, AL-HAQ M, KAWAGISHI S, MAKINO Y, KAWAGOE Y, YE X J, SHINOZAKI S, HIRUMA N. Monitoring of ATP and viable cells on meat surface by UV-Vis reflectance spectrum analysis. Journal of Food Engineering, 2011, 107(2): 262-267. doi: 10.1016/ j.jfoodeng.2011.06.007.
[33] SHIRAI H, OSHITA S, MAKINO Y. Detection of fluorescence signals from ATP in the second derivative excitation–emission matrix of a pork meat surface for cleanliness evaluation. Journal of Food Engineering, 2016, 168: 173-179. doi: 10.1016/j.jfoodeng.2015. 07.032.
[34] OTO N, OSHITA S, KAWAGISHI S, MAKINO Y, KAWAGOE Y, AL-HAQ M, SHINOZAKI S, HIRUMA N. Non-destructive estimation of ATP contents and plate count on pork meat surface by UV-Vis reflectance spectrum analysis. Journal of Food Engineering, 2012, 110(1): 9-17. doi: 10.1016/j.jfoodeng.2011.12.017.
Characterization of Chilled Mutton by ATP from Different Sources

1Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-Products Processing, Ministry of Agriculture and Rural Affairs, Beijing 100193;2School of Food and Wine, Ningxia University, Yinchuan 750021
【Objective】In order to explore a new method for predicting the freshness of chilled mutton, the changes of adenosine triphosphate (ATP in meat, microbial ATP and ATP of meat surface) from different sources during storage were systematically studied, then the ATP that could characterize the change of chilled mutton was screened, and finally the prediction models for the total viable counts and volatile base nitrogen were established. 【Method】The longissimus dorsi muscle of Small Tailed Han sheep was stored in air sealed packaging at 0℃for 0, 1, 3, 5, 7, 9, 11, 13, 15, 17, and 21 days, respectively. The freshness indexes (pH, color, volatile base nitrogen, and total viable counts) and ATP from three sources (ATP in meat, microbial ATP, and ATP of meat surface) of chilled mutton were analyzed during storage. The changes of ATP from different sources were evaluated, and the predictive models of freshness indicators were built. 【Result】The freshness index of total viable counts and volatile base nitrogen in chilled mutton showed an upward trend during storage, and both of them exceeded the national standard limit after 17 days; the ATP in meat showed a decreasing trend, while the microbial ATP and the ATP of meat surface were increased, which was consistent with the change trend of the freshness index; the correlation coefficients () between ATP in meat, microbial ATP, ATP of meat surface and total viable counts, total volatile base nitrogen were -0.399, 0.910, 0.943 and -0.357, 0.725, 0.907, respectively. The optimal model for predicting the total viable counts in chilled mutton by ATP of meat surface was Boltzmann, which the formula was TVC (lg cfu/g)=7.649-4.069/(1+exp(x-5.807)/0.632), (2=0.903,<0.001); the optimal model for predicting total volatile base nitrogen in chilled mutton by ATP of meat surface was Expedc1, which the formula was TVB-N (mg/100 g)=2.493*exp(x/3.745)+ 3.057 (2=0.888,<0.001). 【Conclusion】The results showed that the ATP of meat surface of chilled mutton had the significant positive correlations with the total viable counts and volatile basic nitrogen, and then confirmed that the ATP of meat surface could be used as an indicator to characterize the freshness of chilled mutton. The optimal prediction model of the total viable counts and volatile base nitrogen could provide a new idea for rapid detection of chilled mutton freshness.
chilled mutton; ATP of meat surface; prediction model; freshness

10.3864/j.issn.0578-1752.2022.19.013
2022-02-24;
2022-06-06
国家重点研发计划(2021YFD1600705-2)、中央级公益性科研院所基本科研业务费专项(S2021JBKY-14)
苏媛媛,E-mail:suy2021@126.com。通信作者陈丽,E-mail:chenliwork@126.com。通信作者郑晓春,E-mail:group2_meat@163.com
(责任编辑 赵伶俐)

