新疆部分地区绵羊常见蜱传病原分子调查鉴定
梅杰,巴依娜,鹿梦瑶,阿合提·布尔列斯,李永帅,巴音查汗·盖力克,李永畅
(新疆农业大学动物医学学院,新疆 乌鲁木齐 830052)
蜱能够携带和传播多种病原体(细菌、病毒和原生动物),蜱传疾病因而受到广泛关注。目前,我国已发现7属117种蜱虫和30多种新型蜱传病原体[1],多种蜱传疾病也已有相关报道,如巴贝斯虫病、泰勒虫病、绵羊无浆体病和Q热等[2]。新疆位于我国西北地区,草场丰富气候复杂,利于蜱虫滋生,已有6属14种蜱于新疆被鉴定发现[2]。新疆肉羊存栏量为4 153.8万只,约占全国羊养殖业13.8%。近年来,尽管有少量报道阐述了新疆地区绵羊蜱传血液原虫病[3-4],但关于蜱传播病原体的信息仍然不足。本研究对新疆部分地区绵羊常见蜱传病原体流行特性展开调查,以期补充新疆地区绵羊血液原虫病数据库并为蜱传染病的防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
2021年从新疆克拉玛依乌尔禾区及巴州和静县部分地区,随机抽样选取并采集散养、外观健康、无明显发病症状的绵羊作为调查对象,抽取143只羊逐只无菌颈静脉采血,保存于2 mL EDTA抗凝管。装入放置有冰袋的采样箱中,详细记录每只羊的性别、年龄等情况,带回实验室。置于-4℃冰箱中,提取DNA,-20℃冰箱保存待核酸检测。
1.1.2 试剂与仪器
琼脂糖、溴化乙锭(Sigma公司);TianGen血液基因组DNA提取试剂盒(晶美技术有限公司)、胶回收试剂盒(OMEGA公司);DL2000Marker、2×Es Taq MasterMix(北京康为世纪生物科技有限公司);pEASY-T1载体(北京全式金生物技术有限公司)。
RADIAL20台式高速离心机(ORTO ALRESA公司)、DK-600A型电热恒温水浴锅(上海一恒科学仪器有限公司)、DYY-Ⅲ-5型电泳仪(北京六一公司)、PCR仪(Bio-Rad公司)、Motic BA400型光学显微镜(Motic公司)。
1.2 试验方法
1.2.1 DNA提取
按照天根血液/细胞/组织基因组DNA提取试剂盒说明书提取羊血DNA,于-20℃保存,并对所提取的基因组DNA进行电泳检测。1.2.2血涂片检查
采集的新鲜血液滴于载玻片上,推片、甲醇固定、吉姆萨染片,10×100倍油镜下观察血涂片中红细胞内有无虫体及血液中各种细胞的形态[5]。
1.2.3 常见绵羊血液原虫病分子生物学鉴定
以提取的血液基因组DNA为模板,灭菌双蒸水代替模板的阴性对照,进行目的片段扩增。PCR引物反应体系和反应条件参考文献[3],取5 μL PCR反应产物进行琼脂糖凝胶电泳检测,在凝胶成像系统观察有无目的条带;切PCR阳性反应产物目的条带,参照胶回收纯化试剂盒说明书进行胶回收,送往上海生工公司测序。1.2.4常见绵羊血液原虫病系统发育分析
通过NCBI数据库进行GenBank BLASTn分析,确定核苷酸序列一致性,并运用MEGA 5.0利用最大似然(ML)法,基于Kimura 2参数模型构建系统发育树。
1.3 数据统计与分析
试验数据采用SPPS 20.0软进行件t检验和单因素方差分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 常见绵羊血液原虫病病原检测结果
血涂片镜检结果显示,两个地区的绵羊血涂片均未发现明显虫体。
2.1.1 不同地区常见绵羊血液原虫病原PCR检查结果(见表1)
由表1可知,两个地区的绵羊无浆体阳性率为5.32%(5/94)、100%(49/49);而羊感染伯氏立克次氏体的阳性率分别为7.45%(7/94)、42.86%(21/49)。巴音郭楞和静县地区绵羊无浆体和伯氏立克次氏体感染情况比克拉玛依乌尔禾地区严重,且两地均未检出其他血液原虫病。
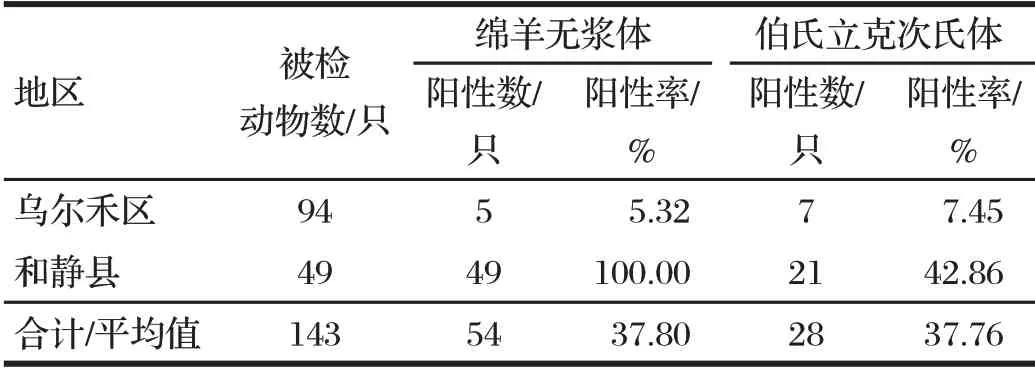
表1 不同地区常见绵羊血液原虫病原PCR检查结果Tab.1 PCR test results of common sheep blood protozoa in different regions
2.1.2 不同性别常见绵羊血液原虫病原PCR检查结果(见表2)
由表2可知,公羊的绵羊无浆体阳性数极显著低于母羊(P<0.01)。

表2 不同性别常见绵羊血液原虫病原PCR检查结果Tab.2 PCR test results of common sheep blood protozoa in different genders
2.1.3 不同年龄常见绵羊血液原虫病原PCR检查结果(见表3)

表3 不同年龄绵羊血液原虫病原PCR检查结果Tab.3 PCR test results of common sheep blood protozoa in different ages
由表3可知,各年龄段均有无浆体和伯氏立克次氏体感染,各年龄段感染情况差异不显著(P>0.05)。
2.2 绵羊血液原虫系统进化发育分析
2.2.1 绵羊无浆体部分PCR扩增结果及系统发育分析(见图1、图2)
由图1可知,绵羊无浆体进行凝胶电泳得到约为

图1 绵羊无浆体PCR检测结果Fig.1 PCR results of Anaplasma ovis in sheep
由图2可知,3株绵羊无浆体的OL859534基因序列的分歧度和相似性差异不大。新疆株与德国株和美国株相似性达99.0%~99.9%;分歧度1.0%~0.1%。
2.2.2 绵羊伯氏立克次氏体部分PCR扩增结果及系统发育分析(见图3、图4)
由图3可知,伯氏立克次氏体进行凝胶电泳得到约为501 bp的目的条带。

图3 绵羊伯氏立克次氏体PCR检测结果Fig.3 PCR results of Coxielle burnetii in sheep
由图4可知,本试验检出的伯氏立克次氏体序列与GenBank中存在绵羊无浆体的法国、阿联酋、尼日利亚、俄罗斯4个国家共17条序列并一支,序列包括:法国株(EU88863)、阿联酋(MW057693)、北京株AY251297、AY251298)、西伯利亚株(MK335931)等。其中本文测定的伯氏立克次氏体序列与法国株和突尼斯株相似性最大,达到97.0%~99.9%。347 bp的目的条带。之后产物送往上海生工有限公司测序,运用MEGA 5.0进行系统发育分析,见图2。

图2 绵羊无浆体系统发育分析Fig.2 Phylogenetic analysis of Anaplasma ovis

图4 绵羊伯氏立克次氏体系统发育分析Fig.4 Phylogenetic analysis of Coxielle burnetii
3 讨论
伯氏立克次氏体作为人畜共患病的病原可引起人的Q热。虽然许多病例无症状,但Q热的症状因人而异,以流感样疾病和肌痛等为主,国外已有报道其感染情况。Sun等[6]报道,伯氏立克次氏体作为我国目前已筛选的新兴病媒传播病原体中报道最多的病原体之一,进行区域内的研究利于降低其对全球健康构成的影响[6]。感染伯氏立克次氏体的非妊娠动物无症状或表现出轻微的流感样症状,小型反刍动物养殖场内主要因流产、死胎、乳腺炎等生殖疾病造成经济损失。而且伯氏立克次氏体可持续潜伏多年,甚至会终生携带病原体而无相关并发症[7-8]。
本试验中,调查范围内的绵羊亦无明显临床症状,且伯氏立克次氏体阳性率为37.76%,高于前期在新疆部分区域内牛感染伯氏立克次氏体(20.5%)和湖北省的山羊阳性率(4.7%)[9-10]。此外,对不同年龄绵羊感染情况调查结果发现,成年绵羊无浆体阳性率高于幼年,Q热的阳性率在幼年时较高,可能是由于幼年绵羊免疫系统发育不完全,机体抵抗力较差,容易受到感染侵害。
无浆体病的病原是寄生于动物血细胞内的血液寄生虫,主要经蜱和吸血昆虫传播,广泛存在于热带和亚热带地区,温带地区也有少量分布[4]。1983年首次在新疆发现绵羊无浆体感染,随后内蒙古等地相继出现相关的报道[11]。无浆体疾病的流行多发生在蜱和各种吸血昆虫活动的季节[12],雨量稀少的地区传播媒介的数量有所减少,当地绵羊无浆体病例也相对较少。各种蜱虫均可通过吸血的方式机械传播病原,而经卵传递和发育阶段性传递试验均未使绵羊遭到感染。本调查推测,调查地区的蜱虫可能是绵羊无浆体普遍感染的重要原因之一,某些病例也可能经胎盘垂直感染[13],造成一定程度的幼年绵羊感染。无浆体原虫通过硬蜱传播的阳性率较高[14-15],进一步表明了蜱虫传播的广泛性。本调查公羊的阳性数高于母绵羊无浆体阳性数可能是由于本次公羊的样本数量太少,导致结果存在误差而不足以说明具体情况。
根据前期相关报道,已知绵羊体内携带绵羊泰勒虫、绵羊巴贝斯虫等病原,但本调查并未发现上述病原体,可能与不同地理位置媒介蜱的分布及其生态环境不同有关。我国羊泰勒虫病的传播媒介为青海血蜱和长角血蜱,已确认青海省、宁夏回族自治区及甘肃省境内羊泰勒虫病的传播媒介为青海血蜱,鉴定河北省和辽宁省羊泰勒虫病的媒介蜱是血蜱属的蜱,河南省羊泰勒虫病的媒介蜱则为长角血蜱,新疆维吾尔自治区羊泰勒虫病的传播媒介主要为小亚璃眼蜱。本调查发现,所采集样点的无浆体阳性率较高,可能是当地的地理环境为蜱等宿主的生存提供了良好条件。与以往其他地区相比,绵羊感染无浆体平均阳性率小幅度上升,各地区阳性率差异性较大,可能与当地的蜱虫种类不同、环境(湿度和温度)以及饲养管理方面有关[4]。
4 结论
本研究发现,两区域内均存在绵羊无浆体和伯氏立克次氏体感染情况,表明本地动物中存在一定潜在感染风险。伯氏立克次氏体可引发人与动物共患病,今后需加大调查与防控力度,提高人与动物健康水平。

