红霉素对大型溞生殖、生长和基因表达的生态毒理效应
刘建超,马雨辰,张凌玉,任静华,李一平,陆光华,*
1 河海大学环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,南京 210098 2 江苏省地质调查研究院,自然资源部(国土)耕地生态监测与修复工程技术创新中心,南京 210018
抗生素在中国广泛使用并不断检出,主要包括磺胺类、四环素类、大环内酯类、喹诺酮类和β内酰胺类。红霉素(ERM)作为一种大环内酯类抗生素,在中国江河湖泊及海域中检出频率和检出浓度相对偏高[1]。中国海河中ERM最高达到4200 ng/L[2],辽河最高达到2834 ng/L[3],香港污水处理厂尾水中达到3150 ng/L[4]。基于ERM的急性基准值(0.47 μg/L)和慢性基准值(0.10 μg/L),通过生态风险评估发现中国辽河、海河和珠江流域水体中ERM暴露风险需要关注,风险熵值在0.17—10.1之间[5]。在中国53种用量较大抗生素风险评估中,ERM是排在前10的优先关注高风险抗生素[6]。研究发现ERM对浮游动物会产生影响,比如ERM会抑制多刺裸腹溞(Moinamacrocopa)的生长发育,造成氧化损伤,影响种群稳定[7]。对于藻类,ERM的暴露也会导致一系列的毒性效应。比如当ERM暴露浓度 ≥0.1 μg/L时,水华微囊藻(Microcystisflos-aquae)体内丙二醛(MDA)和活性氧(ROS)含量会显著升高[8]。ERM暴露浓度为10 μg/L时,微囊藻细胞内的超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性均显著增强[9],影响细胞膜的通透性,造成氧化性损伤,并产生脂质过氧化物信号分子,导致细胞功能障碍和死亡[8]。由此可见,ERM长期暴露的潜在生态风险不容忽视。
为了揭示ERM长期暴露对水生生物的生态毒理效应,本实验选取标准模式生物大型溞作为受试生物,以ERM急性毒性实验结果中96 h-LC50的0.01‰和1‰为暴露浓度,分析ERM对大型溞生长发育、生殖和游泳等生态行为学指标的影响,测试大型溞抗氧化系统和神经系统酶活性变化及生长繁殖代谢相关基因表达,分析ERM对大型溞脂质代谢系统的影响,以期为ERM的毒理效应和污染防控提供借鉴。
1 材料和方法
1.1 实验材料
红霉素(ERM, CAS: 114-07- 8)购买于百灵威科技有限公司;色谱级甲醇、乙醇、乙腈购买于Merk化工技术有限公司;受试生物大型溞(Daphniamagna)由中国科学院水生生物研究所提供。大型溞在实验之前驯化两周,驯化条件为:水温(21±1)℃,光暗周期16 h∶8 h,光照强度1000 lx,每天定时喂食纯种斜生栅藻。
1.2 急性毒性实验
在预实验的基础上设置10、50、100、150、200 mg/L和300 mg/L这6个浓度,同时设置清水空白对照组和溶剂对照组(0.01%乙醇)。在实验中,往100 mL 烧杯中加入50 mL目标浓度的暴露溶液,每个烧杯加1只健康幼溞(6—24 h),每个浓度设置20个平行。实验周期为96 h,在试验期间不进行喂食操作,也不更换暴露溶液。在实验开始后24、48和96 h,分别观察和记录每个烧杯中幼溞死亡的个数。
1.3 慢性毒性实验
根据急性毒性实验结果设置了两个暴露浓度2 μg/L[实测浓度(1.92±0.026)μg/L]、200 μg/L[实测浓度(194.1±5.8)μg/L] 为慢性实验暴露组,同时设置清水空白对照组和溶剂对照组(0.01%乙醇)。在盛有50 mL暴露溶液的烧杯中随机放入1只6—24 h的健康幼溞,并设置20个平行。由于抗氧化损伤实验和荧光定量PCR实验测定时用溞量偏大,每个暴露组在1000 mL烧杯中加入800 mL暴露溶液,随机放置150只健康幼溞(6—24 h),设置3个平行,用于相关参数测定。暴露周期为21 d,暴露期间实验条件维持在(21±1)℃,16:8 h(光:暗),每天喂食斜生栅藻,喂藻密度为5×104个/mL。每两天换水一次,换水时清洗烧杯。暴露期间记录各项指标:①母溞的产卵时间;②产卵数量;③21 d时母溞的体长;④21 d时母溞1 min内胸肢、心脏跳动频率;⑤21 d时连续测定30 s游泳速度。大型溞种群增长、生长、生殖、游泳等行为指标参照张凌玉等[10]的测定方法开展。
暴露21 d结束后,从清水对照、溶剂对照、2 μg/L和200 μg/L的暴露组的每个平行样品中取出50只大型溞放置在液氮中保存,用于测定超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)、乙酰胆碱酯酶(AChE)和丙二醛(MDA)等生物标志物。生物标志物测定前,大型溞先用生理盐水冲洗,滤纸吸干表面水分,然后加入到已经称重的离心管中,用电子天平准确称取大型溞的重量,按重量(g)∶体积(mL)= 1∶9的比例,加入9倍体积的生理盐水,在冰水浴条件下机械匀浆,匀浆液以2500 r/min转速离心10 min,取上清液进行测定。抗氧化系统和神经系统酶活性的具体测定步骤参照Wang等[11]和Aksakal[12]的方法进行。
另外,每个实验组取出50只大型溞,放入液氮中速冻3—5 min,然后放入-80℃冰箱中保存。使用Trizol试剂进行总RNA提取,后用TaKaRa反转录试剂盒对总RNA进行逆转录合成cDNA,然后进行特异性PCR扩增。目的基因测定引物序列见表1,所有结果用两个内参基因(actin和gapdh)的mRNA水平和Cq值进行归一化。
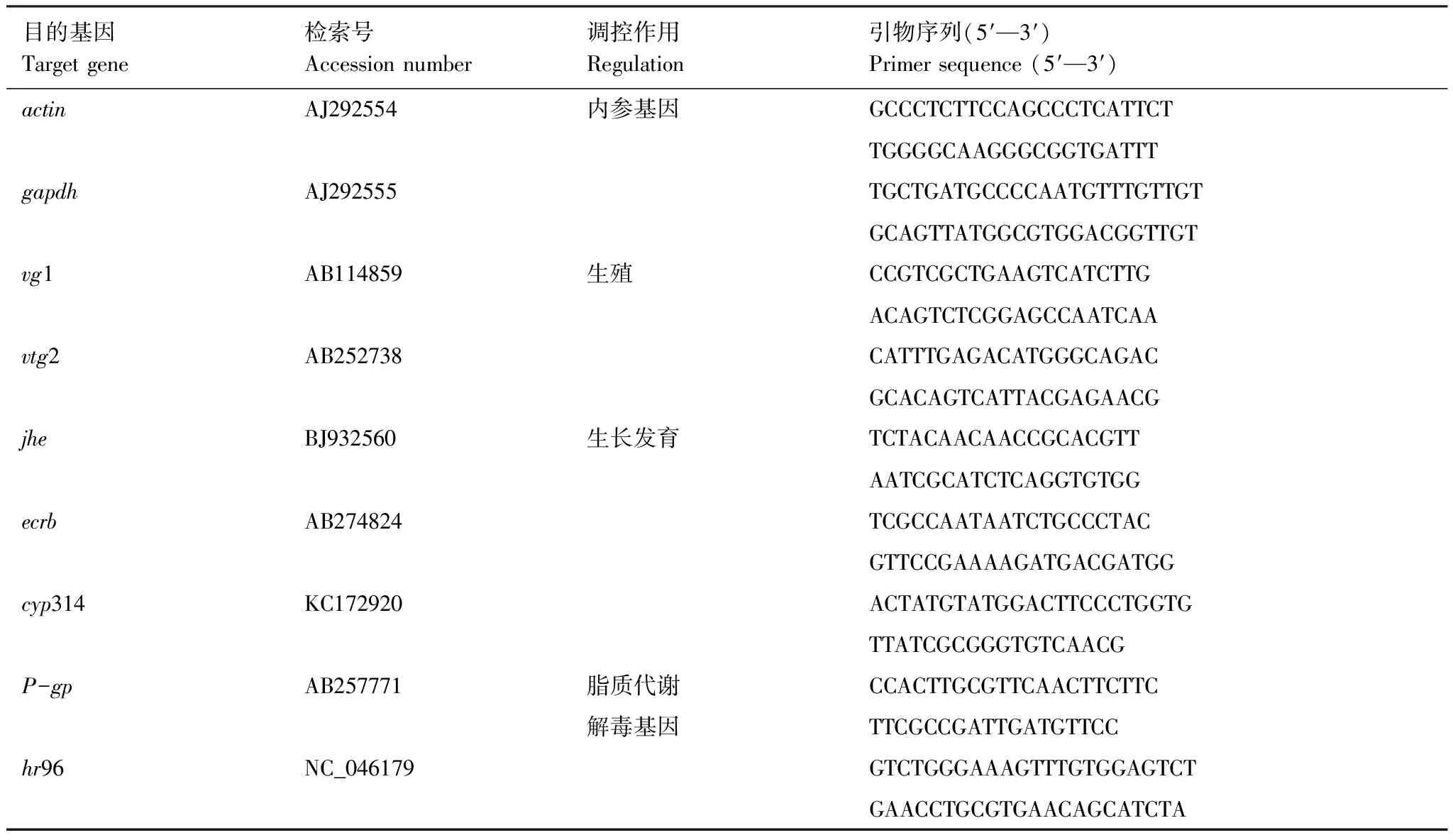
表1 目的基因及引物序列
1.4 统计分析
所有数据结果均采用SPSS Statistics 22.0统计软件进行单因素方差分析(ANOVA),以均值±标准偏差的形式表示。数据可视化由Origin 2019实现。
2 结果与讨论
2.1 半致死浓度
在10—300 mg/L 暴露溶液中,大型溞随着暴露浓度的增加,死亡率不断提高。空白对照组和溶剂对照组死亡率<5%,而低浓度组死亡率和对照组相比未见显著升高。通过使用logistic函数进行非线性回归计算,ERM对大型溞的48 h-LC50为315.41 mg/L,95%置信区间为247.39—398.11 mg/L,96 h-LC50为163.08 mg/L,95%置信区间为134.89—196.79 mg/L。以前研究发现ERM对大型溞的48 h半致死浓度(48 h-LC50)为211 mg/L[7],对青鳉(Oryziaslatipes)的96 h半致死浓度(96 h-LC50)大于100 mg/L[7],毒性低于大环内酯类抗生素罗红霉素,罗红霉素对大型溞的48 h-LC50和96 h-LC50分别为60.26 mg/L和39.81 mg/L[10]。根据化学品分类和标签规范第28部分:对水生环境的危害(GB 30000.28—2013)的毒性等级划分[13],ERM对大型溞的急性毒性为低毒。
2.2 对大型溞生殖的影响
ERM对大型溞生殖指标的影响如表2所示,清水对照和溶剂对照组大型溞毒理数据无明显差异,以下数据分析以溶剂对照组数据作为参照。高低两个ERM浓度组对大型溞首胎产卵时间、首胎产卵个数均无显著影响,轻微提升了大型溞的产卵胎数。随着ERM暴露浓度的增加,大型溞平均每胎产卵数和21 d产卵总数不断增加,高浓度组增加最为显著,提升率分别为50.6%和55.6%。从整个暴露过程来看,高低两个浓度ERM均对大型溞生殖能力产生诱导作用;在ERM污染胁迫下,随着暴露时间延长,大型溞产生生态补偿效应,产卵量有所提升[14],暴露中期产卵量明显高于前期。

表2 红霉素(ERM)对大型溞生殖指标的影响
从ERM对大型溞种群增长指标的影响来看(表2),周限增长率在所有暴露组均无显著变化。高低两个ERM浓度暴露均显著提升大型溞的净生殖率,提升率分别达到69%和97%。高浓度组ERM显著升高了内禀增长率,这与罗红霉素慢性暴露的实验结果类似[10]。ERM、罗红霉素等抗生素暴露下,会引起大型溞的种群繁殖能力提升,导致生存所需的最低食物水平要求升高,这在食物水平不足时可导致大型溞因饥饿而死亡,并影响寿命[15]。根据衰老的进化理论,过度生殖会消耗身体代谢的资源,最终缩短大型溞寿命和影响种群稳定[16]。 而本实验仅对大型溞进行21 d慢性暴露实验,ERM长期暴露对大型溞全生命周期及世代的生殖和种群增长能力的影响仍需深入研究。
2.3 对大型溞生长发育和游泳行为的影响
大型溞心率、胸肢跳动频率和体长与大型溞摄食、呼吸、代谢和内分泌系统等健康状况密切相关。从图1可以看出,高浓度组ERM轻微抑制了大型溞的体长,显著提高了大型溞胸肢和心脏跳动频次。高低两个暴露组ERM均对大型溞游速产生显著抑制作用,抑制率均超过30%。
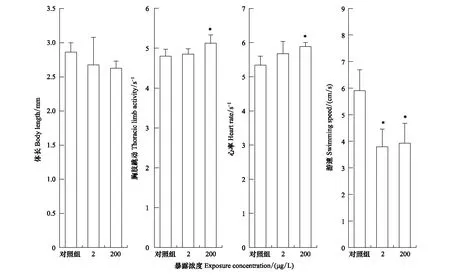
图1 21 d暴露后红霉素对大型溞的体长、胸肢跳动频率、心率和游速的影响Fig.1 Effect of ERM on body length, thoracic limb activity, heart rate and swimming speed of Daphnia magna after 21 d exposure*表示处理组与对照组的显著性差异,P<0.05
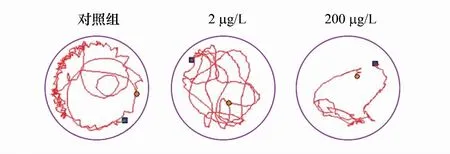
图2 21 d暴露后大型溞的游泳轨迹 Fig.2 Swimming trajectory of Daphnia magna after 21 d exposure
大型溞体长变化是环境胁迫下生物体的一种防御机制,体长的改变虽然小,在实际生态环境中会显著影响大型溞的种群稳定[17]。前期研究报道400 μg/L硫氰酸红霉素会抑制大型溞的体长增长[18]。心率是反映污染物对大型溞血液循环系统影响的敏感生理指标[19],心率紊乱说明大型溞器官可能受到损伤,呼吸能力下降[20]。胸肢作为大型溞的摄食器官,受到心脏的能量供给和神经系统调控的双重作用完成摄食动作。心率过快一定程度上导致供给胸肢的能量过度输出,损耗身体机能,这与大型溞生长抑制和体长减短的结果相一致。游速常用于表征化学物质的有害影响的敏感可靠性生物指标[21]。大型溞游泳能力不仅在游速方面受到显著抑制,高低两个浓度组都显著降低了大型溞的泳道密度,大型溞的移动范围变小(图2),前期研究表明游泳活性的抑制会降低大型溞的生长发育和生殖功能[22]。ERM对大型溞游泳活性产生的抑制作用可能与ERM产生神经毒性相关[21]。
2.4 对大型溞抗氧化和神经系统的影响
为了研究ERM对大型溞抗氧化系统的影响,检测了大型溞MDA的含量和SOD、GST的酶活性,同时检测大型溞的AChE活性探究ERM潜在的神经毒性。根据图3,高浓度ERM暴露显著增加了大型溞体内MDA含量,诱导量超过2倍。脂质过氧化产物MDA的过量产生将进一步影响SOD和GST酶活性,造成细胞膜损伤[23]。ERM暴露下,高低两个暴露浓度组大型溞SOD和GST酶活性都明显降低,高浓度暴露组ERM对SOD和GST的抑制率超过了46%和42%。同时,高低两个暴露组ERM都抑制了大型溞AChE酶活性,最高浓度抑制率达到39%。
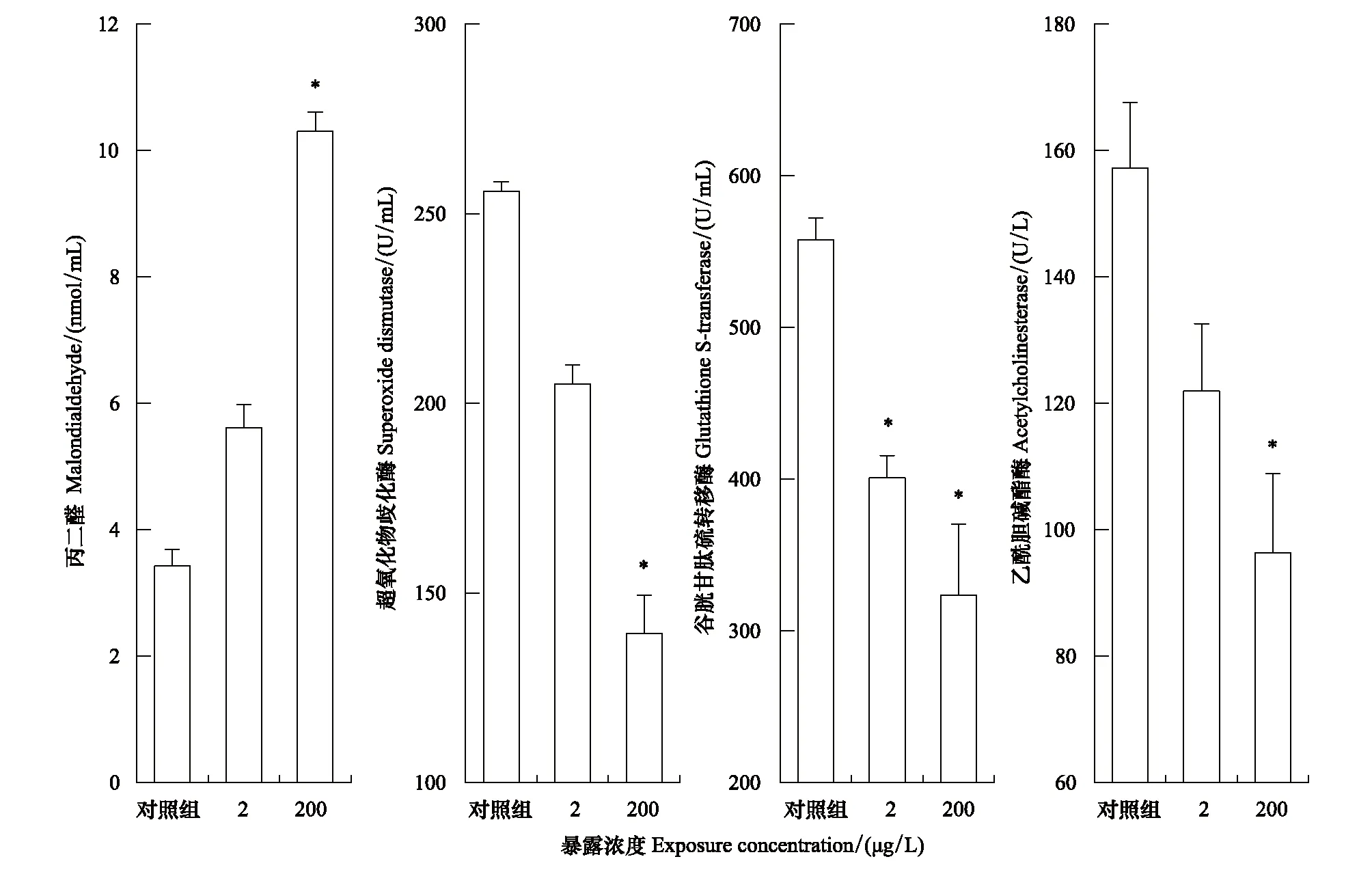
图3 21 d暴露后红霉素(ERM)对大型溞酶活性和丙二醛含量的影响Fig.3 Effect of ERM on enzyme activities and malondialdehyde content of Daphnia magna after 21 d exposure
为了抵御ROS的氧化伤害,大型溞体内SOD、CAT、GST和谷胱甘肽(GSH)等活性酶相互协同,形成抗氧化防御体系发挥抗氧化作用。SOD和CAT构成抗氧化系统的第一道防线,SOD能够歧化超氧化物自由基形成H2O2和O2[24],CAT将H2O2歧化成H2O和O2。CAT含量不足时,GSH可与SOD协同作用,用于清除H2O2,而GSH的降低会进一步影响GST的抗氧化功能[24]。在污染物胁迫作用下,生物体内清除ROS的速率小于ROS累积的速率,过量累积的ROS会对不饱和脂肪酸氧化或者过氧化,生成脂质过氧化产物MDA,生物膜中不饱和脂肪酸减少,膜的流动性降低,通透性变差,导致营养物吸收效率降低,维生素和无机盐等营养失衡,最终造成生长发育受到抑制,生殖能力和免疫力降低[25—26]。本研究发现,ERM能够使大型溞MDA含量增加,SOD和GST活性减弱,尤其是高浓度ERM暴露后,大型溞体内产生的过量ROS损害机体健康,抑制抗氧化酶的生成[27],引起细胞膜损伤[11]。
AChE是无脊椎动物体内广泛存在的一种酶,能够保证生物神经信号正常传递,主要位于胆碱能神经末梢突触间隙,可通过降解神经递质乙酰胆碱[28],降低它对乙酰胆碱受体的兴奋作用,保证神经传导。暴露ERM后,大型溞AChE活性受到抑制,酶水解神经递质乙酰胆碱的能力减弱,导致乙酰胆碱受体过量而无法正常传递神经信号[29],最终游速变慢。研究发现AChE活性的抑制和大型溞游泳能力的削弱呈正相关[30]。
2.5 对大型溞基因转录的影响
2.5.1对卵黄蛋白相关基因转录的影响
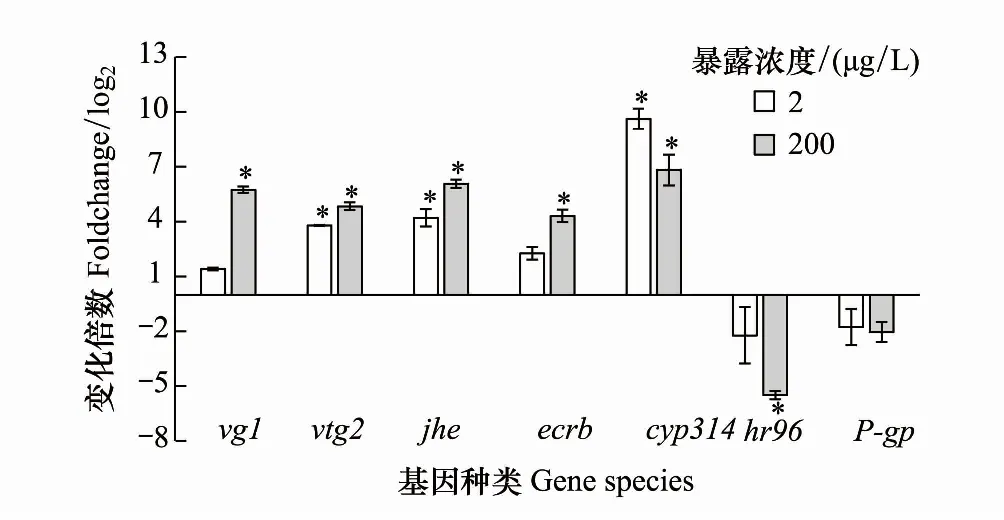
图4 21 d暴露后ERM对大型溞基因相对转录量的影响 Fig.4 Effect of ERM on relative gene transcription of Daphnia magna after 21 d exposure
卵黄蛋白(vitellogenin)是胚胎发育的能量储备和内源性营养的主要来源[31],受雌激素调控[32]。卵黄蛋白vg1有助于卵黄的形成[33],vtg2是卵生动物卵黄蛋白的前体,它们通常被用作雌激素化合物的生物标志物[34]。暴露21 d时,相对于对照组,高浓度组ERM显著上调了vg1和vtg2表达(图4),高浓度组vg1表达上调超过了500%,暴露21 d时暴露组大型溞vg1和vtg2相对表达量均为正值(上调)。在秀丽隐杆线虫成年早期,过量的卵黄蛋白基因转录可以确保充分的卵黄蛋白合成能力,以达到最大的生殖率[16]。在大型溞成年早期vg1和vtg2的转录水平相对偏高,以满足生殖需求[16]。有研究结果表明药物扑热息痛短期暴露下,大型溞vtg表达随着暴露时间的延长会显著提高,在长期暴露扑热息痛对大型溞雌激素的干扰比短期更强[35]。
2.5.2对保幼激素和蜕皮激素相关基因转录的影响
甲壳类动物的生长发育主要受蜕皮激素、保幼激素及ecr受体和usp的转录调控[36]。保幼激素调控大型溞卵黄蛋白的形成,对生物的生殖发育发挥作用[36]。jhe是保幼激素的编码基因。Ecr是负责蜕皮激素合成的基因,ecrb主要参与调节大型溞的蜕皮过程,而蜕皮和大型溞的生长有关[37]。cyp314基因参与主要蜕皮激素的生物合成[38],可以介导蜕皮激素由无活性向活性形态20-HE转化[39]。从图4可以看出,高浓度组ERM上调了jhe、ecrb和cyp314基因表达,低浓度组ERM显著促进了jhe和cyp314基因表达,说明ERM暴露后大型溞的保幼激素和蜕皮激素合成受到促进,导致大型溞的繁殖显著提升[40]。由于大型溞的蜕皮周期和生殖周期同步,蜕皮激素合成发生变化在一定程度上反映了污染物对大型溞生殖能力的干扰[41]。大型溞蜕皮激素的合成不仅涉及cyp314、ecrb基因的表达,同时还与多种信号通路(如视网膜X受体)有关[42],ERM全生命周期或世代暴露下,大型溞cyp314、Ecr等基因表达与繁殖能力的关系需要进一步研究。
2.5.3对脂质代谢和解毒相关基因转录的影响
在无脊椎动物中,hr96是核受体NR1J组中重要的毒物受体[43]。在哺乳动物中,hr96与NR1I(PXR/CAR/VDR)等核受体基因同源,可以调控I和II相解毒基因的表达[35]。hr96还可以调控多个参与脂质吸收的基因,并通过内稳态和运输三酰基甘油、胆固醇介导能量代谢[36, 44],调节涉及胆固醇和脂肪酸稳态的npc基因组[36]。在大型溞的整个生命周期,脂质代谢进程保障其生存和繁殖,脂质代谢过程如果被破坏,脂肪酸摄取和分解脂质相关的酶受到抑制,会导致生物以脂肪的形式储存能量,影响健康[45]。P-gp(P-glycoprotein)是一种通过ATP能量协助外源性化合物跨膜转运的基因,在外源性物质解毒方面起重要作用,生物体的P-gp活性与环境胁迫的抵抗和适应有关,相当于环境和生物组织之间的屏障[42]。P-gp编码基因是hr96的下游靶基因,它们的表达有一定相似性[35]。从图4可以看出,高低两个ERM暴露组都使P-gp的相对表达量降低,高浓度ERM导致hr96表达显著下调。相似的结果在药物氟西汀和扑热息痛暴露中也被发现,50 μg/L浓度暴露下两种药物均显著抑制了hr96基因表达[35,46],解毒系统功能受到抑制会造成氧化损伤[35]。污染胁迫下,hr96和P-gp基因能够协同CYP450s去除体内的外源性污染物,但长期暴露污染物会引起大型溞解毒系统紊乱。
3 结论
ERM对大型溞的急性毒性为低毒,48 h-LC50和96 h-LC50分为315.41 mg/L和163.08 mg/L。在暴露初期高浓度ERM导致大型溞内禀增长率和生殖能力显著升高,AChE活性被抑制,大型溞体长变短,心跳和胸肢跳动加快,游速减慢,生长发育受到影响,同时干扰大型溞的脂质代谢,体内MDA含量增加,过多自由基产生导致SOD和GST活性抑制,细胞膜损伤。ERM显著影响大型溞生殖的相关基因vg1和vtg2表达,上调保幼激素和蜕皮激素相关的基因jhe、ecrb和cyp314表达,下调解毒相关基因hr96和P-gp的表达,最终引起免疫力低下和生长抑制,表明ERM长期暴露影响浮游生物种群稳定和生态系统安全。

