中国胰腺假性囊肿内镜诊治专家共识意见(2022年)
国家消化病临床医学研究中心(上海) 中华医学会消化内镜学分会超声内镜学组 中国医师协会胰腺病学专业委员会
【提要】 胰腺假性囊肿是急、慢性胰腺炎常见并发症,其治疗常需要多学科参与。目前国内存在胰腺假性囊肿治疗理念不统一、干预时机不明确、并发症处理不完善等问题。本共识结合国内外最新循证医学证据,形成包括胰腺假性囊肿定义和分类、影像及内镜诊断、治疗指征、外科手术及内镜治疗原则等10大类,共30项推荐意见,旨在进一步规范我国胰腺假性囊肿的临床诊疗流程,推广以内镜介入治疗为主的综合治疗新技术,从而提高胰腺假性囊肿的诊治成功率。
胰腺假性囊肿(pancreatic pseudocyst,PPC)是指胰腺周围或胰腺内部的非上皮组织包裹的液体积聚,属于胰腺囊性病变的一种,常继发于急性胰腺炎(acute pancreatitis, AP)后期或慢性胰腺炎(chronic pancreatitis, CP)。PPC的发病率较高,AP后期PPC发生率为10%~26%,而CP引起的PPC发生率可高达20%~40%[1]。PPC如处理不当,会导致感染性胰腺坏死(infected pancreatic necrosis,IPN)、囊肿内或腹腔或消化道出血、胰瘘、肠瘘等严重并发症。因此,国内外AP相关诊治指南和共识[2-5]均密切关注PPC的分类和治疗原则。近年来,随着消化内镜、胰腺外科手术、影像介入等诊疗技术的快速发展,尤其超声内镜(endoscopic ultrasound,EUS)技术的日益更新,以及新型囊肿引流支架的临床应用,为PPC的治疗方式带来更多选择。
PPC治疗是一个需要多学科参与的综合治疗过程,目前还存在PPC治疗理念不统一、干预时机不明确、并发症处理不完善等问题,因此有必要制定一项针对PPC的多学科专家共识意见。2022年8月,由国家消化病临床医学研究中心(上海)、中华医学会消化内镜学分会超声内镜学组和中国医师协会胰腺病学专业委员会牵头,组织消化内镜、胰腺外科和影像介入等领域的专家,结合国内外最新的循证医学证据,制订国内首部关于PPC的内镜诊治专家共识意见,旨在进一步规范我国PPC的临床诊疗流程,推广以内镜介入治疗为主的综合治疗新技术,从而提高PPC的治疗成功率。
本共识意见的制定过程中,参考研究对象、干预措施、对照、结局(participant, intervention, comparison, outcomes, PICO)原则[6]提出陈述意见。按照建议评估、发展和评价的分级系统(grading of recommendations assessment, development and evaluation, GRADE)[7]对证据质量和推荐级别进行分级,并采用改良Delphi方法由专家投票表决,表决意见中①+②比例>80%属于达成共识(表1)。最终,本共识形成10大类、30项陈述条款(表2)。

表1 证据质量、推荐级别分级和改良Delphi方法共识投票意见选项

表2 中国胰腺假性囊肿内镜诊治专家共识陈述汇总
一、定义和分类
推荐意见1:PPC是急性胰腺炎的后期并发症,以液体成分为主,有别于包裹性坏死(walled-off necrosis,WON),后者含有较多胰腺或胰周坏死物成分。
证据质量:A; 推荐强度:强;共识水平:100%
PPC主要见于AP和CP。近70%的PPC由酒精性胰腺炎起病,15%为特发性,部分见于手术或创伤所致胰腺损伤[8]。PPC是AP的常见并发症,通常发生在起病4周以后,有完整非上皮性包膜包裹的液体积聚,内含胰腺分泌物、肉芽组织、纤维组织等。国内外指南[2-5]均推荐根据发病时间及积聚物成分将AP合并的胰腺周围液体积聚,分为急性胰周液体积聚(acute peripancreatic fluid collection,APFC)、急性坏死物积聚(acute necrotic collection,ANC)、PPC、WON和IPN 5大类(表3)。广义的“胰腺假性囊肿”包括PPC和WON,随着对该疾病认识的不断深入,有必要对PPC和WON加以区分。本共识内容聚焦于PPC和WON,针对急性期的APFC、ANC以及后期的IPN诊治不在讨论范畴。

表3 急性胰腺炎相关液体积聚的名称及定义
推荐意见2:PPC和WON分别来源于AP的APFC和ANC。
证据质量:B;推荐强度:强;共识水平:100%
AP相关PPC的形成是在全身炎症反应时期的胰液积聚,伴或不伴胰管的破裂。关于PPC和WON的起源仍存在争论,目前倾向于APFC经过机体的吸收和包裹,可形成PPC[8]。ANC因急性期伴有胰腺组织或胰周组织的坏死物,后期可包裹形成WON,但随时间推移,部分坏死物成分较少的ANC亦可后期形成PPC而非WON,而PPC的囊肿内亦可因少量出血或囊液吸收、坏死物比例增多而形成WON[2]。
推荐意见3:PPC和WON均可合并细菌或真菌感染,导致IPN,WON更易引起IPN。
证据质量:A;推荐强度:强;共识水平:100%
PPC和WON因囊肿内富含营养成分、蛋白质比例高,易引起自发感染或因穿刺引流造成外源性感染,自发感染的主要原因可能与机体免疫力低下、肠黏膜屏障受损、肠道菌群移位等因素有关[8]。PPC感染后可导致患者出现发热、腹痛、白细胞计数增高、血清降钙素原升高等表现,CT上可显示囊肿内的“气泡征”[9]。也有一部分PPC感染后CT上无“气泡征”,可于引流后囊液性状及囊液培养后结果得到证实。PPC的感染率为20%~40%[8],相较于囊液清亮的PPC,WON因含有较多固体成分和有机物,更易并发感染。
推荐意见4:CP、胰腺肿瘤或其他胰腺疾病也可导致PPC,发生机制可能与胰管梗阻引起的潴留性囊肿有关。
证据质量:C;推荐强度:弱;共识水平:96.3%
CP形成的假性囊肿通常被认为是基础疾病急性加重的结果,多为潴留性囊肿,与胰管梗阻有关。Nealon等[10]根据囊肿与主胰管解剖位置的关系,将PPC分为7种类型:Ⅰ型,正常胰管,胰管与囊肿不相通;Ⅱ型,正常胰管,胰管与囊肿相通;Ⅲ型,胰管狭窄,胰管与囊肿不相通;Ⅳ型,胰管狭窄,胰管与囊肿相通;Ⅴ型,部分胰管正常伴胰管完全中断;Ⅵ型,慢性胰腺炎,胰管与囊肿不相通;Ⅶ型,慢性胰腺炎,胰管与囊肿相通。但胰管与囊肿的关系很难单从影像学检查结果判断,治疗前分型较为困难。
胰腺良、恶性肿瘤也可导致胰管梗阻形成PPC,或继发AP形成PPC或WON。胰腺癌多为实性占位,通过患者症状、影像学检查、血液肿瘤标志物检测等可鉴别[8]。对于疑似肿瘤合并PPC者,囊肿引流需谨防肿瘤种植性转移。胰腺囊性肿瘤影像学表现可近似于PPC,但前者囊壁多由上皮组织构成,可通过抽吸囊液进行病理学、肿瘤标志物、淀粉酶或分子生物学检测,无症状者亦可采用影像学检查密切随访。
二、影像学及内镜诊断
推荐意见5:CT或MRI均为诊断PPC和WON的首选影像学检查方式,MRI更有助于判断囊肿液体及坏死物含量。
证据质量:B;推荐强度:弱;共识水平:92.6%
PPC于腹部CT上表现为密度相对均一的液体包裹囊肿,固体成分较少,增强CT有助于精确评估囊肿大小和周围血管情况[11-12](图1)。WON可于CT影像上显示囊腔中除液体积聚外,还包含有坏死组织,坏死物含量可通过CT密度值判断。MRI可更加准确地判断囊肿性质、液体及坏死物含量,MRCP有助于初步判断囊肿和胰管的关系[2, 13]。通过MRCP和EUS测量、判断坏死物含量,从而将WON与PPC相鉴别。腹部B超也是可供选择的影像学检查方式,B超下可见胰周液性暗区,无回声影。
推荐意见6:EUS对PPC的性质判断优于CT或MRI,可精确判断囊肿内坏死物的比例,有助于区分PPC和WON。
证据质量:A;推荐强度:强;共识水平:100%
EUS因扫查时距离PPC/WON更近,可精确观察囊壁结构改变,例如是否有壁结节、囊液中的絮状物或坏死物,是否有分隔等(图1),因此对于囊肿坏死物比例的判断较为准确,有助于区分PPC和WON[14]。过去指南[2]中PPC的定义为增强CT检查囊肿内不含坏死物。部分WON因CT显示均一性较好,而EUS更能明确WON诊断。通常情况下,对于坏死物含量较少的假性囊肿,只有在引流时才能发现坏死组织[15]。关于EUS下PPC和WON中坏死物含量的比例目前尚未确定,有研究认为囊肿内坏死物成分>20%有可能是区分WON和PPC的界值[16-17]。
推荐意见7:超声内镜引导下细针穿刺活检(endoscopic ultrasound-guided fine-needle aspira-tion, EUS-FNA)对于判断PPC/WON是否合并IPN有一定价值,但不推荐单纯以诊断为目的的EUS-FNA,通常在拟行内镜引流前实施。
证据质量:B;推荐强度:弱;共识水平:100%
影像学检查对判断IPN感染范围、评估严重程度及选择后续治疗措施有至关重要的作用,其中CT检查结果示“气泡征”是IPN诊断的直接证据。对于无法明确诊断者,可视情采用EUS-FNA,穿刺液涂片或培养有助于明确感染的细菌[18]。同时,因FNA有引起PPC/WON感染的风险,因此不推荐单纯以诊断为目的的EUS-FNA[19]。

图1 典型胰腺假性囊肿(1A~1C)和包裹性坏死(1D~1F)的CT、MRI、EUS图像
三、治疗指征
推荐意见8:PPC/WON持续4周以上,且有囊肿直径>6 cm或囊肿继发压迫症状或囊肿进行性增大或囊肿感染或合并胰源性门脉高压等情况时,有干预指征。
证据质量:A;推荐强度:强;共识水平:100%
40%~70%的PPC无症状或症状轻微,无需介入治疗,囊肿可自行吸收[8,14,20]。近50%无症状WON经保守治疗后可自行消散[21-22]。1992年亚特兰大胰腺炎治疗指南[23]建议对>6 cm和(或)存在时间超过6周且引起症状的PPC进行引流。CP引起的PPC囊壁厚且伴有胰管中断,囊肿出现后均不能自行吸收,需临床干预方可消散[24]。当PPC/WON出现以下情况时不易自行消散:(1)囊肿直径>6 cm;(2)囊肿持续存在6周以上;(3)合并囊内感染、出血、压迫毗邻脏器等并发症[14]。
关于囊肿引流介入时机,尽管有研究[25]表明AP后胰周液体积聚早期(<4周)行EUS引导下穿刺引流安全可行,目前仍不建议早期干预。囊壁未包裹完整的囊肿,过早介入治疗,发生并发症的风险增加。近期一项研究[26]纳入170例AP发病4周内(早期组)和AP发病≥4周(延迟组)伴胰周积液行EUS引导下穿刺引流的患者,发现早期组囊肿直径[(12.3±2.1)cm]显著大于延迟组[(10.5±2.7)cm)],囊内固体成分比例(47.7%±8.9%)亦显著多于延迟组(28.3%±11.7%),后续采用内镜下坏死组织清除术的比例显著高于延迟组(50.0%比7.4%)。延迟组再次介入治疗率低可能与随着时间推移坏死物发生液化有关。此外,研究发现囊肿直径越大,坏死物含量越多,需要后续介入操作的次数越多。囊肿直径≥10 cm、坏死物含量≥30%是再次干预治疗的危险因素[27]。
关于PPC/WON治疗时机可总结如下:(1)囊肿持续4周以上;(2)囊肿直径>6 cm;(3)继发压迫症状;(4)囊肿进行性增大;(5)合并囊内感染伴胰源性门静脉高压等并发症。符合(1)+(2)/(3)/(4)/(5)时,建议采取介入治疗。囊肿合并急性出血为非干预指征;陈旧性出血合并感染可考虑干预;短期内合并出血干预需慎重。
推荐意见9:PPC/WON若直径<6 cm,无明显症状且无严重并发症,可保守治疗观察一段时间,争取自行吸收。
证据质量:B;推荐强度:弱;共识水平:100%
保守治疗即内科支持治疗,通过静脉输液,抑酸、抑酶、抗感染及营养支持,以期囊肿自行吸收[20-21]。通常认为具备以下条件者可采取保守治疗:(1)患者一般情况较好;(2)病因除外胰腺慢性疾病;(3)单发小囊肿(直径<6 cm),无进行性增大趋势且存在时间<4周;(4)囊肿壁薄,囊腔不与主胰管相通,囊液性质稳定,除外出血、感染等并发症。此类患者建议每6~8周行腹部B超或CT/MRI随访,无症状出现或囊肿无进行性增大者,可继续观察。
推荐意见10:CP引起的PPC,很难自行消散,建议积极引流,若有恶变倾向,建议早期外科手术治疗。
证据质量:C;推荐强度:弱;共识水平:81.5%
20%~40%的CP并发PPC多因主胰管或分支胰管梗阻引起,相关因素不解除很难使囊肿消散,因此建议积极引流。CP患者中直径<5 cm但与胰管相通的PPC,可积极采取内镜下经乳头引流[28]。CP并发的PPC存在一定恶变风险,对于有恶变倾向的PPC,建议尽早行外科手术治疗。部分假性囊肿破裂也建议外科手术干预。
四、外科手术治疗
推荐意见11:PPC/WON与胃、十二指肠壁相隔较远且无法行经皮穿刺引流者,建议采用囊肿空肠Roux-en-Y吻合术治疗。
证据质量:B;推荐强度:弱;共识水平:82.1%
外科手术治疗PPC的方式主要有内引流和外引流[14],其中内引流包括囊肿胃引流术和囊肿空肠吻合术。囊肿空肠吻合术是临床上应用最多的外科内引流术,以囊肿空肠Roux-en-Y吻合术效果较为理想,主要适用于囊肿位置较低者。内引流应在囊肿壁成熟后实施,但随着内镜引导下囊肿引流术的发展,外科囊肿胃引流术已逐渐被取代。外科内引流效果较外引流好,外引流是指囊肿外引流术,仅适用于囊肿形成时间短(<4周)、囊肿壁薄又继发细菌感染者,目前临床应用较少。
推荐意见12:PPC/WON经内镜及保守治疗无效,需外科手术治疗时优先选择腹腔镜下内引流术。
证据质量:B;推荐强度:强;共识水平:88.9%
PPC外科手术指征与治疗指征相同,对于无法采用内镜下引流或经皮穿刺引流的患者,排除手术禁忌证后可采用外科手术进行治疗。外科手术治疗PPC,术后并发症发生率高达25%,病死率为5%[29]。腹腔镜手术发展迅速,术式与传统外科手术相似,具有创伤小、恢复快等明显优势,但操作技术要求较高。腹腔镜下假性囊肿腔内引流术在降低术后并发症发生率、减少术后疼痛和早期恢复等方面显著优于常规开腹手术[30-31]。
五、经皮置管引流术(percutaneous catheter drainage,PCD)
推荐意见13:PPC/WON若囊肿距离胃壁较远、具备经皮穿刺路径者,建议采用PCD。
证据质量:B;推荐强度:强;共识水平:96.3%
PCD是较早应用于PPC治疗的微创技术。大多数PCD是在腹部B超或CT引导下进行,无需等待囊肿壁成熟,多应用于AP急性渗出期(<4周)的APFC治疗,但其对操作者技术要求高,且部分患者易复发。目前PCD也可用于部分PPC/WON的引流,具有操作简便、可实时观察引流液性状等优点。
一般认为,PCD适合囊肿距离胃壁较远、胰管解剖结构正常的PPC,也可作为病情危重、手术风险大的患者的紧急治疗手段。PPC患者若症状反复发作,且存在重度感染、囊内出血、囊肿破裂等危及生命的并发症,但无条件及时行内镜下处理时,建议采用PCD,若效果仍不理想可考虑行外科手术治疗。国内研究显示,PCD治疗PPC的总有效率为62%,无死亡病例[32]。PCD的失败率约为16%,复发率为7%,并发症发生率为18%[33]。CP合并PPC患者多数存在胰管结构异常及囊肿与主胰管相通,故PCD治疗失败率高。
推荐意见14:PCD引流后有一定的出血、感染、胰瘘或肠瘘发生率,需密切观察并及时干预。
证据质量:C;推荐强度:弱;共识水平:96.3%
PCD的常见并发症有出血、感染、脓毒血症、胰瘘和肠瘘等,少见并发症包括脾损伤、肺炎、气胸、脓胸、心肌梗死、肠梗阻等。研究发现PCD与胰瘘形成的风险增加相关,PCD引流后胰瘘发生率高达14%[34]。PCD引流过程中,可能引流液会突发变为血性液体,要考虑腹腔血管破裂可能,必要时可行紧急数字减影血管造影术(digital subtraction angiography, DSA)或外科手术止血。空腔脏器和血管损伤也是PCD引流PPC的重要并发症,PCD相关出血并发症大多需要手术干预治疗,但术后总体病死率与无出血并发症患者相似[35]。PCD引起的逆行感染也较常见,但对于感染的来源还存在争论,亦可由肠道菌群移位引起。
严格意义上说,胰瘘并不属于PCD引流的直接并发症,因PPC或WON本身与主胰管或分支胰管相通,引流液后期会呈现半透明的清亮胰液、伴引流液淀粉酶升高(通常>1 000 U/ml),对假性囊肿的起源有诊断价值。大部分肠瘘并非引流管直接损伤肠壁引起,与肠道所处的腹腔环境有关(胰液侵蚀或感染),也有一部分IPN引流后直接表现为肠瘘。
六、内镜逆行胰胆管造影(endoscopic retrograde colangiopancreatography,ERCP)引流术
推荐意见15:PPC/WON与胰管相通、继发于CP者,可选择ERCP放置胰管支架引流。
证据质量:B;推荐强度:强;共识水平:100%
ERCP是最早应用于PPC治疗的内镜技术。内镜下引流PPC是指在内镜引导下将囊肿内囊液引流至消化腔道,以达到缓解症状、消散囊肿的目的。ERCP引导下的内引流又称为经乳头囊肿引流术,通过胰管内置入支架解除导管狭窄,恢复导管连续性,此法主要适用于与主胰管相通的PPC,如CP相关PPC[28]。国内学者[36]报道ERCP治疗PPC安全、有效,一般胰管支架需要留置的时间较长(>4个月),必要时可中途更换支架。ERCP最常见的并发症是术后急性胰腺炎,其次是囊肿感染。胰头部假性囊肿大部分与主胰管相通,少数由于囊肿压迫无法实施ERCP者,建议先经消化腔道引流囊肿,后进行ERCP。
推荐意见16:ERCP引流后有并发感染或急性胰腺炎风险,对于胰管部分中断的PPC/WON,必要时需联合EUS引流治疗。
证据质量:C;推荐强度:弱;共识水平:100%
一项单中心RCT研究[37]分析比较外科手术与内镜(ERCP联合EUS)两种不同引流方式在PPC治疗中的应用,发现PPC内镜引流效果不亚于外科手术引流,两组术后复发率差异无统计学意义,且内镜组在住院时间、费用等方面优于外科手术引流。各项研究证实,与PCD相比,内镜下治疗胰周液体积聚(PPC/WON)初始治疗成功率较高,再干预率和不良事件发生率较低,住院时间较短[38-40]。
经ERCP胰管支架植入术联合EUS下囊肿引流术能否降低囊肿复发率尚存争议。一项多中心研究认为,ERCP联合EUS引流PPC与单用EUS引流效果相当,经消化道引流联合经十二指肠乳头引流不能提高囊肿引流效果,同时也不能预防囊肿复发[41]。胰腺外伤常致胰管中断,84%的胰腺外伤后胰周积液患者,主胰管中断后通过支架长期引流,可降低因胰管离断综合征所致的囊肿复发[42]。研究证实,对于胰管部分中断的PPC/WON,ERCP联合EUS可减少胰瘘的发生[43]。
七、EUS引流术
推荐意见17:推荐EUS引导下的穿刺引流术为治疗PPC/WON的首选治疗方法,操作成功率高,并发症发生率及复发率低,能明显减少住院时间和费用。
证据质量:A;推荐强度:强;共识水平:100%
EUS引导下的假性囊肿穿刺引流术技术成功率高,并发症发生率低,远期效果好,目前认为是PPC/WON首选的内镜治疗技术[8]。EUS可分辨囊液中的坏死物,区分PPC和WON,通过多普勒探测囊内及囊肿周边血管分布,可避开血管选择最佳穿刺点[44]。国内学者最早于2006年[45]即开展了EUS引导下穿刺引流术,被认为是一种治疗PPC安全、有效的新方法。EUS的内镜治疗原则包括(1)穿刺在避开大血管的前提下,应选择在囊肿最膨出处;(2)囊肿达到治疗指征;(3)必要时行EUS-FNA排除囊内生肿瘤。
推荐意见18:不推荐普通内镜直视下的PPC/WON穿刺引流,操作失败率及并发症发生率高。
证据质量:B;推荐强度:强;共识水平:100%
EUS引导下囊肿穿刺引流术治疗成功率为80%~100%,显著高于传统内镜下穿刺引流(33.3%~72.4%)[46]。1989年,Cremer等[47]首次报道普通胃镜引导下引流即内镜直视下穿刺引流,在PPC和胃或十二指肠之间通过置入塑料双猪尾支架引流囊液。传统内镜直视下穿刺引流包括内镜下囊肿胃造瘘术及内镜下囊肿十二指肠造瘘术,应用范围局限[14],其影像学上囊肿与消化道壁之间的距离小,仅适用于消化道壁无静脉曲张,并排除假性动脉瘤及恶性病变等情况。虽然直视下引流具有创伤小的特点[48],但因无法避开血管,操作成功率较EUS引导技术低[46],出血及感染风险高,目前已被EUS替代。
经自然腔道内镜手术(natural orifice translumenal endoscopic surgery, NOTES)也被报道应用于PPC/WON的治疗中,效果与腹腔镜及开放式手术相当,具有创伤小的优势,但操作技术要求高,需要多学科团队同时参与[49-50],目前国内开展较少。
推荐意见19:EUS穿刺引流术应选择囊肿距离消化道壁最近处穿刺,穿刺路径避开血管,遵循置入导丝-电切-扩张窦道-置入支架步骤,必要时先行FNA明确囊液性质。
证据质量:A;推荐强度:强;共识水平:96.3%
EUS引导下的囊肿穿刺引流术,具体操作步骤如下[51]:(1)EUS下确定假性囊肿的位置、大小,选择合适的穿刺点;(2)经内镜孔道置入19 G穿刺针,刺入PPC内,X线引导下插入导丝至PPC内,使导丝在PPC中盘旋;(3)沿导丝置入电切刀,在胃壁与囊壁之间建立通道,并行球囊扩张;(4)置入引流支架(塑料支架或金属支架)。近期亦有“一体式”支架的临床应用,提高了操作便捷性。EUS无法明确囊肿性质者,可先行FNA明确诊断。
八、EUS引流术的支架选择
推荐意见20:塑料支架可用于PPC的引流,但对于WON引流效果欠佳。
证据质量:B;推荐强度:强;共识水平:100%
国内应用较多的囊肿引流支架是直径7~10 Fr(2~3 mm)的双猪尾塑料支架。有研究比较不同直径引流支架的效果发现[52],10 Fr双猪尾塑料支架能较快引流囊肿,缩短患者住院时间,而感染率、囊肿复发率与7 Fr支架相近。一项研究通过长期随访(10~103个月)使用单根7 Fr塑料支架引流的PPC,发现治疗成功率(2周囊肿缩小50%以上)达100%[17]。成分单一的非复杂性PPC塑料支架引流成功率与支架的直径、使用数量无关[15]。塑料支架易发生堵塞、移位,故建议条件许可的情况下放置多根猪尾管进行引流,以降低并发症的发生率。此外,有研究报道塑料支架治疗PPC,有更好的经济—效益比[53]。
推荐意见21:推荐双腔固定金属支架(lumen-apposing metal stent,LAMS)用于PPC/WON引流,尤其适用于坏死物成分较多的WON引流。
证据质量:A;推荐强度:强;共识水平:100%
LAMS(又称“双蘑菇头”或“双头”金属支架)是基于胆道金属支架结构上进行改良的引流支架,具有防止移位的双翼(图2),末端去除了胆道金属支架的毛刺,表面覆有生物膜,支架两端分别可紧贴胃壁和囊肿内壁,支架长10 mm,内径孔径可达10~20 mm,囊肿引流效果更好。LAMS放置技术并不复杂,操作时间短,放置成功率高。
近期有研究报道[54],相较于塑料支架,LAMS治疗PPC成功率高(95.6%比89.4%)。国内近期一项进口LAMS(AXIOS)注册研究显示[55],LAMS的操作成功率达100%,囊肿引流成功率达93.3%,感染、支架堵塞和移位率分别为13.3%、10.0%和6.7%。国内另一项国产LAMS的研究亦正在进行中[56]。多项Meta分析证实,在治疗胰周液体积聚尤其是WON中,金属支架优于塑料支架[57-59]。LAMS的另一独特优势是对于治疗过程中囊肿出现感染的患者,在保证支架不移位的基础上,可行内镜下坏死组织清除术,为PPC并发感染的患者创造了微创治疗条件[60]。相较于PPC,WON的内镜下治疗成功率低与WON内部坏死物含量有直接联系[16]。

图2 双腔固定金属支架示意图
推荐意见22:不推荐其他类型的金属支架用于PPC/WON的引流。
证据质量:A;推荐强度:强;共识水平:85.7%
2010年,国际首次报道使用胆道覆膜金属支架引流PPC,发现全覆膜胆道金属支架引流PPC有效性及安全性较好[61]。可通过术后调整金属支架位置防止支架移位,另外可根据囊肿大小、囊液性状考虑是否需在金属支架内再置入鼻囊肿管或塑料支架协助引流及冲洗。与塑料支架相比,金属支架灵活度和张力较大,直径较粗,引流充分、有效且通畅时间较长,在引流效果及操作性方面优于塑料支架[62]。但由于其圆柱体形状易移位,胆道覆膜金属支架临床应用于PPC/WON的治疗逐渐减少。有研究比较两种不同金属支架引流安全性发现,新型LAMS较胆道覆膜金属支架安全性更高,并发症发生率显著低于胆道覆膜金属支架[63-64]。
推荐意见23:目前无证据支持LAMS需联合塑料支架用于引流PPC/WON。
证据质量:B;推荐强度:强;共识水平:96.6%
2018年,有学者[65]首次报道LAMS联合塑料支架治疗PPC。研究通过回顾性分析47例采用LAMS联合塑料支架引流的PPC患者疗效,发现LAMS组再次干预率为17%,而LAMS联合塑料支架组均无需再次干预。另有研究表明,LAMS联合塑料支架不良事件发生率显著低于单独使用LAMS(10%比42.9%)[66]。但新近研究认为LAMS联合塑料支架引流胰周液体积聚的成功率和并发症发生率与单用LAMS相比差异无统计学意义[67]。一项纳入68例PPC患者的研究发现,LAMS联合塑料支架对囊肿引流成功率、并发症发生率以及二次介入率无影响[68],进一步亚组分析发现,无论是PPC还是WON,LAMS联合使用塑料支架均无明显必要。另一项回顾性分析236例PPC和34例WON的研究显示,放置LAMS后置入塑料支架并不能增加治疗成功率和减少不良事件发生率[69]。基于上述结果,目前暂无证据支持LAMS需联合塑料支架引流PPC,需要进行更大规模的前瞻性临床研究。
推荐意见24:LAMS若用于PPC/WON伴胰管离断综合征,建议拔除后替换成塑料支架,以保持受损胰管的持续引流,防止囊肿复发。
证据质量:B;推荐强度:强;共识水平:89.7%
胰管离断综合征是PPC患者中一个重要但易被忽视的并发症,临床表现为持续增大的假性囊肿压迫症状,其在坏死性胰腺炎患者中发生率高达50%[70]。胰管离断综合征的特征是主胰管完全破坏,导致上游胰腺的胰管与下游主胰管分离,可通过MRCP进行诊断。分离的胰腺仍然具有功能,在腺泡萎缩不存在的情况下,可导致持续性的无法自行吸收的胰周积液。胰周液体积聚治疗后的整体复发率为10%~30%,主要发生在伴有胰管离断综合征的患者中[69]。研究发现在接受内镜引流的PPC患者中,主胰管完整者均未出现复发,而94例胰管离断综合征患者中有7例复发[71]。ERCP的经乳头引流治疗胰管离断综合征也有较好疗效[72];EUS引导下的跨壁塑料支架维持引流并发症发生率低[73]。因此,对于应用LAMS治疗的PPC伴胰管离断综合征患者,建议后期将金属支架替换成塑料支架,以促进断开胰管的持续引流,防止囊肿复发。
九、EUS引流术支架的并发症
推荐意见25:塑料支架引流PPC存在支架堵塞、移位及并发感染、出血等风险。
证据质量:B;推荐强度:强;共识水平:96.6%
塑料支架引流PPC并发症发生率约为13%(95%CI0.057~0.218)[17],主要包括移位或脱落、闭塞、感染[74]。少数研究报道塑料支架引流PPC出现操作相关出血并发症,与支架本身无关[75]。长期留置塑料支架有一定的肠穿孔风险,治疗PPC时应避免长期放置[76]。出现塑料支架相关感染等并发症时,一般建议拔除或更换支架。
移位是指支架完全进入囊内或完全移出至胃内,导致囊液未能有效引流,最终是否需要内镜取出,取决于移位的支架能否自行排出。移位多见于塑料支架及胆道金属支架,LAMS具有抗移位双翼,能够有效防止移位发生。
推荐意见26:LAMS有一定程度的并发出血风险,需密切观察病情,一旦出血需紧急拔除支架,必要时行DSA止血或外科手术治疗。
证据质量:B;推荐强度:弱;共识水平:96.6%
出血是目前报道最多、最受临床关注的LAMS并发症[77]。内镜下引流术后任何需要介入、输血及留院观察的出血事件即可认为出现出血并发症。LAMS术后出血多由假性动脉瘤引起。在LAMS国际应用的早期阶段,出血并发症发生率较高,与术前血管风险判断不足、穿刺路径选择差异、支架留置时间过长等有关。一项随机对照试验的中期分析结果表明[78],塑料支架组未见不良事件发生,而LAMS组不良事件发生率为50%,主要包括迟发性出血、包埋综合征以及支架致胆道狭窄后引起的梗阻性黄疸。随后研究证实LAMS与塑料支架相比,引流后出血的发生率较高(21% 比1%)[79]。有报道LAMS的延迟出血发生率为17%,从置入支架到出血的平均时间为9.5 d[62]。
LAMS出现出血并发症的可能原因:(1)放置LAMS后囊肿迅速塌陷,支架远端刺激囊肿后壁,促进假性动脉瘤的形成,即之出血[80];(2)部分囊肿直径巨大,尽管引流前已完善影像学检查评估,但由于囊肿的张力影响,可能出现血管遗漏的情况[77]。大多数出血通过保守治疗能有效控制,部分需DSA止血,必要时采取外科手术[80]。LAMS放置3周左右应完善CT检查,判断囊肿引流效果同时评估出血风险,如达到引流成功,需尽早拔除支架[81]。出血可通过临床表现联合影像学检查发现。一旦出现出血,建议紧急拔除支架,判断出血点及出血原因,对症治疗;当出血量>400 ml时,建议内镜、影像、介入、外科多学科会诊。
关于LAMS出血的预防,目前尚无有效办法。通过EUS或增强CT评估血供情况,有助于评估出血风险。在LAMS中放置塑料支架可减少LAMS支架端与囊壁或血管直接接触,从而降低出血的发生率,或在患者出院前用塑料支架代替LAMS可能是降低延迟出血风险的可行方法[82]。
推荐意见27:LAMS置入后若出现发热等感染表现,需行内镜直视下坏死组织清除术。
证据质量:B;推荐强度:弱;共识水平:93.1%
PPI抑制胃酸产生可以减少囊肿引流处消化道溃疡、出血或穿孔等不良事件[8]。然而,一项回顾性研究发现经内镜引流的WON接受PPI的患者可能需要进行更多次的内镜下坏死物切除术才可治疗成功,认为这可能与PPI减少胃酸进入囊腔,囊腔中固体坏死碎片溶解减少相关[83]。
LAMS总体相对安全,并发症发生率大约为6%[84]。术后出现发热、炎症指标(体温>38.0℃、白细胞>10.0×109/L、C反应蛋白>10 mg/L、降钙素原>0.5 ng/ml)数值升高、血培养或囊液培养阳性应考虑囊肿感染。建议围术期使用抗生素防治感染,对于出现感染的患者应加强抗生素的使用。如PPC演变为IPN,则需要实施经胃内镜直视下坏死组织清除术。感染的原因可能由于支架堵塞或引流不畅,既往塑料支架闭塞率高达18%[85]。研究发现,LAMS在PPC引流中的一过性闭塞率达23.7%(28/118),即便是术前完全无固体坏死物的PPC,支架闭塞发生率也有17.5%,可能与支架被固体食物残渣堵塞相关[86]。因此,LAMS置入术后的必要性清理对防治囊肿感染有积极意义。
推荐意见28:LAMS的最佳拔除时机为3周~2个月,留置时间过长会导致支架包埋。
证据质量:A;推荐强度:强;共识水平:100%
LAMS难以取出的情况通常和支架留置时间有关。“包埋综合征”是指组织嵌入支架,内镜下取出困难,与支架放置时间过长有关,部分可内镜下取出,部分则需要外科处理。其他罕见并发症还包括贲门梗阻[87]。有个案报道[88]1例支架放置5个月出现“包埋”的患者,最终内镜下用活检钳拆除,但因LAMS的编织方式改变,该方法并不适用于多种类型的LAMS。研究发现,PPC囊肿直径≤7 cm、支架留置时间≥4周是LAMS并发症发生的危险因素[84]。关于支架拔除时间目前均无统一共识,近期一项研究建议在PPC已消除的情况下,可3~4周内拔除LAMS[82]。此外,考虑远期出血风险,LAMS放置时间最迟不超过2个月[89]。相对于PPC,WON留置LAMS的时间可稍作延长。
十、药物治疗及随访
推荐意见29:抑酸药及胰酶制剂可用于无症状、暂不需干预的PPC/WON维持治疗。
证据质量:C;推荐强度:弱;共识水平:82.8%
无症状、暂不需干预的PPC/WON可药物辅助保守治疗,以期囊肿自行吸收[8]。多中心队列研究表明,PPI与AP患者假性囊肿发生率减低相关[90]。
在广泛的坏死性胰腺炎外分泌胰腺功能不全合并PPC/WON时,推荐联合使用胰酶制剂[91]。生长抑素类似物是临床上常用的保守治疗药物,其通过抑制胰腺分泌,促进PPC吸收,但目前缺乏证据较强的临床研究证实。
研究报道,大剂量胰酶(40 000 IU tid)替代成功治疗难治性多发PPC,可能与外源性胰酶补充负反馈调节内源性胰液分泌,进而减少囊液积聚有关[92]。大剂量胰酶制剂应用于PPC/WON治疗的文献证据较少,具体作用机制及临床推广有待进一步研究。
推荐意见30:PPC/WON经内镜或其他方式治疗后需密切随访,建议每隔3~6个月行影像学复查,必要时再次干预。
证据质量:B;推荐强度:弱;共识水平:100%
PPC/WON经内镜支架引流后,有一定的远期复发率,为10%~30%,主要发生在伴有胰管离断综合征的患者中[70,74]。因此,建议PPC/WON治疗后,每隔3~6个月行腹部CT或B超检查,随访过程中出现囊肿进行性增大或伴随症状者,需进一步完善影像学检查加以综合评估,必要时再次干预[93]。
总之,PPC和WON依据囊肿的起源、部位、直径大小等因素,需制定个体化的治疗方案,其中EUS尤其是LAMS的应用为PPC的治疗带来了新的选择(图3)。不同阶段的治疗方案亦不尽相同,整个治疗过程需要消化内镜、胰腺外科、影像医学科、放射介入科等多学科医师的团队合作,才能取得最佳的治疗效果。
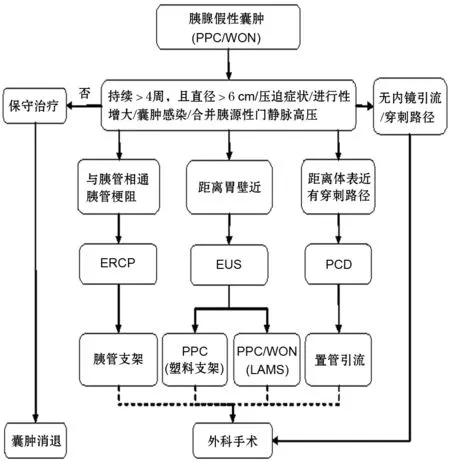
图3 胰腺假性囊肿(PPC/WON)的治疗方案选择
利益冲突所有作者声明无利益冲突
参与制定共识意见专家组成员:
李兆申(海军军医大学第一附属消化内科),金震东(海军军医大学第一附属消化内科),令狐恩强(解放军总医院第一医学中心消化内科),张澍田(首都医科大学附属北京友谊医院消化内科),杨爱明(北京协和医院消化内科),孙思予(中国医科大学附属盛京医院消化内科),邹晓平(南京大学医学院附属鼓楼医院消化内科),周平红(复旦大学附属中山医院内镜中心),柴宁莉(解放军总医院第一医学中心消化内科),钟良(复旦大学华山医院消化内科),陈幼祥(南昌大学第一附属医院消化内科),唐秀芬(黑龙江省医院消化内科),胡兵(四川大学华西医院消化内科),张筱凤(浙江大学医学院附属杭州市第一人民医院消化内科),王雷(南京大学医学院附属鼓楼医院消化内科),覃山羽(广西医科大学第一附属医院消化内科),李鹏(首都医科大学附属北京友谊医院消化内科),郭晓钟(北部战区总医院消化内科),丁震(中山大学附属第一医院消化内科),王晓艳(中南大学湘雅三医院消化内科),程斌(华中科技大学同济医学院附属同济医院消化内科),柏健鹰(陆军军医大学第二附属医院消化内科),钟宁(山东大学齐鲁医院消化内科),李汛(兰州大学第一医院普外科),李维勤(东部战区总医院普外科),孙备(哈尔滨医科大学附属第一医院普外科),金钢(海军军医大学长海医院胰腺外科),李非(首都医科大学宣武医院普外科),耿小平(安徽医科大学第二附属医院普外科),刘威(中南大学湘雅二医院普外胆胰外科),卲成伟(海军军医大学第一附属放射诊断科),唐涌进(中华消化内镜杂志编辑部),吕芳萍(中华胰腺病杂志编辑部)
执笔者:杜奕奇(海军军医大学第一附属消化内科),王凯旋(海军军医大学第一附属消化内科),朱惠云(海军军医大学第一附属消化内科)

