106株红色毛癣菌基因分型与药敏分析
郑文爱 乔凤 唐小正 吴伟伟 王皇玉
(1.海南省第五人民医院检验科,海口 570206;2.海南省第五人民医院皮肤科,海口 570206)
红色毛癣菌(Trichophytonrubrum)是最常见的一种皮肤癣菌,也是浅部真菌病的主要病原菌之一。红色毛癣菌主要侵犯人的皮肤、指甲/趾甲,偶可侵犯人的毛发,所致癣病病程持久,且治愈后易复发。本资料主要对海南地区分离自皮肤癣菌病患者的106例红色毛癣菌临床分离株进行基于红色毛癣菌核糖体rDNA非转录区(NTS)的基因分型研究和药敏试验,探讨基因型和感染部位、基因型和药物敏感性的关系。
1 材料与方法
1.1 材料
受试菌株 106株红色毛癣菌来源于2015年1月1日—2019年5月30日海南岛内多个市县浅部真菌感染的患者。菌株均经形态学和核糖体内转录间隔区(ribosomal internal tran scribeds pacer(ITS)region)序列分析鉴定符合红色毛癣菌。其中来源于男性患者71株,女性患者35株,年龄1~68岁(平均31.8岁)。股癣49株,体癣27株,甲真菌病16株,手足癣11株,面癣3株。质控菌株为广东省菌种保藏中心提供的ATCC-MYA-4438和ATCC 00294。
抗真菌药物 氟康唑(FCZ)、伊曲康唑(ITR)、伏立康唑(VCZ)、酮康唑(KETO)、特比萘芬(TER),均购自北京华中海威公司,5种药物的纯度分别是:98.5%、99.0%、99.0%、99.0%、99.0%。5种药物的贮存液溶剂除了氟康唑用灭菌蒸溜水溶解外,其余4种脂溶性药物均需溶于二甲基亚砜(DMSO)。抗真菌药贮存液浓度为试验中最高浓度的100倍,分装于2 mL冻存管中置于-80℃存储备用。各药物工作浓度范围为:氟康唑0.125~64 μg/mL,酮康唑 0.0313~16 μg/mL,特比萘芬、伊曲康唑、伏立康唑0.001~0.5 μg/mL。
试剂盒 高保真DNA提取试剂盒(购自华大基因公司),试剂盒提供的扩增NTS区引物(5′-3′):25SCON2:TAGACCGTCGTGAGACAG、NS1-R:GAGACAAGCATATGACTAC;扩增TRS-1区引物(5′-3′):TrNTSF-2:ACCGTATTAAGCTAGCGCTGC、TrNTSR-4:TGCCACTTCGATTAGGAGGC;扩增TRS-2区引物(5′-3′):TrNTSR-1:CTCAGTCGAACCGTGAGGC、TrNTSC-1:CGAGACCACGT GATACATGCG。
1.2 方法
DNA提取及PCR扩增 利用NTS区的特异性引物(25SCON2、NS1-R)扩增出NTS作为模版,再各自利用TRS-1 及TRS-2区的特异性引物(TrNTSF-2、TrNTSR-4和TrNTSR-1、TrNTSC-1)扩增出TRS-1 及TRS-2。
TRS-1、TRS-2分型结果判读 序列测定显示NTS区包含两个串联重复亚单位,TRS-1以200 bp为一个拷贝单位串联重复排列,紧接一个 49 bp的部分重复。TypeⅠ型为一个 200 bp拷贝紧接一个 49 bp的部分重复;TypeⅡ型为两个串联重复200 bp拷贝紧接 一个49 bp的部分重复;TypeⅢ型为3个串联重复200 bp拷贝紧接一个49 bp的部分重复;TypeⅣ型为4个串联重复200 bp拷贝紧接一个49 bp的部分重复;<200 bp或条带复杂的归入其他带型。同理,TRS-2以77 bp为一个拷贝单位串联重复排列,紧接1个46 bp的部分重复, TypeⅠ型为1个77 bp拷贝紧接1个46 bp的部分重复;TypeⅡ型为两个串联重复 77 bp拷贝紧接 1个46 bp的部分重复;<77 bp或条带复杂的归入其他带型。
抗真菌药物敏感性试验 采用微量液体稀释法(参照 CLSI-M38-A2 方案)[1],质控菌株ATCC©MYA-4438红色毛癣菌。特比萘芬、伊曲康唑、伏立康唑试验浓度0.001~0.5 μg/mL,酮康唑药物浓度0.0313~16 μg/mL,氟康唑药物浓度0.125~64 μg/mL。
2 结 果
106株红色毛癣菌基因分型TRS-1有5种带型,其中TypeⅠ52株(49.06%),TypeⅡ14株(13.21%),TypeⅢ5株(4.72%),TypeⅣ型3株(2.83%),其他带型32株(30.18%)。TRS-2有3种带型,其中TypeⅠ68株(64.15%),TypeⅡ6株(5.66%),其他带型32株(30.19%)。TRS-1以I型和其他型为主,TRS-2也是以I型和其他型为主。此二种主要基因型在不同部位的分型中也是一致的。药敏试验结果显示在不同感染部位中均以特比萘芬GM(geometric mean MIC)最低,其次是伏立康唑,排在第三的是伊曲康唑。不同感染部位药物敏感试验结果及基因型见表1、2。
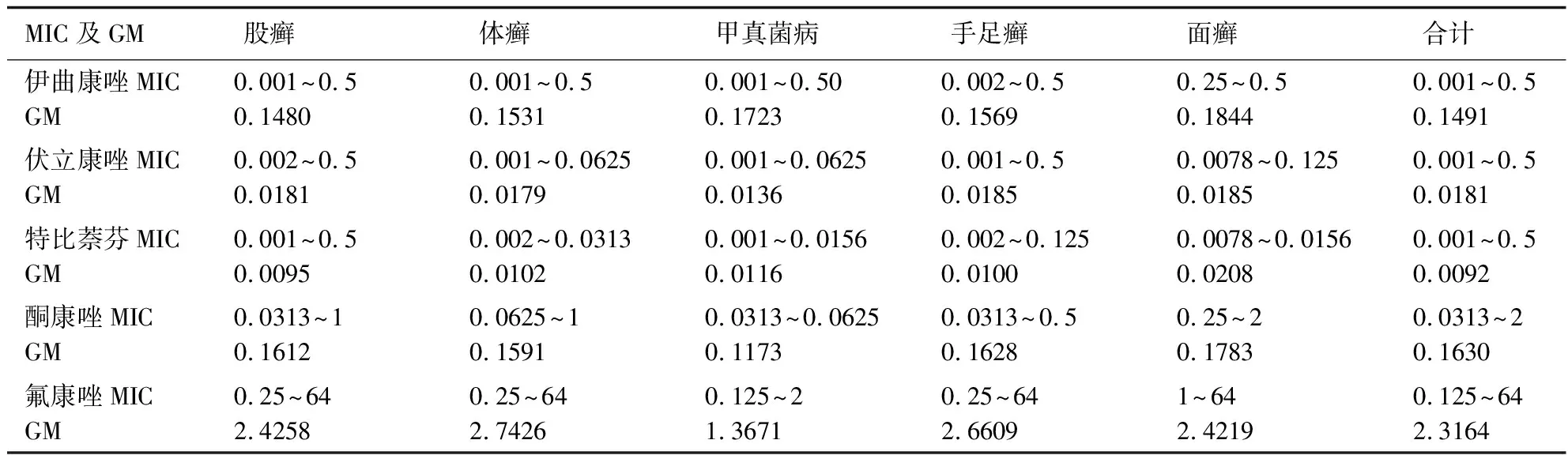
表1 不同部位分离的106株红色毛癣菌MIC范围和GM
因红色毛癣菌目前尚无药敏折点,所以本药敏试验结果所说的不敏感株是指伊曲康唑或伏立康唑或特比萘芬MIC≥0.5 μg/mL,酮康唑MIC≥16 μg/mL,氟康唑MIC≥64 μg/mL的红色毛癣菌株。结果显示在不同感染部位菌株中伊曲康唑MIC≥0.5 μg/mL的有33株,其中股癣15株、体癣13株、足癣2株、面癣2株、甲真菌病1株;伏立康唑MIC≥0.5 μg/mL的有2株,股癣和足癣各1株;特比萘芬MIC≥0.5 μg/mL有2株,均为股癣;氟康唑MIC≥64 μg/mL的有12株,其中股癣9株、体癣2株、手癣1株;酮康唑均MIC<4 μg/mL。不敏感株多出现在股癣。其中有5株对伊曲康唑(MIC≥0.5 μg/mL)不敏感的股癣株同时对氟康唑(MIC≥64 μg/mL)不敏感,1株同时对特比萘芬(MIC≥0.5 μg/mL)不敏感;1株对伏立康唑不敏感的股癣株同时对氟康唑(MIC≥64 μg/mL)不敏感。不敏感菌株TRS-1分型TypeⅠ为主,TRS-2分型也是TypeⅠ为主。不同感染部位耐药菌株基因型分布见表3。
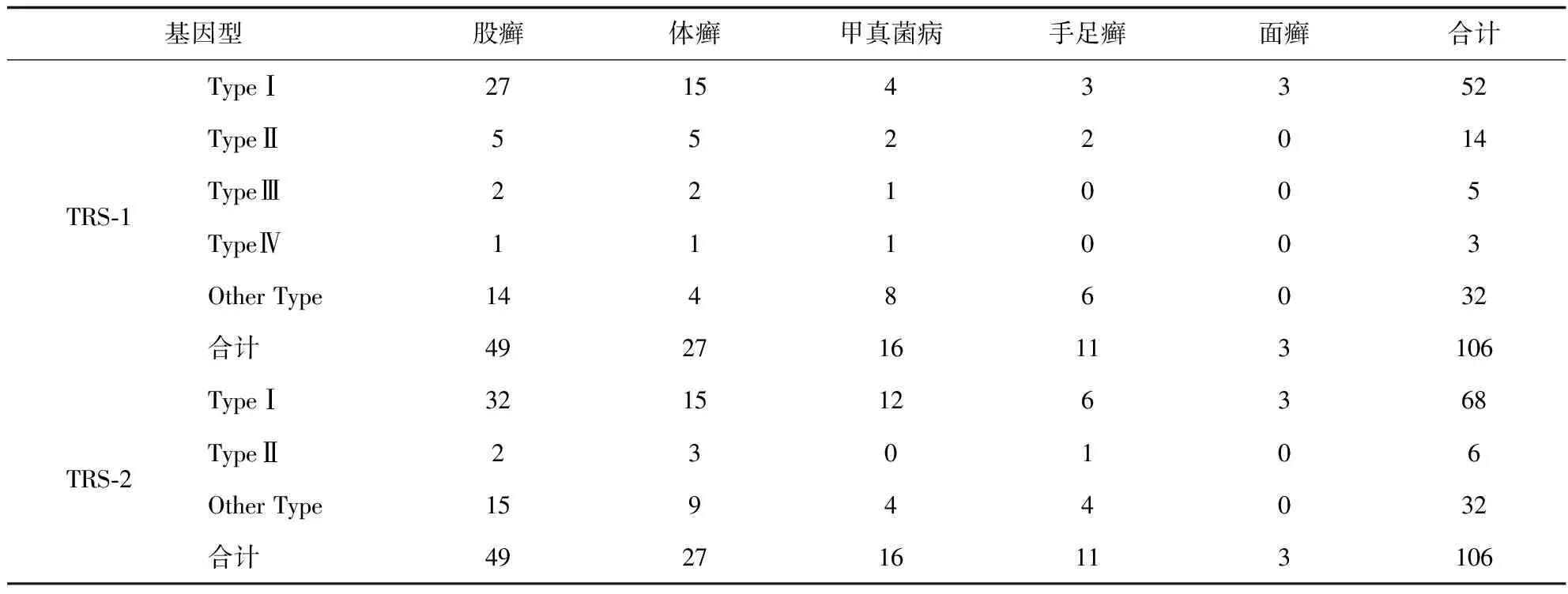
表2 不同部位分离的106株红色毛癣菌基因型分布
图1 TRS-1部分扩增条带图(TypeⅠ:4,6,7,10,11,12,14;TypeⅣ:9;Other Type: 1,2,5,8,13) 图2 TRS-2部分扩增条带图(TypeⅠ: 1,3~7,11,12;TypeⅡ:9;Other Type: 2,8,10,13)
3 讨 论
红色毛癣菌基因分型方法有很多,Jackson等[1]报道了红色毛癣菌NTS区的两个高变区:TRS-1区和TRS-2区,各由一种串联重复序列组成,不同的菌株其重复次数不同,少数菌株还存在缺失、转换或颠换现象,成为红色毛癣菌株独特的分子指纹。国内外学者[2-3]通过几种方法的比较,发现TRS-1、TRS-2指纹图谱最适合用于红色毛癣菌种内分型,国内学者[4-6]也以此为基础进行红色毛癣菌种内分型。本研究中我们共收集了来自海南岛各地患者的106株红色毛癣菌,选用Jackson等[1]的TRS-1和TRS-2分型方法进行种内分型,TRS-1分5种带型,占比最多的是TypeⅠ,其次是其他型;TRS-2分出3种带型,占比最多的是TypeⅠ,其次是其他型;说明海南地区流行的红色毛癣菌TRS-1基因型以一个 200 bp拷贝紧接一个 49 bp的部分重复的TypeⅠ为主,和TRS-2基因型以77 bp为一个拷贝单位串联重复排列,紧接1个46 bp的部分重复的TypeⅠ为主。这与闫玮等[4]的研究相同,说明本地区流行的红色毛癣菌与国内其他地区流行的基因型差异不大。本结果发现不同感染部位来源的菌株TRS-1分型均以TypeⅠ和其他型为主,这与占萍等[7]通过两足一手病例分析发现80%以上的患者手足部位菌株基因型相同,说明可能红色毛癣菌基因型与菌株来源有关,与感染部位无关。但因本研究的菌株数较少(106株),尚不能完全肯定此论述。
本研究依据“CLSI-M38-A2”方案检测这106株红色毛癣菌药敏,试验结果显示5种抗真菌药物对本地区的红色毛癣菌表现出不同的活性。MIC几何均数由低至高分别为特比萘芬(0.0092 μg/mL)、伏立康唑(0.0181 μg/mL)、伊曲康唑(0.1491 μg/mL)、酮康唑(0.1630 μg/mL)、氟康唑(2.3164 μg/mL)。
药敏结果共有42株菌MIC≥0.5或≥64 μg/mL(见表3),其中7株出现同时对两种药不敏感的情况。经TRS-1和TRS-2分型,这些不敏感株的常见TRS-1的基因型以TypeⅠ为主;TRS-2的常见基因形是TypeⅠ和其他型。这与本地区的流行基因型基本一致。说明本地区的不敏感菌株可能与来源有关。
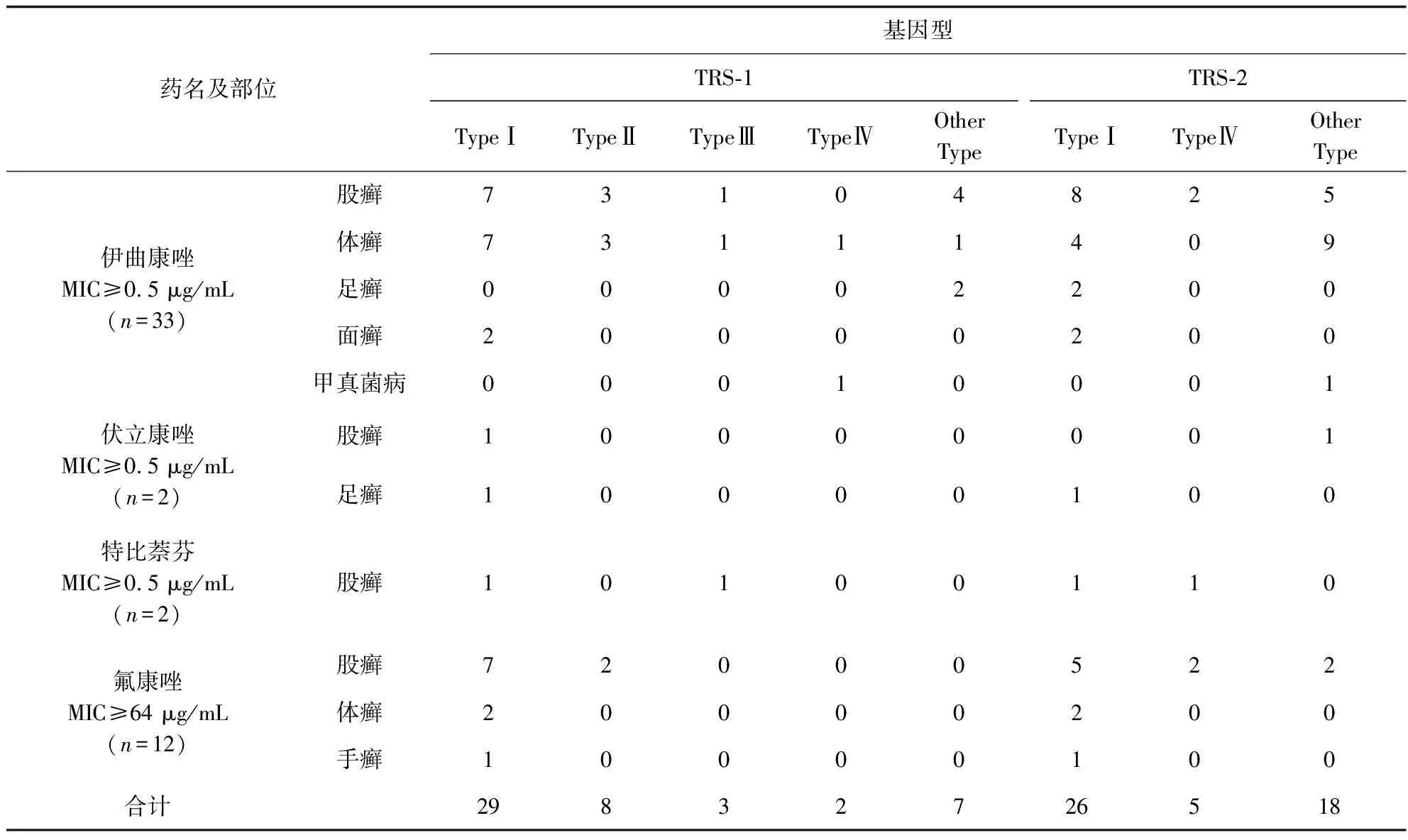
表3 耐药菌株基因型分布情况
红色毛癣菌的种内分型有许多潜在的临床和流行病学应用价值,如通过基因分型可以证实感染的来源,在临床上当抗真菌治疗失败时可以确定是复发还是再感染,判断某些患者的慢性感染是否由某种菌株的某一特定基因型引起等。

