Castor支架及体外预开窗Ankura支架用于近端锚定区不足Stanford B型主动脉夹层胸主动脉腔内修复术
宋 威,王砚亮*,张小涛,李发中,潘 明
(1.郑州大学附属洛阳中心医院介入科,2.心脏外科,河南 洛阳 471000)
主动脉夹层(aortic dissection, AD)是临床常见主动脉疾病,发病急、致死率高,临床主要采用创伤小、操作简便、安全有效的胸主动脉腔内修复术(thoracic endovascular aortic repair, TEVAR)[1]进行治疗。TEVAR已在国内开展20余年,是治疗Stanford B型AD的首选方法[2]。对于破口位置不同的Stanford B型AD,选择手术策略不当可能影响治疗效果[3],尤其破口位置与左锁骨下动脉(left subclavian artery, LSA)距离小于1.5 cm的AD近端锚定区不足,主体支架需覆盖LSA、左颈总动脉(left common carotid artery, LCCA),对于TEVAR如何维持主动脉弓上动脉血流仍有争议[4]。本研究观察Castor支架及体外预开窗Ankura支架用于TEVAR治疗近端锚定区不足Stanford B型AD的价值。
1 资料与方法
1.1 一般资料 回顾性分析2017年10月—2022年5月41例于郑州大学附属洛阳中心医院接受TEVAR治疗的原发性Stanford B型AD患者,男32例、女9例,年龄33~79岁、平均(52.3±12.4)岁;均经主动脉CT血管造影(CT angiography, CTA)检出AD,近端锚定区<1.5 cm;根据TEVAR策略将患者分为A、B组,对A组(n=20)植入Castor支架,对B组(n=21)植入体外预开窗的Ankura支架。A组20例中,男16例、女4例,年龄33~69岁、平均(50.5±10.6)岁,其中高血压17例、糖尿病7例;B组21例中,男16例、女5例,年龄36~79岁、平均(53.5±13.6)岁,其中高血压17例、糖尿病8例。排除患有其他器质性疾病、恶性肿瘤等患者。患者和(或)家属对治疗方案均知情并签署同意书。
1.2 手术方法 采用Toshiba INFX系列数字减影血管造影(digital subtraction angiography, DSA)机及Siemens Artis Zee数字平板DSA机为引导设备,配备MEDRAD MarkV高压注射器。以非离子型对比剂碘海醇(350 mgI/ml)进行造影,采集图像3帧/秒。A组:穿刺右肱动脉,留置5F血管鞘(Cordis),置入猪尾管(5F,Cordis)并造影显示AD破口;于右侧腹股沟区沿右股动脉走行切开皮肤约4 cm,暴露并游离右股动脉,直视下以18G动脉穿刺针穿刺右股动脉,将猪尾管送入升主动脉,交换加硬导丝;以18G动脉穿刺针穿刺左肱动脉并留置7F血管鞘(Cordis),置入加长导丝及单弯导管(5F,Cordis,125 cm)至降主动脉,明确其在真腔后由右股动脉切口引出;沿单弯导管将Castor分支型主动脉覆膜支架及输送系统(心脉医疗科技公司,术前根据患者CTA选择合适型号)的支架分支牵引导丝自右股动脉切口穿入、从左肱动脉鞘管引出,沿加硬导丝送入Castor支架,边送边牵引,确定支架定位准确、无缠绕后控制性降压并释放支架,通过7F鞘管撤出Castor分支支架束缚膜;再次造影确认Castor支架位置无误后撤出输送器及各导管导丝,吻合右股动脉,缝合皮下及皮肤各层。B组:穿刺左肱动脉置入5F黄金标记导管(Cordis),造影显示主动脉弓降部夹层;于右侧腹股沟区沿右股动脉走行切开皮肤约4 cm,暴露并游离右股动脉,直视下以18G动脉穿刺针穿刺右股动脉,将猪尾管(5F,Cordis)送入胸主动脉,明确其在真腔后交换加硬导丝,沿导丝送入已于体外预开窗的Ankura大动脉覆膜支架系统(先健),准确定位后控制性降压并释放支架;再次造影确认Ankura支架位置无误后撤出输送器及各导管导丝,吻合右股动脉,缝合皮下及皮肤各层。
1.3 观察指标 观察2组术中支架释放情况。术后1个月复查主动脉CTA,之后每3个月复查主动脉CTA,直至AD假腔逐渐减少、真腔逐渐恢复至正常。记录术中及术后并发症(再发AD、支架移位、内漏、逆撕、脑梗死、截瘫、死亡),必要时根据病情需要再次行TEVAR或外科手术治疗。
1.4 统计学分析 采用SPSS 19.0统计分析软件。以±s表示计量资料,组间比较行t检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2组患者性别(χ2=0.087,P=0.054)、年龄(t=5.032,P=0.278),高血压(χ2=0.119,P=0.529)及糖尿病(χ2=0.042,P=0.547)史差异均无统计学意义。
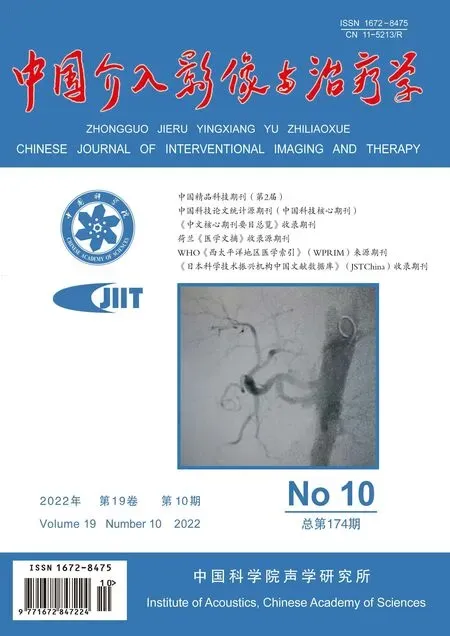
对41例均成功实施手术。对A组患者均植入1枚Castor支架,术中支架均成功释放(20/20,100%),支架形态良好,分支支架均通畅(图1)。对B组20例(20/21,95.24%)植入1枚Ankura支架,术中支架成功释放,支架形态良好;1例(1/21,4.76%)术中支架轻度向近心端移位,遮挡部分LCCA开口,交换导丝行球囊扩张,向LCCA植入1枚Wallstent(Boston Scientific,8 mm×40 mm)后造影,LCCA显影良好(图2)。对41例患者随访1~24个月、平均(12.50±3.60)个月;随访期间主动脉CTA示真腔均恢复,假腔逐渐消失。A组术中及术后均未见并发症;B组1例术后1个月主动脉CTA显示Ⅰa型内漏,因量较小且患者无不适未予特殊处理。
3 讨论
治疗AD的传统方法为经胸、经腹甚或胸腹联合切口进行外科手术,对患者生理及心理方面造成巨大创伤。以大动脉覆膜支架行TEVAR安全且创伤小[5],主要针对破口位置自LSA开口处至胸主动脉、甚至累及髂动脉的Stanford B型AD,其近端破口多位于主动脉LSA起始部;破口位置与LSA距离大于1.5 cm时,术中可直接植入直管型覆膜支架,支架撑开后封堵破口效果较为理想。但TEVAR也存在风险及并发症,主要包括再发AD、支架移位、内漏、逆撕、脑梗死、截瘫甚至死亡等[6]。截瘫是以大动脉覆膜支架行TEVAR的严重并发症,由于发自胸主动脉或腹主动脉的血管被覆膜支架遮挡,若供应脊髓的动脉无交通支形成,则存在截瘫风险[7];如果大动脉覆膜支架遮挡供应头部动脉,而无相应交通支开放,可致脑梗死。AD存在多个破口时,即使以大动脉覆膜支架行TEVAR,仍有再出血风险。因此,以大动脉覆膜支架行TEVAR具有较高风险,尤其对于近端锚定区不足的AD患者,制定适当的手术策略具有重要意义。
本研究对41例近端锚定区小于1.5 cm的Stanford B型AD患者分别植入Castor分支型覆膜支架(A组)或预开窗Ankura覆膜支架(B组)行TEVAR,均顺利完成手术,封堵破口效果均较好;A组术中及术后未发生并发症;B组1例术中支架轻度移位,导致LCCA开口部分被遮挡,植入1枚Wallstent后LCCA血流通畅。B组术后1例发生Ⅰa型内漏[8],因量较少且患者无不适而未予特殊处理。未见再发AD、支架移位、内漏、逆撕、脑梗死、截瘫及死亡等。本研究结果表明,以上2种方案用于TEVAR治疗近端锚定区不足的Stanford B型AD均安全、有效。
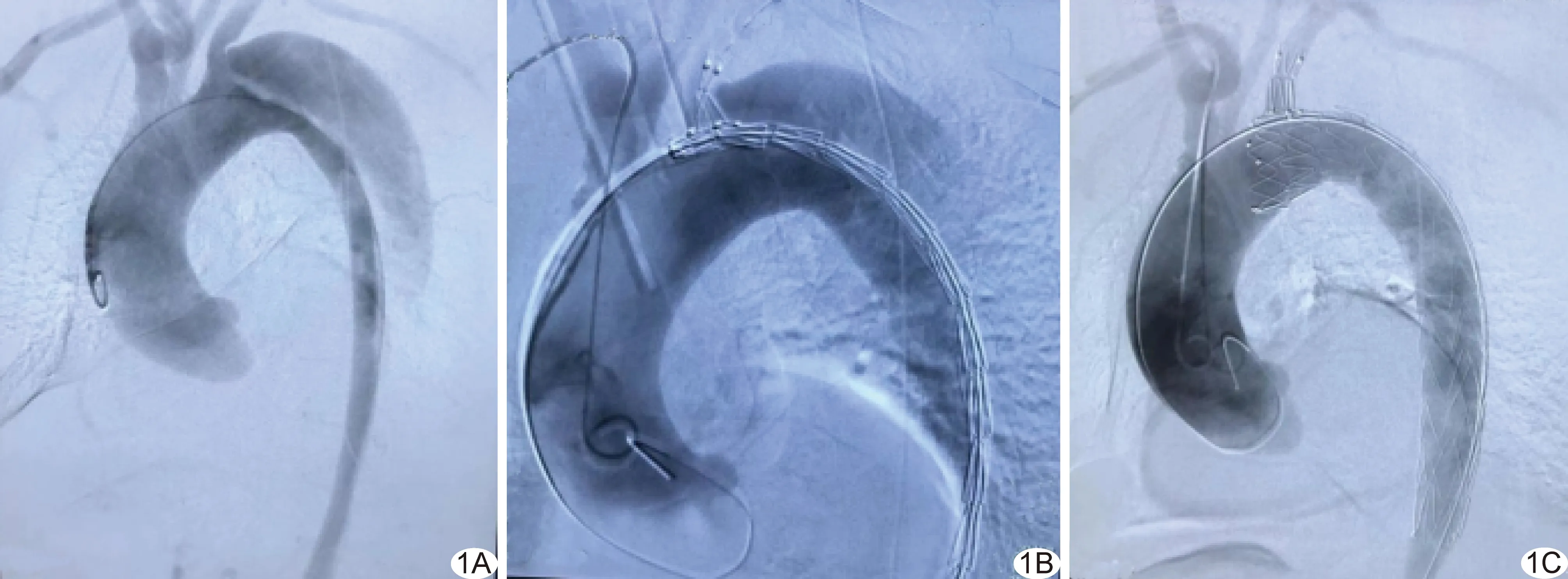
图1 A组患者,男,66岁,原发性Stanford B型AD,以Castor支架行TEVAR A.术前主动脉DSA图示AD破口累及LSA近端; B.术中造影确认Castor支架位置准确; C.术后主动脉DSA图示AD破口已成功封堵,LSA血流通畅
图2 B组患者,男,42岁,原发性Stanford B型AD,以体外预开窗的Ankura支架行TEVAR A.术前于体外对Ankura支架进行预开窗; B.术中DSA图示主动脉弓及分支血管,AD破口累及LSA左侧近端; C.植入支架后,支架稍向近心端移位,遮挡部分LCCA开口; D.向LCCA植入1枚Wallstent后1个月,主动脉CTA图示LCCA血流通畅
对于近端锚定区不足的Stanford B型AD,直接植入直管型覆膜支架可能影响LSA通畅程度,甚至可使LSA闭塞,这对于左椎动脉为优势供血血管患者而言是致命的[9];于外科分流术后行二期覆膜支架植入术会增加住院时间及创口愈合时间,而对于提高治疗效果并无明显帮助。利用覆膜支架开窗技术可有效解决上述问题,但将破坏支架完整性和稳定性,增加支架移位风险,且术中操作难度较大。本研究所用Ankura覆膜支架体外预开窗技术用于近端锚定区不足的Stanford B型AD有助于改善LSA及左椎动脉血供[10]。Castor分支型覆膜支架为一体式分支支架,可一次导入和释放,解决了大动脉支架导入和定位困难的问题,且具有内漏发生率低、侧支通畅性好等优势,可一次性封堵LSA近端内膜破口并一期重建LSA,但价格昂贵。此外,临床可用于治疗近端锚定区不足的Stanford B型AD的方法还有杂交手术、原位开窗及烟囱支架等[11-12]。
综上所述,Castor支架或体外预开窗Ankura支架用于TEVAR治疗近端锚定区不足的Stanford B型AD均安全、有效。但本研究样本量较小,有待积累病例进行多中心随机对照研究进一步对比观察其疗效。