动脉硬化性脑小血管病患者情感障碍与影像学标志物的相关性研究
蒋宇轩 林嘉灏 刘三鑫 刘旭 刘宇欣 陆正齐 卢婷婷
脑小血管病(CSVD)是指各种病因影响脑内小动脉、微动脉、毛细血管、微静脉和小静脉所导致的一系列临床、影像、病理综合征,其中小动脉硬化性CSVD(aCSVD)是最常见的一种[1]。CSVD 影像学标志物包括新发皮层下小梗死(RSSI)、血管源性腔隙、血管源性白质高信号(WMH)、扩大的血管周围间隙(EPVS)、脑微出血(CMB)和脑萎缩[2]。情感障碍是aCSVD 患者的常见临床症状,主要表现为焦虑和抑郁。国内一项研究显示55%的CSVD 患者合并抑郁、28.3%者合并焦虑,同时合并焦虑和抑郁者占 21.7%[3]。对于抑郁而言,有研究显示位于基底节区(BG)的无症状腔隙性脑梗死患者出现抑郁的风险高[4]。Brookes 等(2014 年)探讨了CSVD 患者脑白质完整性对抑郁的作用,发现弥散张量成像(DTI)检测到的脑白质病变是介导CSVD 和抑郁之间联系的因素之一。CMB 与抑郁之间的关系并不确定,推测可能与CMB 的不同位置有关[5]。近年来,EPVS作为 CSVD 的影像学标志物受到了广泛关注,其与WMH、腔隙微出血和CMB 密切相关,并与普通人群的抑郁发生相关[6]。而对于焦虑而言,CSVD 影像标志物与焦虑关系的研究较匮乏,仅有个别研究证实WMH 与卒中后焦虑相关[7]。
目前,CSVD 的影像学标志物与焦虑和抑郁之间的具体关系尚未明确,因此,本研究拟对本中心建立的 aCSVD 患者队列进行横断面研究,探讨其影像学特征是否可以作为独立的情感障碍标志物,并较为具体地探索焦虑和抑郁各系统症状与影像学标志物的关系,为疾病的早期诊断和防治提供理论依据。
对象与方法
一、研究对象
纳入2020 年1 月至2021 年10 月在本院神经内科就诊且临床诊断为aCSVD 的患者。aCSVD 诊断标准参考《中国脑小血管病诊治专家共识2021》(2021 年之前的患者再重新根据本共识诊断1次)[8]。本研究经本院医学伦理委员会批准(批件号:中大附三医伦[2021]02-209-01)。所有患者签署知情同意书。
纳入标准:①45 岁 ≤ 年龄< 80 岁。②至少存在以下1 项致动脉粥样硬化的血管危险因素,高血压、高脂血症、BMI > 28 kg/m2、吸烟(10 支/日,烟龄 ≥10 年)、糖尿病、空腹血糖受损或糖耐量异常、症状性卒中(持续)、冠状动脉粥样硬化性心脏病(冠心病)。③至少存在以下1 种脑小血管病常见的急性或慢性临床症状(综合征),急性腔隙综合征、步态或姿势平衡障碍、认知功能下降、精神或情感障碍(焦虑、抑郁等)、血管源性帕金森综合征、睡眠障碍、尿道及肛门括约肌功能障碍。④MRI 至少存在1 种符合神经影像学血管性改变报告标准(STRIVE 标准)的CSVD 特征性影像学标志物[9]。排除标准:①符合2018 年波士顿淀粉样脑血管病诊断标准,考虑淀粉样脑血管病的患者。②对于临床表现、影像学特征和家族史疑似遗传性CSVD 患者,或经基因检测证实遗传性CSVD 的患者;免疫或炎症导致的CSVD,静脉胶原病和其他类型的CSVD 如放射性物质导致的CSVD。③合并陈旧或新发大血管闭塞性脑梗死、心源性卒中。④MRA 可见的中-重度颅内动脉粥样硬化狭窄。⑤其他原因所导致的焦虑、抑郁,比如药物、遗传及神经系统其他疾病等所引起的精神心理疾病。⑥正在服用改善情绪方面药物的患者。
二、方 法
采集患者人口学资料、既往病史和神经功能量表等资料。
1.焦虑抑郁程度评估
采用焦虑自评量表(SAS)和抑郁自评量表(SDS)评定患者的负性情绪。SAS 评分>50 分被认为存在焦虑,SDS 评分>50 分被认为存在抑郁,得分越高,说明症状越严重[10-11]。按患者是否存在焦虑或抑郁将其分为焦虑组、非焦虑组以及抑郁组与非抑郁组。
2.影像学分析
采用3.0 T MRI 扫描仪(Discovery MR750,GE,美国和Siemens Medical Solutions, Erlangen,德国)对所有患者进行脑部MRI 扫描。纳入分析的序列包括T1加权像(T1WI)、T2WI、T2液体衰减反转恢复序列(FLAIR)、扩散加权成像(DWI)、磁敏感加权成像(SWI)。参考STRIVE 标准关于CSVD 特征性影像学标志物(血管源性腔隙、WMH、EPVS、CMB)的定义和放射学特点进行半定量分析[9]。采用英国爱丁堡大学临床脑科学中心关于CSVD 影像学疾病负担的评定标准(1~4 分)评估影像学总负荷[12]。EPVS 定义为沿穿支动脉方向的小的(< 3 mm)脑脊液信号结构。常见的部位主要是半卵圆中心(CSO)和BG,目前认为CSO-EPVS 和BGEPVS 在发生机制和疾病指向性上是有区别的,因此本研究分别统计上述2 个区域的EPVS,计算大脑单个层面的EPVS 数量。
三、统计学处理
采用SPSS 19.0 软件进行数据分析,符合正态分布或近似正态分布计量资料以 表示并采用t 检验比较组间差异;非正态分布计量资料以中位数(四分位数间距)表示并采用Manne-Whitney U 检验比较组间差异;分类变量以计数(百分率)表示并采用χ2检验比较组间差异。采用多因素logistic 回归分析各个CSVD 影像学标志物对焦虑和抑郁的影响。采用Spearman 相关分析对EPVS数量与焦虑和抑郁症状出现频率的影响作分析。
结 果
一、非焦虑组和焦虑组、非抑郁组和抑郁组患者组基线资料比较
共纳入81例aCSVD患者,非焦虑组和焦虑组、非抑郁组和抑郁组患者基线资料见表1。就影像学标志物而言,焦虑组BG-EPVS 数目比非焦虑组多,抑郁组BG-EPVS 数目亦比非抑郁组多(P 均<0.05)。
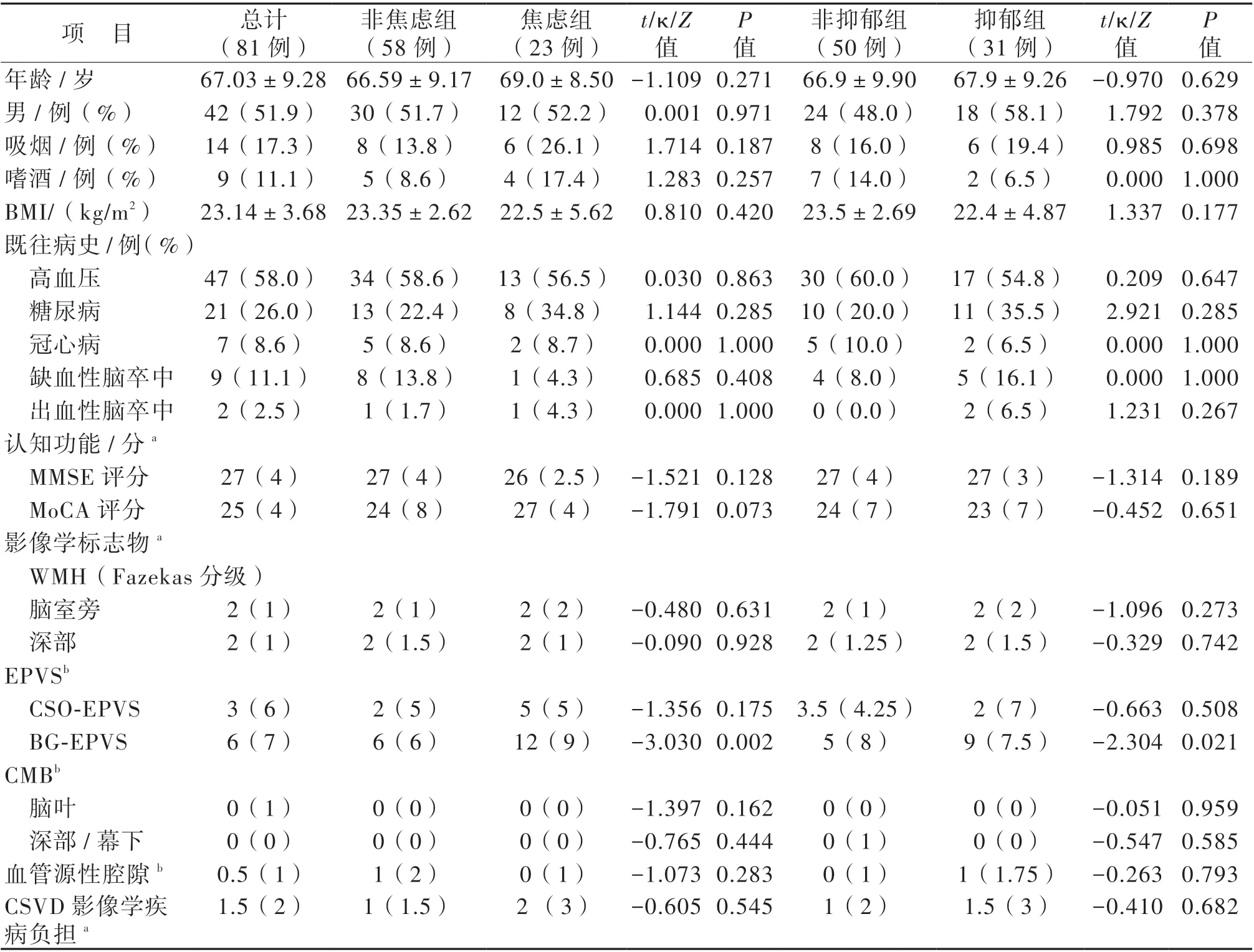
表1 非焦虑组和焦虑组、非抑郁组和抑郁组患者临床基线资料比较
二、焦虑组和非焦虑组、抑郁组和非抑郁组患者影像学标志物的相关分析结果
焦虑组和非焦虑组影像学标志物多因素logistic回归分析见表2,提示在CSVD 影像学标志物中,BG-EPVS 数目(OR = 1.223,95% CI:1.066~1.404;P = 0.004)与焦虑独立相关。

表2 焦虑组与非焦虑组患者影像学标志物多因素logistic 回归分析
抑郁组和非抑郁组影像学标志物多因素logistic回归分析见表3,提示在CSVD 影像学标志物中,BG-EPVS 数目(OR = 1.163,95% CI:1.035~1.307;P = 0.011)和抑郁独立相关。
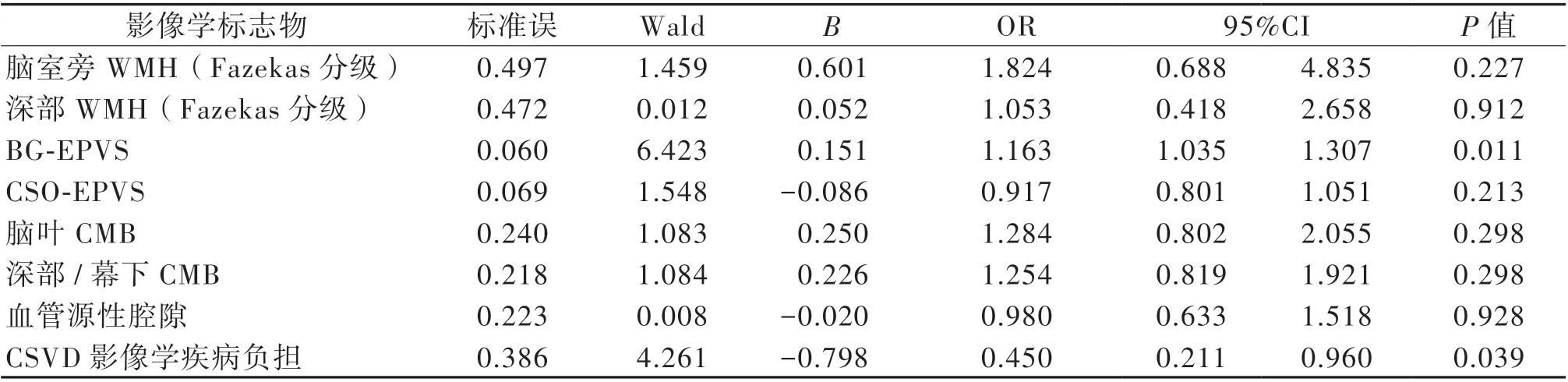
表3 抑郁组与非抑郁组患者影像标志物多因素logistic 回归分析
三、BG-EPVS 数量与患者焦虑和抑郁症状的Spearman 相关分析结果
对2 种量表的内部一致性进行了检查,SAS 的克龙巴赫系数(Alpha) = 0.714,SDS 的克龙巴赫系数(Alpha) = 0.725,内部一致性系数均> 0.7,认为内部一致性良好。
Zungs 根据焦虑的症状特点,将SAS 分为9 组特异性症状,并以每个因子的总得分(1~4 分)代表其症状出现的频率[13]。本研究显示,BG-EPVS数量越多,患者会更频繁地出现以下症状:泌尿系统症状(P = 0.026)、皮肤症状(P = 0.007)、睡眠障碍(P = 0.002),见表4。
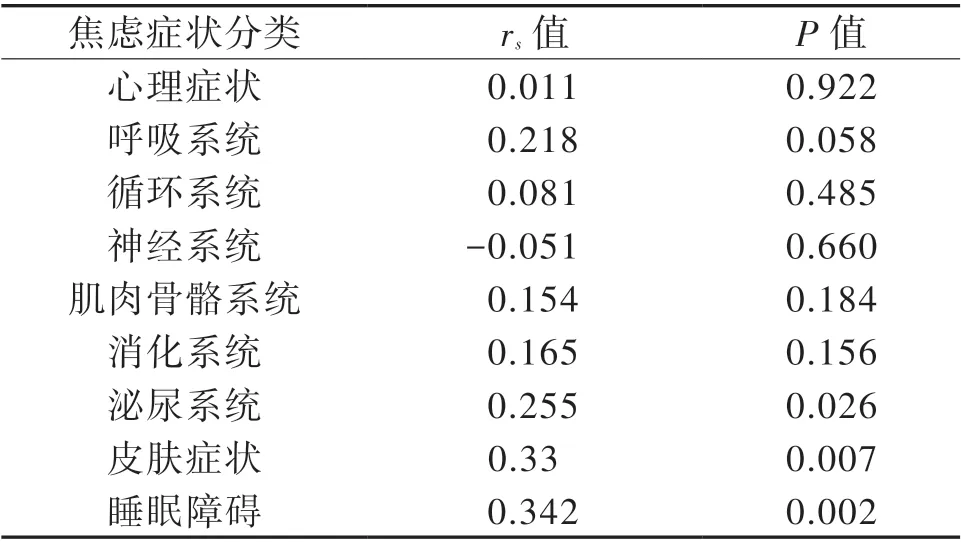
表4 BG-EPVS 数量与aCSVD 患者焦虑症状的Spearman相关分析结果
Zungs 根据抑郁的症状特点,以SDS 每个因子的总得分(1~4 分)代表其症状出现的频率[14]。本研究显示,BG-EPVS 数量越多,患者会更频繁地出现消极心理(P < 0.001),见表5。
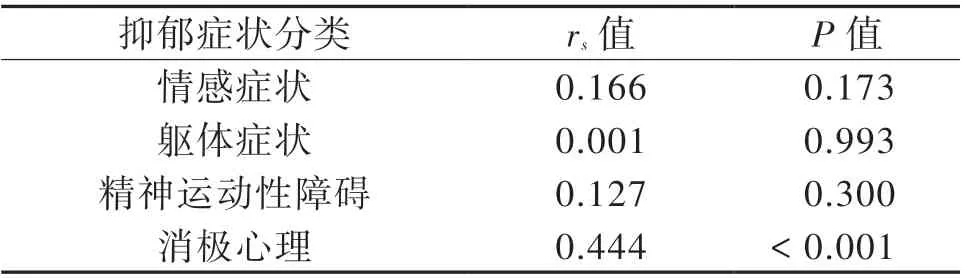
表5 BG-EPVS 数量与aCSVD 患者抑郁症状的Spearman相关分析
讨 论
本研究中的患者中位年龄仅约67 岁,总体CSVD 影像学负担较轻。既往研究显示在社区人群中,EPVS 与抑郁的发生率相关[5]。本研究结果提示在CSVD 影像学标志物中,aCSVD 患者焦虑和抑郁状态与BG-EPVS 数量独立相关。就症状特点而言,BG-EPVS 数量与焦虑相关的躯体症状如泌尿系统、皮肤症状和睡眠障碍相关,亦与抑郁有关的消极心理相关。
本研究显示的aCSVD 患者中BG-EPVS(并非CSO-EPVS)与焦虑和抑郁相关可能与基底节尤其是纹状体参与情绪活动调节的损伤有关,血脑屏障破坏可能是EPVS 和情感障碍的共同机制。脑微循环内皮功能障碍可导致脑灌注缺损、血脑屏障损伤和脑组织慢性缺血性损伤[13]。同时,基底节区大量小孔状血管周围间隙可能直接压缩和破坏深层白质束,导致皮质-基底节情绪调节环路的破坏。
关于EPVS 与和睡眠障碍之间相关的机制,Del Brutto 等(2020 年)发现睡眠效率低与BGPVS 增大独立相关,而CSO-EPVS 与睡眠之间的关系并不显著。大脑间质液和代谢废物的排出主要发生在睡眠期间,睡眠障碍影响清除机制,从而造成PVS 扩大,成为患者产生焦虑的病理生理学基础[14]。同时焦虑又可通过诱导炎症反应等机制影响睡眠,形成恶性循环。面色潮红、尿频以及出汗等症状均与自主神经系统功能紊乱有关,其调控中枢主要位于边缘系统,杏仁核在其中发挥重要作用[15]。BG-EPVS 可能通过损伤边缘系统,导致不良躯体反应,从而引发患者的焦虑症状。
关于本研究显示的aCSVD 患者BG-EPVS 数量与抑郁症状中的消极心理相关的问题,既往研究发现BG 病变可以导致患者出现急性抑郁[6]。EPVS可能通过破坏位于BG 参与情绪调节的关键白质束引发患者抑郁症状。
Direk 等(2016 年)发现更大的WMH 体积与社区人群抑郁的严重程度呈正相关。本研究未能证实WMH 与焦虑和抑郁的相关性。与既往研究相比较,本组患者更年轻、影像学负担评分更低,提示本组患者处于aCSVD 疾病的更早期阶段。同时,与更精确的WMH 体积、DTI 等测量方法相比,本研究所采用的STRIVE 标准的WMH 视觉Fazekas 分级的方法分辨度较低且样本量较少,可能不足以显示WMH 与焦虑和抑郁的关系。值得一提的是,在出现可见的WMH 之前,EPVS 会伴随原位脑白质网络微结构的破坏,影像学特征为EPVS 周围存在不同形态的WMH 包绕,而对没被WMH 包绕的EPVS 随访6 个月后,发现周边会出现点状WMH[16]。这提示EPVS 可能参与WMH 的形成,或可作为比WMH 更早期的影像学标志物预测患者的情感障碍。
本研究为横断面研究且样本量较少。同时,尽管SAS 和SDS 与汉密尔顿焦虑抑郁量表有良好的相关性,但自评量表用于CSVD 患者的信度和效度还有待验证。血管周围间隙与情感障碍的关系证据仍很有限,需要进一步更深入的临床和基础研究证实。
总之,焦虑和抑郁在aCSVD 患者中常见,且与BG-EPVS 数量独立相关。临床医师应重视aCSVD 尤其是具有显著BG-EPVS 影像特征的患者情感障碍的早期筛查。对于焦虑而言,EPVS 与焦虑相关躯体症状的相关性更明显;对于抑郁而言,EPVS 主要影响患者的心理状态。睡眠障碍可能参与aCSVD 患者焦虑的发生机制,改善睡眠有可能成为阻断aCSVD 患者焦虑加重的干预环节。

