IgA肾病国际风险预测工具在中国人群中的预测效果评价
郭康林 程一春 葛树旺 徐 钢
(华中科技大学附属同济医院肾脏内科,武汉 430030)
IgA肾病(IgA nephropathy,IgAN)是世界上最常见的原发性肾小球肾炎之一,且其患病率具有地区差异,在亚洲地区的患病率明显高于其他地区[1]。约30%~40%的患者会在20年内进展为肾衰竭,造成了极大的健康和经济负担[2]。
肾功能恶化的风险异质性是IgA肾病的一个特殊特征,因此,改善全球肾脏病预后组织(Kidney Disease Improving Outcomes,KDIGO)指南[3]建议对患者进行风险分层,以便针对疾病进展的高危人群进行免疫抑制治疗;但仅基于蛋白尿水平进行风险分层是非常不准确的。为了进行更为准确的风险分层,国际IgA肾病网络协作组利用有长期随访的大型多民族队列,开发了IgA肾病国际风险预测工具[4]。IgA肾病国际风险预测工具包含2个模型,区别在于一个包含种族因素,一个不包含种族因素。这是第一个基于多民族多中心队列推导出来的预测IgA肾病预后的工具,且充分整合了经验证的临床病理学风险因素。这些临床病理因素包括年龄、估计肾小球滤过率(estimated glomerular filtration rate,eGFR)、平均动脉压(mean arterial pressure,MAP)、24 h尿蛋白、牛津病理分型[系膜细胞增殖(mesangial hypercellularity,M)、毛细血管内增殖(endocapillary cellularity,E)、节段硬化(segmental sclerosis,S)、肾小管萎缩/间质纤维化(tubular atrophy/interstitial fibrosis,T),MEST]评分以及肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)阻断剂和免疫抑制剂的使用。该工具的终点事件是患者发生终末期肾衰竭(end stage renal disease,ESRD)或eGFR下降超50%。将患者的基线数据代入该公式即可计算出患者未来某个时间点到达终点事件的概率,根据概率的大小可将患者进行风险分层,以便于根据患者的情况进行针对性治疗。
广泛的外部验证是所有预测模型在临床推广应用的基础。本研究的目的是在一个现代中国人队列中对IgA肾病国际风险预测工具进行外部验证,为该预测工具在临床的推广应用提供更多证据。
1 对象与方法
1.1 研究对象
此研究是一项回顾性队列研究,目的是对国际IgA肾病风险预测工具进行外部验证。收集2012年1月至2016年12月,华中科技大学附属同济医院收治经活检确诊的IgA肾病患者548例。排除了肾活检肾小球数小于8、年龄小于18岁、基线临床病理数据缺失、伴有其他系统性疾病、随访时间小于6个月且未到达终点事件的患者,最终有467名患者被纳入队列。本研究已经通过华中科技大学附属同济医院的伦理委员会的审批,伦理编号为TJ-IRB2018110。所有患者均提供了参与本研究的书面知情同意书,所有研究程序符合《赫尔辛基宣言》。
1.2 临床病理数据
本外部验证队列的所有预测因素的定义和收集都与原始队列一致。将不包含种族的预测模型称为模型1;包含种族的预测模型称为模型2。模型1的预测因素包括:年龄、eGFR、MAP、24 h尿蛋白、牛津病理分型评分以及RAAS阻断剂和免疫抑制剂的使用。在肾活检时收集患者的基线24 h尿蛋白、年龄、性别、MAP和eGFR。eGFR根据血清肌酐浓度利用慢性肾病流行病学合作研究(Chronic Kidney Disease Epidemiology Collaboration, CKD-EPI)公式计算得出。MAP定义为舒张压加三分之一的脉压差。RAAS阻断剂和免疫抑制剂为肾活检前使用。由经验丰富的病理科医生在不了解临床数据的情况下,做出牛津病理分型评分。模型2除包括模型1的所有预测因素外,增加了种族这项预测因素。种族分为中国人、日本人、白人或其他,根据种族的不同,模型2的计算公式中种族因素前的系数会有变化。ESRD定义为eGFR小于15 mL-1·min-1·1.73 m-2、接受透析治疗或接受肾移植。终点事件定义为随访时eGFR下降超50%或发生ESRD。
1.3 计算预测风险值及风险分组
根据IgA肾病国际风险预测工具利用基线数据计算每个患者到达终点事件的概率,即为预测风险。在模型2中,由于违反了比例风险假设,中国人在小于等于36个月时使用一个分段函数[4]。按照原始研究相同的方法,将患者按照预测风险进行排序,0%~16%为低风险组(n=70)、16%~50%为中风险组(n=163)、50%~84%为高风险组(n=164)、84%~100%为极高风险组(n=70)。
1.4 统计学方法
可以从区分度、净重新分类分析、校准度和临床实用性几个方面对模型的表现性能进行评估。使用C统计量和时间依赖地受试者工作特征(receiver operating characteristic curve,ROC)曲线评估模型的区分度。同时比较不同风险组的生存曲线,生存曲线分离则表明模型具有良好的区分度。使用Log-rank检验分析生存曲线间的差异。因为低风险组中无患者到达终点事件,以中间风险组作为参考计算风险组之间的风险比(hazard ratio,HR)。使用净重分类改善指标(net reclassification improvement,NRI)和综合判别改善指标(integrated discrimination improvement,IDI)进行净重新分类分析,以比较两个模型的预测能力是否有差异。
使用校准图来比较5年到达终点事件的观察风险和预测风险,以评估模型的校准度。根据线性预测因子得到十等分的预测风险组,画出5年预测风险对比5年观察风险的校准图,以报告随访满5年时,模型预测的校准度。
决策曲线分析用于评估预测模型的临床效用[5]。在特定阈值下,模型的净收益是真阳性率与假阳性率的差。在合理的概率阈值范围内,只有当净收益高于治疗所有患者和不治疗任何患者时,才认为预测模型具有临床应用价值。统计分析采用R 4.0.5(SAS公司,美国)。当P<0.05时,结果具有统计学意义。
2 结果
2.1 外部验证队列与原始推导队列及原始验证队列的基线特征比较
本研究的外部验证队列共467例患者,有48例(10%)患者到达终点事件。随访时间的中位数是4.0年,四分位区间是2.8~5.2年。与本研究的外部验证队列相比,原始推导队列和原始验证队列的队列人数更多,队列时间更早,随访时间更长,到达终点事件的患者比例和24 h尿蛋白相对较高,T2病变的比例及接受RAAS抑制剂治疗和免疫抑制剂治疗的比例相对较低,详见表1。

表1 外部验证队列、原始推导队列和原始验证队列的基线特征
2.2 IgA肾病国际风险预测工具的预测表现
区分度:在这个外部验证队列中,两个模型都表现出了极好的区分度。模型1和模型2的C指数分别为0.86(95%CI:0.80~0.92)和0.86(95%CI:0.79~0.92),5年ROC曲线下的面积均为0.88,证明了区分度优于原始推导队列和原始验证队列,详见表2。
不同风险组的生存曲线如图1所示。分离良好的生存曲线也证实了两个模型的区分能力。不同风险组之间的风险比详见表3。因为低风险组没有患者到达终点事件,因此以中风险组为参照组,结果显示两个模型都能明显区分高风险组和极高风险组。

图1 不同风险组的终点事件生存曲线

表3 风险组与终点事件的相关性
重新分类:在将种族作为预测因子加入模型后,模型2与模型1相比,没有在预测5年风险的表现上有显著进步,NRI和IDI分别为0.02 (95%CI:-0.07~0.09)和0.00 (95%CI:-0.01~0.01),详见表2。

表2 外部验证队列验证模型的C指数、5年AUC面积、NRI、IDI
校准度:图2显示了5年终点事件的预测风险与实际风险的对比。总的来说,2个模型的5年终点事件预测无明显差异,在高风险组轻度低估。
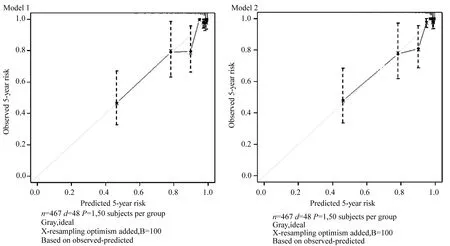
图2 5年预测风险与5年观察风险对比的校准图
临床效用:图3是决策曲线分析图,两个模型都显示了在0~0.75阈值概率范围内5年预测风险的正净收益,表明了两个模型显著的临床实用性。两者几乎重叠,则表示两个模型在临床效用上无明显差异。
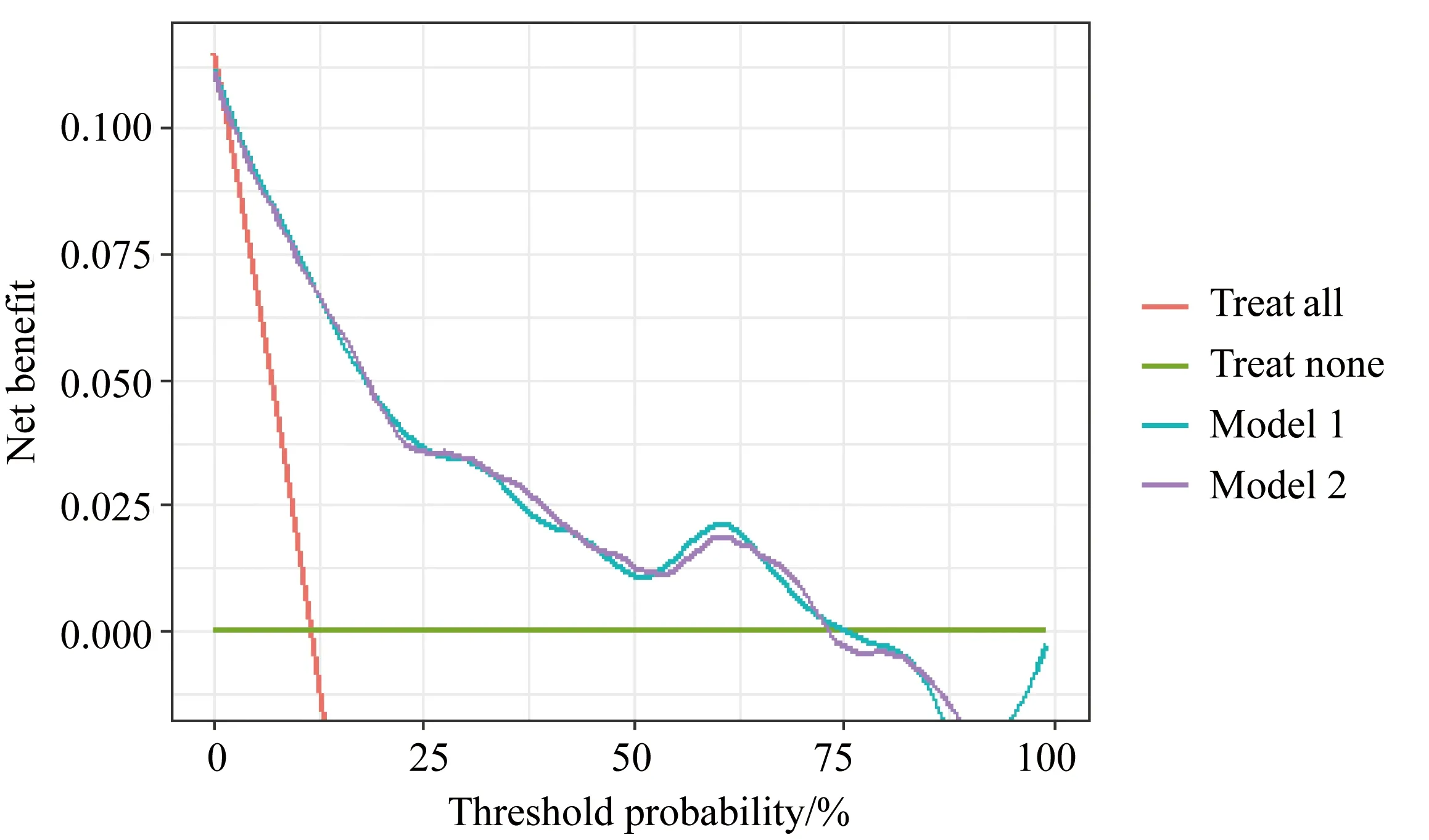
图3 5年预测风险的决策曲线分析
4 讨论
本研究首先比较了外部验证队列和原始队列的差异性,然后进一步通过外部验证评估了国际IgA肾病预测工具在一个现代中国人队列中的表现性能。与原始推导队列和原始验证队列相比,本研究的现代中国人队列24 h尿蛋白较低,接受RAAS阻断剂和免疫抑制剂治疗的比例更高,随访时间较短,这导致了中国人队列到达终点事件的患者比例较低。
基于区分度、校准度、重新分类和临床实用性评价,在本研究中,两个模型在预测终点事件的5年风险方面无明显差异,均表现出显著的区分性和临床实用性,均轻微低估了5年风险。2个模型的C指数均为0.86,且生存曲线分离良好,表现出优秀的区分能力。2个模型在校准方面表现也基本一致,均轻微低估了5年风险。重新分类表明,两个模型在预测5年风险方面无明显差别。决策曲线分析表明2个模型在预测5年风险方面都具有显著的临床实用性且无明显差异。
准确的风险评估对于IgA肾病患者至关重要。相比其他IgA肾病预后模型,IgA肾病国际风险预测工具具有样本量大、纳入的基线容易获取、纳入了MEST评分,包含多个民族等多个优点,充分整合了经验证的临床病理学风险因素[6-8]。因原始推导队列的中位随访时间是5年,因此推荐使用此工具预测IgA肾病患者到达终点事件的5年风险。
在临床上广泛应用之前,需要对预测模型进行广泛的外部验证。外部验证研究包括地理验证、时间验证和领域验证3种类型。原始研究队列中的中国人来自中国东部(北京和南京),且占比为22%。原始推导队列和原始验证队列的中位年数分别是2006年和1998年。因为招募时间过早,原始队列的患者治疗大部分未按照KDIGO指南进行[4-9]。本研究的中国人队列来自中国中部(武汉),中位年数是2014年,且大部分患者按照KDIGO指南进行治疗。因此,本研究用一个现代中国人队列对国际IgA肾病预测工具进行外部验证是必要的。
一项264人的希腊IgA肾病队列对国际IgA肾病预测工具的外部验证研究[10]证明,2个模型具有良好的区分度,但校准度不好,均高估了风险。本研究中两个模型的C指数都是0.86,显著高于希腊研究(模型1:0.70;模型2:0.71),校准度也表现良好,仅轻微低估了风险,同时进行了临床实用性分析。在本研究中,模型1与模型2的预测结果未有显著差异,其原因可能是队列的人群相对较少且缺乏种族多样性。
近几年来相关领域的研究人员构建并验证了多个预后预测模型,除了IgA肾病国际风险预测工具,还有最佳临床预测模型(The Best Clinical Predictive Model,CLIN)、最佳临床结合组织学模型(The Best Model Combining Clinical Variables and Pathology Scores,CLIN-PATH)及临床决策支持系统(Clinical Decision Support System,CDSS)等[4-12]。CLIN以性别、年龄、eGFR、血红蛋白、尿蛋白定量为预测因素,终点事件是肾衰竭。CLIN-PATH在CLIN的基础上纳入年龄、eGFR、M病变、T病变。CDSS是一个人工神经网络预测模型,以年龄、性别、高血压、血清肌酐、蛋白尿、MEST-C 分类和治疗为预测因素,以5至10 年内发生ESRD 为终点事件。CLIN、CLIN-PATH和CDSS对IgA肾病预后的预测作用特异性更高,其原因是上述3个预测模型的终点事件是ESRD,而国际IgA肾病预测工具的终点事件是eGFR下降超50%或ESRD。国际IgA肾病预测工具相比上述3个预测模型优势在于灵敏度更高,因终点较易到达更容易识别出高风险患者。
目前,IgA肾病预后影响因素的相关研究仍在不断进展。国际IgA肾病预测工具的预测因素包含了已经验证的IgA肾病预后的风险因素,包括年龄、24 h尿蛋白、MAP、eGFR、M病变、E病变、S病变、T病变、RAAS阻滞剂及免疫抑制剂在肾穿刺前的使用[13-14]。最近,一些研究[15-20]表明,血清尿酸、血清胆红素、血清IgA、补体C4、血清钙磷等临床因素和C病变、系膜IgM沉积、系膜IgG沉积等病理因素也是IgA肾病预后的风险因素。随机森林、支持向量机、人工神经网络和深度学习等新的模型构建方法也被用于IgA肾病预后模型的构建[12-21]。因此,未来IgA肾病预后预测模型也会随着研究进展不断改进完善。
本研究也具有一些局限性。首先,这是一个单中心单民族队列且仅有467人。其次,这些参与医院定期随访的患者病情都较为严重。第三,没有纳入患者确诊后的治疗情况,而确诊后的治疗对预后有着重要影响[22]。
总之,本研究对国际IgA肾病预测工具的外部验证,证明该工具在IgA肾病患者的个性化风险评估方面表现很好,在临床上推广应用该工具有助于对患者制定个性化的治疗方案,改善患者的预后。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明徐钢:提出研究思路,设计研究方案,总体把关;程一春:收集数据;郭康林:分析数据,撰写论文;葛树旺:收集数据,审定论文。

