猪丹毒丝菌-猪链球菌二联油乳剂灭活疫苗的制备及其免疫效果评价
韩业芹,崔丽荣,邢刚,何长生,孙裴,刘雪兰,魏建忠,李郁
1.安徽农业大学 动物科技学院,安徽 合肥 230036;2.马鞍山史记动物健康管理有限公司,安徽 马鞍山 238251;3.安徽省动物疫病预防与控制中心,安徽合肥 230091
猪丹毒(swine erysipelas)和猪链球菌病(swine streptococcosis)分别是由猪丹毒丝菌(E.rhusiopathiae,ER)和多种致病性猪链球菌(Streptococcus suis,SS)引起的急性、热性人畜共患传染病,不仅给养猪业带来了巨大经济损失,也对公共卫生安全造成了威胁[1]。血清型1a型ER和2型猪链球菌(SS2)是我国猪群中分离率最高、致病力最强的菌株,且在兽医临床中常见ER、SS与其他细菌或病毒发生混合感染或继发感染,使猪群的发病率和死亡率增高[2],严重影响了养猪业的发展。
抗生素可用于猪丹毒和猪链球菌病的防治,但长期大量不合理地使用易导致ER和SS耐药性的产生,疫苗接种是预防猪丹毒和猪链球菌病、降低死亡发生的有效措施[3]。目前,ER和SS2商品化疫苗包括弱毒疫苗和灭活疫苗。弱毒疫苗虽能产生较好的免疫效果,但易受母源抗体和抗生素的干扰,并存在毒力返强的风险;灭活疫苗的使用安全性优于弱毒疫苗,易于制备多联苗,从而达到“一针多防”的目的,且可节省接种成本,降低对动物的免疫应激反应[4]。目前国内外尚无商品化ER和SS2二联灭活疫苗上市。本研究将前期通过致病性、抗原性和稳定性试验筛选出的1株1a型ER(编号AEr31)和1株SS2(编号HF2)作为制苗菌株[5-6],经甲醛灭活AEr31和HF2,以ISA 201VG矿物油为佐剂制备ER-SS2二联油乳剂灭活疫苗,并进行免疫效果评价,以期为该疫苗的临床应用奠定基础。
1 材料与方法
1.1 菌株ER及SS2的制苗菌株(AEr31和HF2)、ER及SS2攻毒菌株(AEr21和BZ1)、ER-SS2联合攻毒菌株(由AEr21与BZ1等比混合菌液制成)均由安徽农业大学动物传染病实验室分离、鉴定及保存。菌株信息见表1。

表1 制苗菌株及攻毒菌株的背景信息Tab.1 Background information of strains for vaccine preparation and challenge
1.2 主要试剂 酵母浸膏胰酪胨大豆琼脂(TSAYE)、酵母浸膏胰酪胨大豆肉汤(TSB-YE)及脑心浸液肉汤培养基(BHI)均购自绍兴天恒生物科技有限公司;猪丹毒(疫苗)培养基购自青海高科园海博生物技术公司;ISA 201VG矿物油佐剂购自法国赛比克公司;甲醛溶液购自上海苏懿化学试剂有限公司;小鼠脾脏组织淋巴细胞分离试剂盒购自天津灏洋生物制品科技有限责任公司;HRP标记的羊抗鼠IgG抗体购自美国博士德生物工程有限公司;细胞因子ELISA检测试剂盒(IL-4、IL-10、IFNγ、TFN-β、MCP-1)购自美国RB公司;流式细胞抗体试剂盒购自上海优宁维生物科技股份有限公司;DMSO购自北京四季青生物科技有责任限公司;健康豚鼠血清由安徽农业大学动物传染病实验室提供。
1.3 实验动物 清洁级昆明小鼠,雌性,6~8周龄,体质量为18~22 g,购自安徽医科大学动物实验中心,动物合格证号为:SCXK(皖)2017-001。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行操作。
1.4 ER-SS2二联油乳剂灭活疫苗的制备 将菌株AEr31及HF2用终浓度为0.3%的甲醛,于37℃分别灭活8和15 h。将灭活完全的菌液V-AEr31和V-HF2等体积混合,再与ISA 201VG矿物油佐剂等体积混合,制备为ER-SS2二联油乳剂灭活疫苗,即(V-AEr31+V-HF2)+ISA 201VG。另将灭活完全的菌液V-AEr31和V-HF2分别与ISA 201VG矿物油佐剂等体积混合,再进行等比例混合,即(V-AEr31+ISA 201VG)+(V-HF2+ISA 201VG)。上述两种灭活疫苗按文献[7]方法进行性状、无菌和安全检验。
1.5 免疫效果评价
1.5.1 动物分组及给药 将小鼠随机分为5组(编号Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ),Ⅰ~Ⅲ组每组105只,Ⅳ、Ⅴ组每组30只。Ⅰ、Ⅱ组分别接种(V-AEr31+V-HF2)+ISA 201VG和(V-AEr31+ISA 201VG)+(V-HF2+ISA 201VG),Ⅲ组接种等体积的灭菌0.9%氯化钠溶液,均经皮下多点注射,接种剂量均为0.2 mL/只,共接种2次,间隔14 d。Ⅳ组不接种不攻毒,Ⅴ组不接种仅攻毒。
1.5.2 小鼠血清中IgG抗体水平的检测 于每次接种后7及14 d,Ⅰ、Ⅱ和Ⅲ组各取3只小鼠,经小鼠眼眶静脉窦采血,分离血清,ELISA法检测血清中IgG抗体效价[8],并计算P/N值。
1.5.3 小鼠血清功能性抗体水平的检测 采用血清杀菌试验。于每次接种后7及14 d,Ⅰ、Ⅱ和Ⅲ组各取3只小鼠,经小鼠眼眶静脉窦采血,分离血清,经过滤器除菌。每组均设免疫组、补体对照组及体系对照组,免疫组为:PBS稀释液+待检小鼠血清+健康豚鼠血清(补体)+菌悬液(分别为AEr21、BZ1、AEr21-BZ1,浓度均为1.0×106CFU/mL);补体对照组为:PBS稀释液+健康豚鼠血清(补体)+菌悬液(分别为AEr21、BZ1、AEr21-BZ1,浓度均为1.0×106CFU/mL);体系对照组为:PBS稀释液+健康豚鼠血清(灭活补体)+菌悬液(分别为AEr21、BZ1、AEr21-BZ1,浓度均为1.0×106CFU/mL)。均置37℃孵育1 h;涂布于TSAYE培养基,继续培养24 h;进行菌落计数,计算杀菌率。若免疫组孔内菌落数为补体对照孔的50%以下即为“杀菌”,否则为“不杀菌”。
1.5.4 小鼠血清中相关细胞因子水平的检测 于每次接种后7及14 d,Ⅰ、Ⅱ和Ⅲ组各取3只小鼠,经小鼠眼眶静脉窦采血,分离血清,采用细胞因子ELISA检测试剂盒检测相应细胞因子(IL-4、IL-10、IFNγ、TFN-β、MCP-1)水平。
1.5.5 小鼠脾淋巴细胞增殖水平的检测 于每次接种后7及14 d,Ⅰ、Ⅱ和Ⅲ组各取3只小鼠,经小鼠眼眶静脉窦采集外周血,制备小鼠脾淋巴细胞悬液,调整浓度至5×106个/mL,加入96孔板,100 μL/孔,试验孔中加入10 μL的植物血凝素,每个样本设3个平行孔,同时设对照孔(仅加入培养液),置37℃,5%CO2条件下孵育70 h;加入MTT,20 μL/孔,继续培养4 h;弃培养液,加入DMSO,150 μL/孔,混匀,用酶标仪检测A570[9],并按下式计算增殖指数(SI)。SI越高,脾淋巴细胞增殖能力越强,反之越弱。
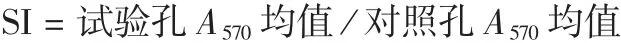
1.5.6 小鼠外周血中CD4+、CD8+T细胞亚群百分比的测定 于每次接种后7及14 d,Ⅰ、Ⅱ和Ⅲ组各取3只小鼠,经小鼠眼眶静脉窦采集外周血,按文献[10]的方法,通过流式细胞仪进行检测。
1.5.7 小鼠免疫保护率的测定 第2次免疫后14 d,将Ⅰ、Ⅱ、Ⅲ、Ⅴ组小鼠均用AEr21、BZ1和AEr21-BZ1菌液经腹腔进行攻毒,每组均设3种攻毒菌感染剂量,分别为100 LD50、5 LD100和30 LD100,即Ⅰ1~Ⅰ3组、Ⅱ1~Ⅱ3组、Ⅲ1~Ⅲ3组和Ⅴ1~Ⅴ3组,Ⅳ组注射无菌生理盐水(Ⅳ1~Ⅳ3组),均0.3 mL/只。攻毒7 d后,观察各组小鼠的精神状态及死亡情况,并按下式计算各组小鼠免疫保护率。

1.5.8 小鼠脏器组织荷菌数的检测 攻毒3 d后,取各组小鼠的肺、肝、脾、肾脏,称重并记录,计算组织重量。研磨后,用PBS缓冲液进行10倍稀释,分别取100、10-1、10-23个稀释度的组织悬液各1 mL,均匀涂布于TSA-YE固体培养基,37℃培养18~24 h,平板计数法统计细菌菌落数(以CFU/mL为单位)。
1.5.9 小鼠脏器病理组织的检测 攻毒14 d后,取各组小鼠的肺、肝、脾、肾脏,置10%福尔马林中浸泡24 h;更换福尔马林,进行固定及保存,送安徽医科大学制作病理组织切片,进行镜下观察。
1.6 统计学分析 应用SPSS 20.0统计软件进行统计学分析,通过Graphpad.7.0软件进行数据绘图,数据均采用均值±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 ER-SS2二联油乳剂灭活疫苗的检定
2.1.1 性状(V-AEr31+V-HF2)+ISA 201VG及(V-AEr31+ISA 201VG)+(V-HF2+ISA 201VG)两种疫苗外观检查均呈乳白色,为颗粒均匀的混悬液,无沉淀、凝块、分层及其他异物;黏度均为3 s;均未出现破乳现象;均为水包油包水型乳剂。符合油乳剂灭活疫苗性状检验要求。
2.1.2 无菌检验(V-AEr31+V-HF2)+ISA 201VG及(V-AEr31+ISA 201VG)+(V-HF2+ISA 201VG)两种疫苗于TSB-YE液体培养基中振荡培养3 d仍清澈透明;于TSA-YE固体培养基和鲜血琼脂培养基上培养72 h均无细菌生长。符合油乳剂灭活疫苗无菌检验要求。
2.1.3 安全检验 免疫(V-AEr31+V-HF2)+ISA 201VG及(V-AEr31+ISA 201VG)+(V-HF2+ISA 201VG)14 d后,20只小鼠均健康存活、吸收良好,无明显全身及局部不良反应。符合油乳剂灭活疫苗安全检验要求。
2.2 免疫效果评价
2.2.1 小鼠血清中IgG抗体水平 Ⅰ、Ⅱ组小鼠各时间点的血清IgG抗体水平相同,且均显著高于Ⅲ组(F=2.00,P<0.05),见表2。

表2 ER-SS2二联油乳剂灭活疫苗免疫小鼠血清中的IgG抗体水平Tab.2 IgG antibody titer in sera of mice immunized with oil emulsion-inactivated ER-SS2 combined vaccine
2.2.2 小鼠血清的功能性抗体水平 菌悬液分别为AEr21、BZ1、AEr21-BZ1时,Ⅰ、Ⅱ组各时间点细菌数均低于补体对照的50%,均有杀菌作用,且均显著低于Ⅲ组(F=123.63,P<0.05);Ⅰ、Ⅱ组细菌数差异均无统计学意义(F=1 648,P>0.05)。见图1。表明Ⅰ、Ⅱ组小鼠血清对ER和SS2均有杀菌作用。
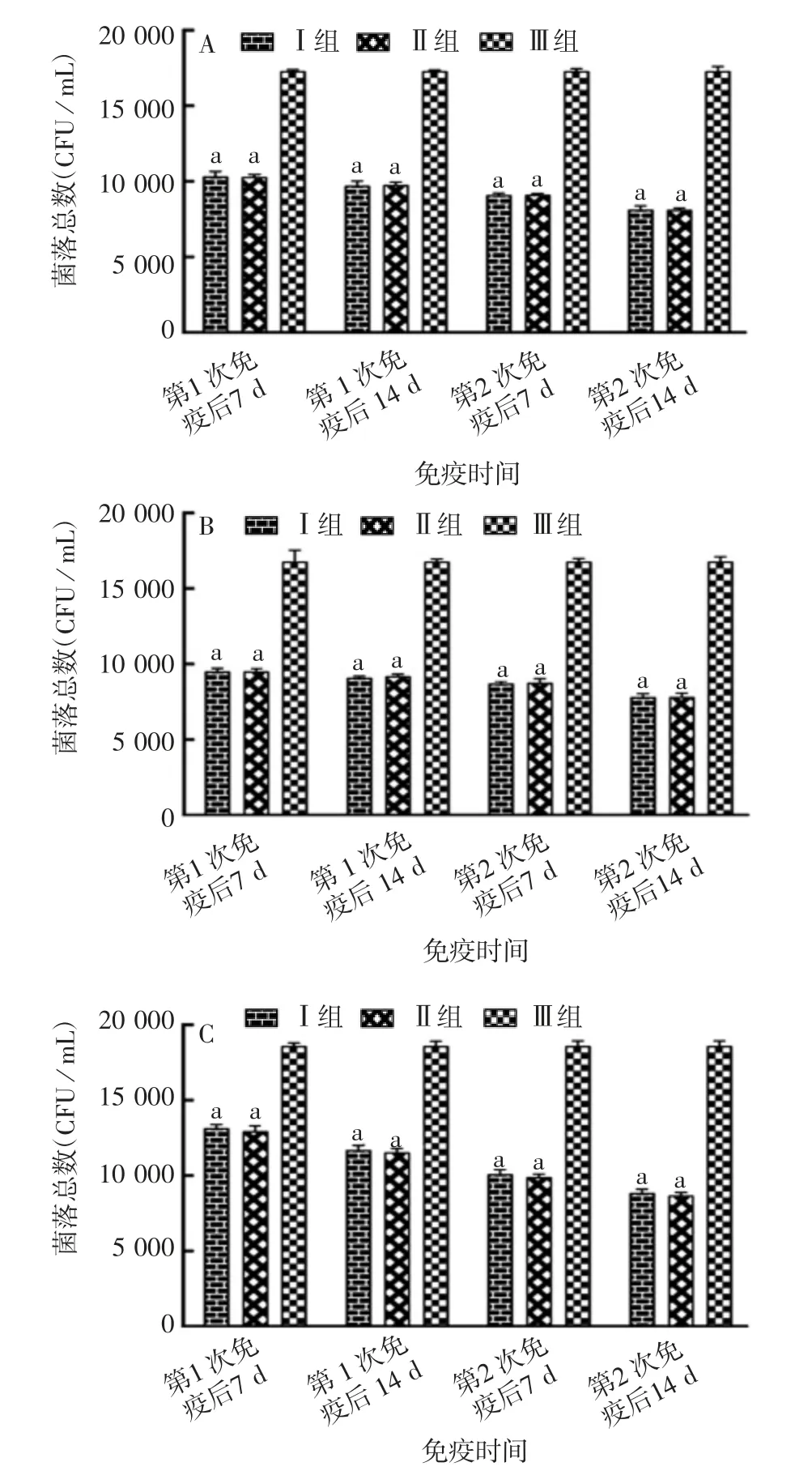
图1 小鼠血清杀菌试验结果Fig.1 Serum germicidal test in mice
2.2.3 小鼠血清中相关细胞因子的水平 各时间点的Ⅰ、Ⅱ组小鼠血清中IL-4、IL-10、IFNγ、TNF-β、MCP-1水平均明显高于Ⅲ组(F=2.36,P<0.05),且相同时间点Ⅰ、Ⅱ组间差异无统计学意义(F=132.00,P>0.05),见图2。表明两种方式制备的ER-SS2二联油乳剂灭活疫苗均可诱导小鼠产生较高水平的细胞因子。
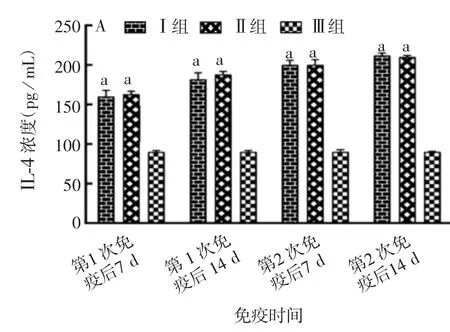
图2 小鼠血清中IL-4(A)、IL-10(B)、IFNγ(C)、TNF-β(D)及MCP-1(E)的水平Fig.2 Results of detection of IL-4(A),IL-10(B),IFNγ(C),TNF-β(D)and MCP-1(E)in sera of mice
2.2.4 小鼠脾淋巴细胞的增殖水平 在整个免疫周期中,Ⅰ、Ⅱ组小鼠的SI呈上升趋势,Ⅲ组变化较小;各时间点Ⅰ、Ⅱ组小鼠的SI显著高于Ⅲ组(F=2.806,P<0.05),Ⅰ与Ⅱ组间差异无统计学意义(F=26.905,P>0.05)。见表3。表明两种方式制备的ER-SS2二联油乳剂灭活疫苗均能有效地刺激脾细胞增殖,使其淋巴细胞不断活化、增殖和分化,诱导适应性免疫反应。

表3 小鼠脾淋巴细胞增殖试验结果Tab.3 Splenic lymphocyte proliferation test in mice
2.2.5 小鼠外周血中CD4+及CD8+T细胞亚群的百分比 各时间点Ⅰ、Ⅱ组小鼠外周血中CD4+/CD3+、CD8+/CD3+均显著高于Ⅲ组(F=14.00,P<0.05),Ⅰ、Ⅱ组间差异无统计学意义(F=2.80,P>0.05),见图3。表明两种方式制备的ER-SS2二联油乳剂灭活疫苗均可诱导小鼠T细胞亚群比率持续升高。
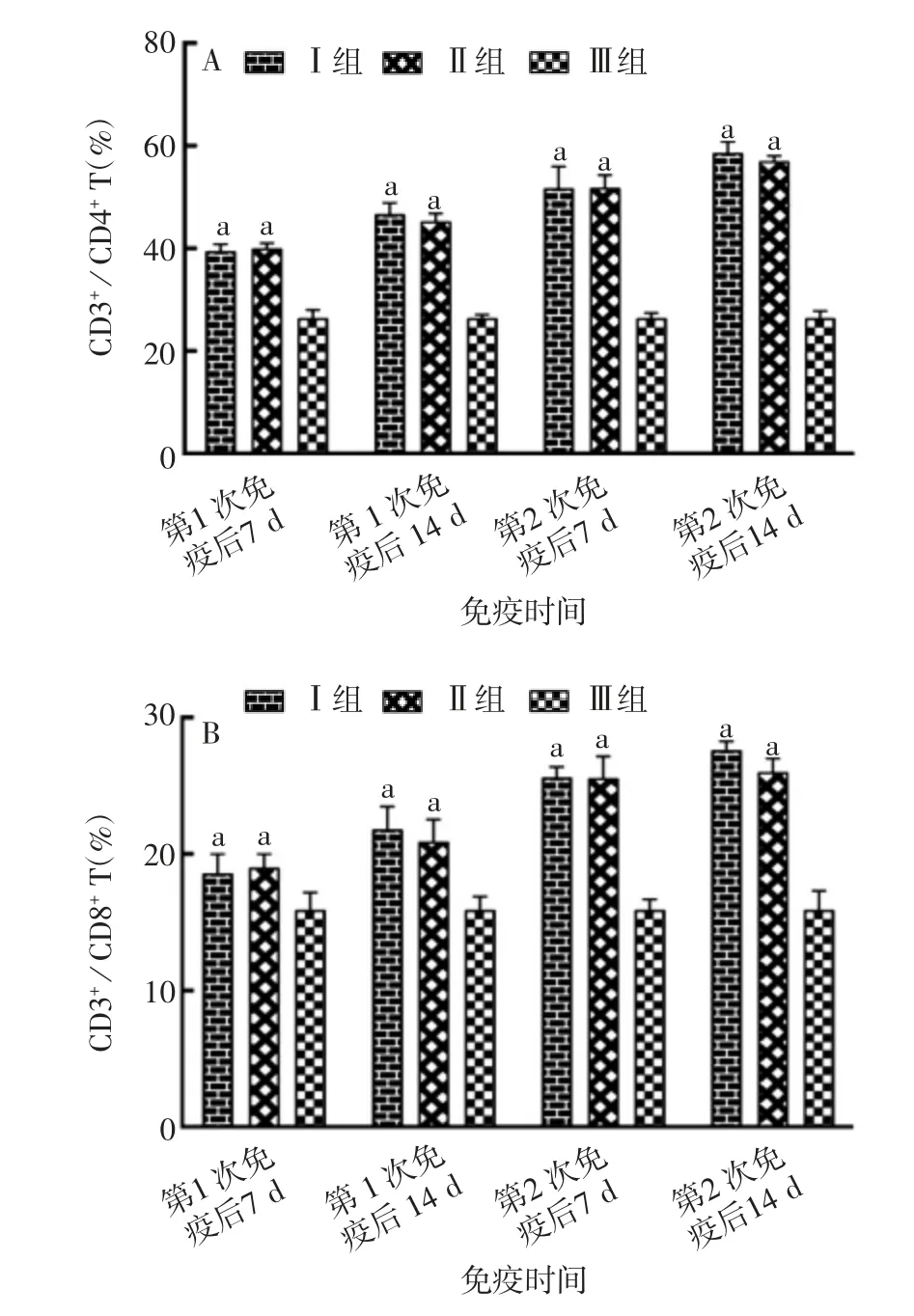
图3 小鼠外周血中CD4+(A)及CD8+(B)T细胞亚群的百分比Fig.3 Percentage of CD4+(A)and CD8+(B)T cell subsets in peripheral blood of mice

续图2小鼠血清中IL-4(A)、IL-10(B)、IFNγ(C)、TNF-β(D)及MCP-1(E)的水平Fig.2(Continued)Results of detection of IL-4(A),IL-10(B),IFNγ(C),TNF-β(D)and MCP-1(E)in sera of mice
2.2.6 免疫保护率测定结果 第2次免疫14d后,Ⅴ1、Ⅴ2、Ⅴ3组所有小鼠均死亡,Ⅳ1、Ⅳ2、Ⅳ3组所有小鼠均存活,试验成立。Ⅰ、Ⅱ组小鼠均存活,免疫保护率为100%,Ⅲ组小鼠均死亡,免疫保护率为0%。表明两种方式制备的ER-SS2二联油乳剂灭活疫苗均能使小鼠产生良好的免疫保护力,可100%抵御ER和SS2强毒株攻击。
2.2.7 小鼠脏器的组织荷菌数 Ⅰ、Ⅱ组小鼠的肺、肝、脾、肾脏组织的细菌定植量均显著低于Ⅲ组(F=26.00,P<0.05),且Ⅰ、Ⅱ组小鼠间差异无统计学意义(F=1.157,P>0.05),见图4。表明两种方式制备的ER-SS2二联油乳剂灭活疫苗均能有效清除ER和SS在体内的定植。

图4 攻毒后小鼠各脏器组织中的荷菌量Fig.4 Loads of bacteria in various organs of mice after virus challenge
2.2.8 小鼠脏器病理组织学观察
2.2.8.1 肺脏 Ⅳ1、Ⅳ2和Ⅳ3组整体结构正常;Ⅴ1组有明显炎症细胞浸润,Ⅴ2组部分肺泡萎缩,组织有少量炎症细胞浸润,Ⅴ3组肺泡壁明显增厚,肺间质可见淤血;Ⅰ1、Ⅱ1组肺间质轻微充血,组织未见明显炎症细胞浸润,Ⅰ2、Ⅱ2组整体结构正常,未见明显炎症,Ⅰ3、Ⅱ3组肺间质轻微充血;Ⅲ1组肺泡壁增厚,组织可见少量炎性细胞浸润,Ⅲ2组肺间质可见明显充血,Ⅲ3组肺泡壁增厚,明显实质化,组织可见少量炎性细胞浸润。见图5。

图5 各组小鼠肺脏病理组织切片镜下观察(HE染色,×20)Fig.5 Histopathological changes of lung of mice in various groups(HE staining,×20)
2.2.8.2 肝脏 Ⅳ1、Ⅳ2和Ⅳ3组整体结构正常;Ⅴ1、Ⅴ2组肝窦间隙增大、轻微充血,肝窦间隙巨噬细胞明显增多,Ⅴ3组肝组织中央静脉轮廓不清晰,肝窦间隙增大,轻微充血,组织有少量炎症细胞浸润;Ⅰ1、Ⅱ1组肝窦间隙轻微增大,组织未见明显炎症细胞浸润,Ⅰ2、Ⅱ2组部分肝细胞轻微水肿,组织未见明显炎症细胞浸润,Ⅰ3、Ⅱ3组结构基本正常;Ⅲ1组肝细胞排列紊乱,可见肝细胞固缩坏死,部分水肿至空泡变性,Ⅲ2组肝窦间隙明显增大,肝细胞溶解坏死,Ⅲ3组肝组织中央静脉轮廓不清晰,肝细胞结构疏松,有炎性细胞浸润。见图6。
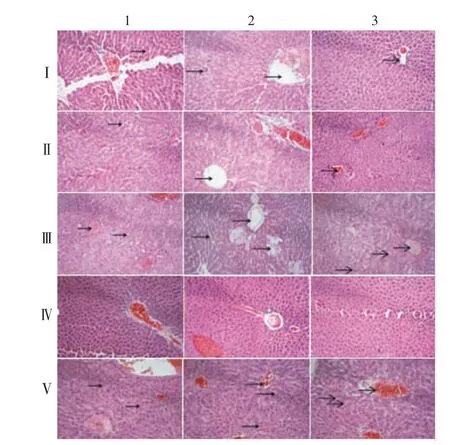
图6 各组小鼠肝脏病理组织切片镜下观察(HE染色,×20)Fig.6 Histopathological changes of liver of mice in various groups(HE staining,×20)
2.2.8.3 肾脏 Ⅳ1、Ⅳ2和Ⅳ3组整体结构基本正常;Ⅴ1组肾小管上皮疏松水肿脱落,Ⅴ2组部分肾小管上皮疏松水肿脱落,Ⅴ3组肾间质大量充血,组织可见明显炎症细胞浸润;Ⅰ1、Ⅱ1组血管轻微充血扩张,无明显炎症细胞浸润,Ⅰ2、Ⅱ2组组织结构基本正常,Ⅰ3、Ⅱ3组肾小管上皮细胞轻微脱落水肿,未见明显炎症细胞浸润;Ⅲ1组肾小管上皮细胞轻微脱落水肿,肾间质明显充血,Ⅲ2组肾小管上皮细胞明显脱落水肿,组织有少量炎症细胞浸润,Ⅲ3组肾小管上皮细胞大量坏死,坏死区上皮细胞核固缩,溶解消失,组织少量炎症细胞浸润。见图7。
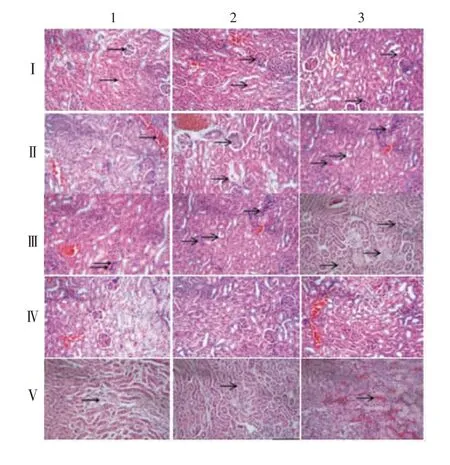
图7 各组小鼠肾脏病理组织切片镜下观察(HE染色,×20)Fig.7 Histopathological changes of kidney of mice in various groups(HE staining,×20)
2.2.8.4 脾脏 Ⅳ1、Ⅳ2和Ⅳ3组整体结构正常;Ⅴ1组整体结构异常,红髓白髓界限不分明,脾正常结构消失,呈均质伊红色一片,组织有明显粒细胞浸润,Ⅴ2组脾小结结构不清,红髓白髓界限不分明,脾正常结构消失,Ⅴ3组脾小结结构不清,红髓白髓界限不分明,呈均质伊红色一片,组织可见明显粒细胞浸润;Ⅰ1和Ⅱ1两组脾组织可见少量粒细胞浸润,Ⅰ2、Ⅱ2组和Ⅰ3、Ⅱ3组脾组织整体结构基本正常;Ⅲ1组脾间质可见明显充血,组织可见大量粒细胞浸润,Ⅲ2、Ⅲ3组脾小结结构不清,红髓白髓界限不清,组织淋巴细胞稀疏,组织可见少量粒细胞浸润。见图8。
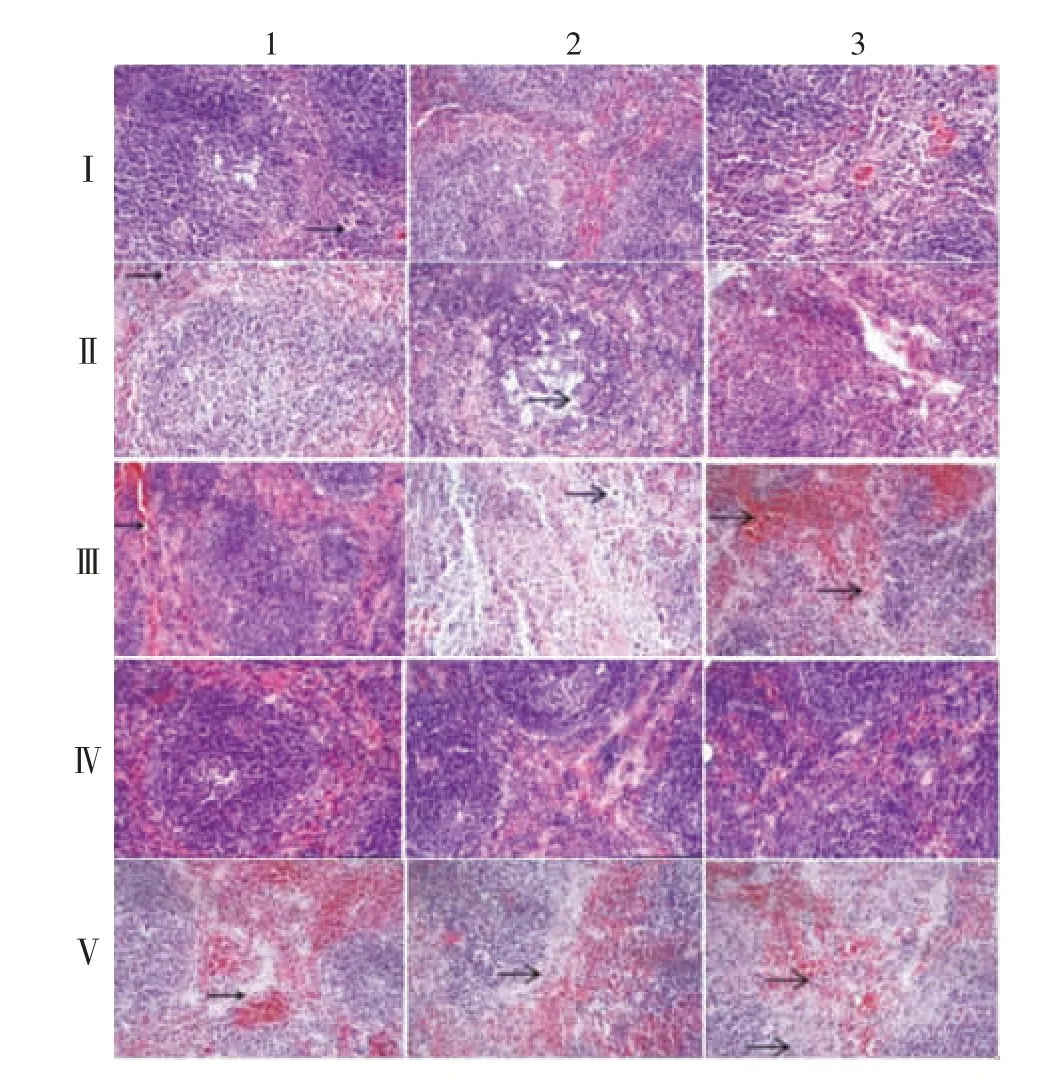
图8 各组小鼠脾脏病理组织切片镜下观察(HE染色,×20)Fig.8 Histopathological changes of spleen of mice in various groups(HE staining,×20)
3 讨论
近年,猪丹毒在国内外多个地区呈散发流行态势,检出率逐渐增多,病死率也随之上升,国内猪链球菌病的流行也较严重,不仅给养猪业带来了较大损失,也严重威胁公共卫生安全[11-12]。细菌耐药现象使猪丹毒与猪链球菌病的防控成本和风险日趋增加,疫苗免疫仍是目前防控这两种病的有效措施。
多联灭活疫苗的免疫效果与其制苗菌株所引起机体产生免疫应答水平密切相关[13],不同血清型ER和SS菌株的生物学特性和毒力存在差异,相同血清型菌株间的毒力和抗原性也不尽相同,因此接种后免疫效果可能出现不确切的现象[10]。体液免疫应答是评价疫苗免疫效果的重要指标,IgG抗体是介导体液免疫的主要抗体,在机体抗感染过程中发挥主要作用[14]。细菌性灭活疫苗清除体内的病原菌主要是通过特异性抗体、补体与吞噬细胞表面受体结合,介导吞噬细胞发挥对病原菌的调理吞噬作用[15]。通过血清杀菌试验检测免疫血清中特异性抗体的调理吞噬活性,可直接反映功能性抗体水平,从而准确评估疫苗的保护效力[16]。本研究采用两种不同混合方式制备了ER-SS2二联油乳剂灭活疫苗,免疫小鼠后产生的IgG抗体效价均为1∶25 600,表明这两种灭活疫苗通过诱导IgG抗体来介导体液免疫,小鼠血清中IgG抗体水平越高,补体介导的杀菌效应越强,血清杀菌效果越好。综上所述,由两种方式制备的ER-SS2二联油乳剂灭活疫苗均可诱导小鼠产生大量特异性抗体与功能性抗体,可与机体免疫系统结合杀伤病原菌,具有良好的免疫效果。
脾淋巴细胞增殖能力与免疫系统应对细菌性疾病所引起的细胞免疫水平较为一致。Th细胞(CD4抗原)基于分泌性质及功能的差异又分为Th1和Th2亚型,Th1细胞可分泌IFNγ、TNF-β等细胞因子,介导细胞免疫应答;Th2细胞可分泌IL-4和IL-10等,介导体液免疫应答[17]。Tc细胞(CD8抗原)可分泌IFNγ、TNF-β等细胞因子。MCP-1作为炎症反应的始动因子,可同时作用于Th1和Th2的细胞分化[6]。本研究结果显示,两种方式制备的ER-SS2二联油乳剂灭活疫苗均能有效刺激小鼠脾淋巴细胞增殖,使其淋巴细胞不断活化、增殖和分化,诱导适应性免疫反应,同时刺激CD4+/CD3+T和CD8+/CD3+T细胞比例持续升高,诱导机体产生细胞免疫,促进体液免疫的同时刺激机体产生较高水平细胞因子,以达到机体产生持久的免疫保护效果。
SS多定植于扁桃体,当定植与免疫之间平衡破坏时,SS可从扁桃体向周围淋巴组织扩散[19],ER也可通过消化道或损伤的皮肤黏膜侵入机体,两种病原菌与机体相互对抗,发生炎症反应,进入血液,随后侵袭相应组织器官,使机体对应部位形成病灶,造成损伤或死亡[18]。本研究于第2次加强免疫小鼠后14 d,经小鼠腹腔注射ER、SS2和ER-SS2菌液进行攻毒,通过免疫保护率、组织荷菌数及病理组织变化等指标对两种方式制备的ER-SS2二联油乳剂灭活疫苗的免疫效力进行了评估,结果表明,两种方式制备的灭活疫苗不仅对ER、SS2和ER-SS2混合感染具有100%的保护力,同时免疫后小鼠各器官组织荷菌数显著降低(P<0.05),且病变轻微。表明小鼠接种疫苗后获得特异性免疫的能力,受到外来抗原刺激时机体迅速启动免疫应答反应,效应细胞与效应分子共同作用清除抗原物质,使机体免受外来抗原侵袭,从而对ER和SS2产生良好的免疫保护力及较强的清除细菌定植能力。
综上所述,两种方式制备的ER-SS2二联油乳剂灭活疫苗免疫小鼠后均能产生良好的体液免疫和细胞免疫,可100%抵抗ER、SS2和ER-SS2强毒株的攻击,本研究为该疫苗进一步应用于猪的临床实践奠定了基础,也为有效防控猪丹毒和猪链球菌病提供了实验依据。

