精氨酸水平对梅花鹿仔鹿瘤胃发酵参数和菌群结构的影响
范玉洁,司华哲,王晓旭,杨乾龙,张新宇,钟伟,王凯英
(中国农业科学院特产研究所,特种经济动物分子生物学国家重点实验室,吉林长春 130112)
幼龄反刍动物断奶后因固体饲料的摄入其消化方式开始由非反刍向反刍转变,瘤胃发酵功能和微生物区系不断完善,瘤胃内环境逐渐趋于稳定[1]。大量研究表明[2-5],通过调整幼龄反刍动物饲粮结构,可调控瘤胃发育、完善瘤胃微生物群落和微生态系统,促进反刍动物健康生长。离乳期是梅花鹿生长发育的关键时期,仔鹿身体各器官功能及各系统构建均不完善,可塑性极强。因此,调整仔鹿饲粮结构,会对梅花鹿的生长发育以及后续鹿茸生产产生直接影响。精氨酸(arginine,Arg)作为幼龄哺乳动物的条件性必需氨基酸,是机体合成蛋白质最重要的氮源,精氨酸对各种营养物质的代谢起着重要的协同平衡作用,进而调控动物的生长发育[6-7]。目前精氨酸在营养方面的研究主要集中于单胃动物,在反刍动物尤其是幼龄反刍动物上的研究则相对较少。本研究以离乳期梅花鹿为试验对象,在其饲粮中添加不同水平的精氨酸,调整基础饲粮结构,探究精氨酸水平对离乳期梅花鹿瘤胃发酵参数和微生物菌群结构的影响,为精氨酸在仔鹿饲粮中的合理利用提供理论依据。
1 材料与方法
1.1 试验设计
选取3月龄健康离乳雄性梅花鹿仔鹿12只,随机分为3组,每组4只,各组之间体重差异不显著(P>0.05)。仔鹿饲喂蛋白质水平为12.28%的低蛋白质饲粮,精氨酸水平分别为0.80%(A组)、1.08%(B组)、1.26%(C组)。按照各组饲粮精粗比相同,赖氨酸和蛋氨酸含量一致的原则,试验饲粮以玉米(Zea mays)、豆粕、酒糟蛋白、玉米胚芽、苜蓿(Medicago sativa)草粉、糖蜜、食盐、预混料等为原料,按不同比例配制成颗粒化全混合日粮(total mixed rations,TMR)。试验饲粮组成及营养水平见表1,试验饲粮氨基酸含量见表2。试验于2019年8月27日至10月10日在中国农业科学院特产研究所茸鹿试验基地进行。每天06:30和14:30分2次定量饲喂,自由饮水。试验期为50 d,其中预试期为15 d,正试期为35 d。
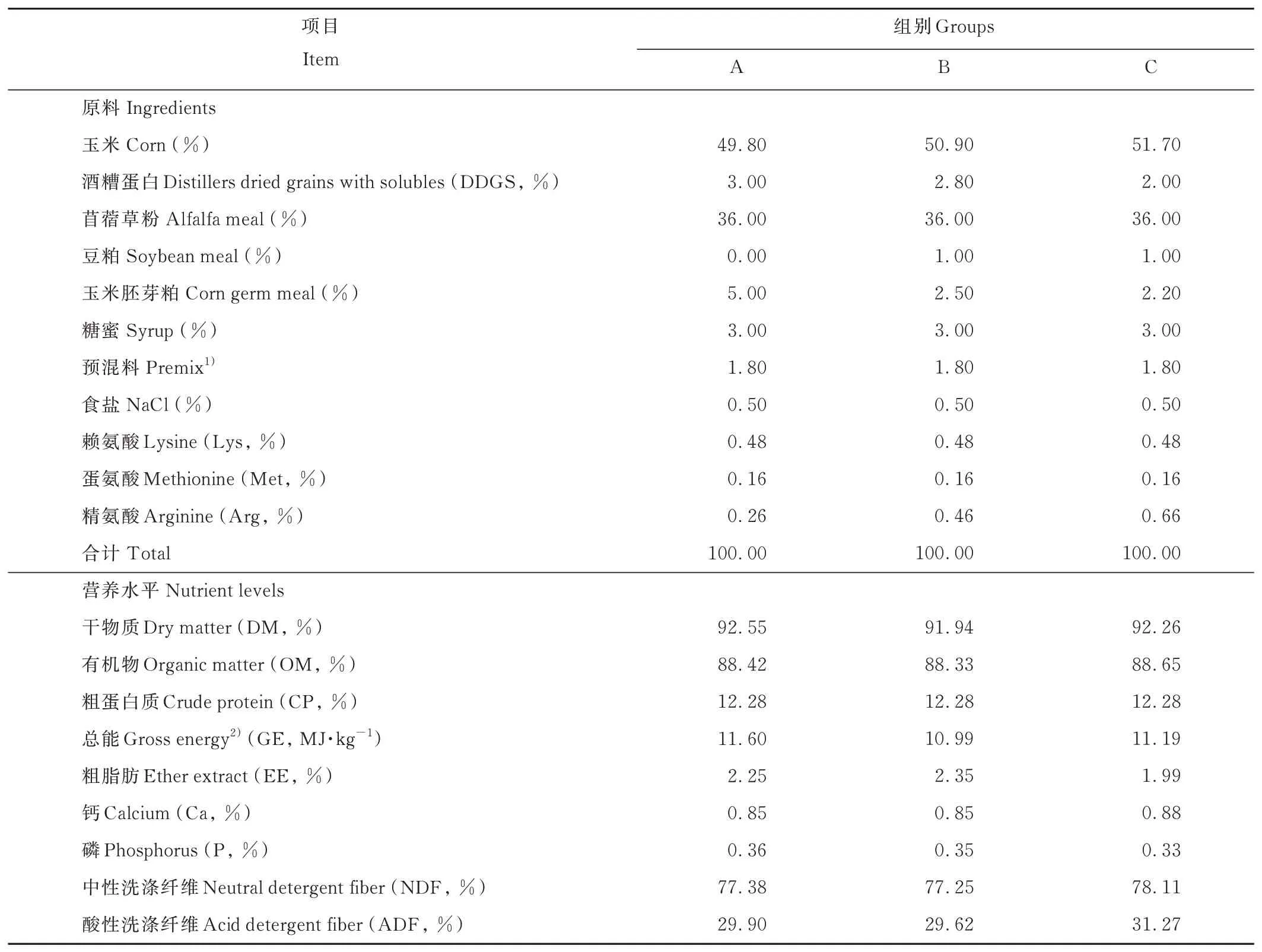
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experiment diets(air-dry basis)
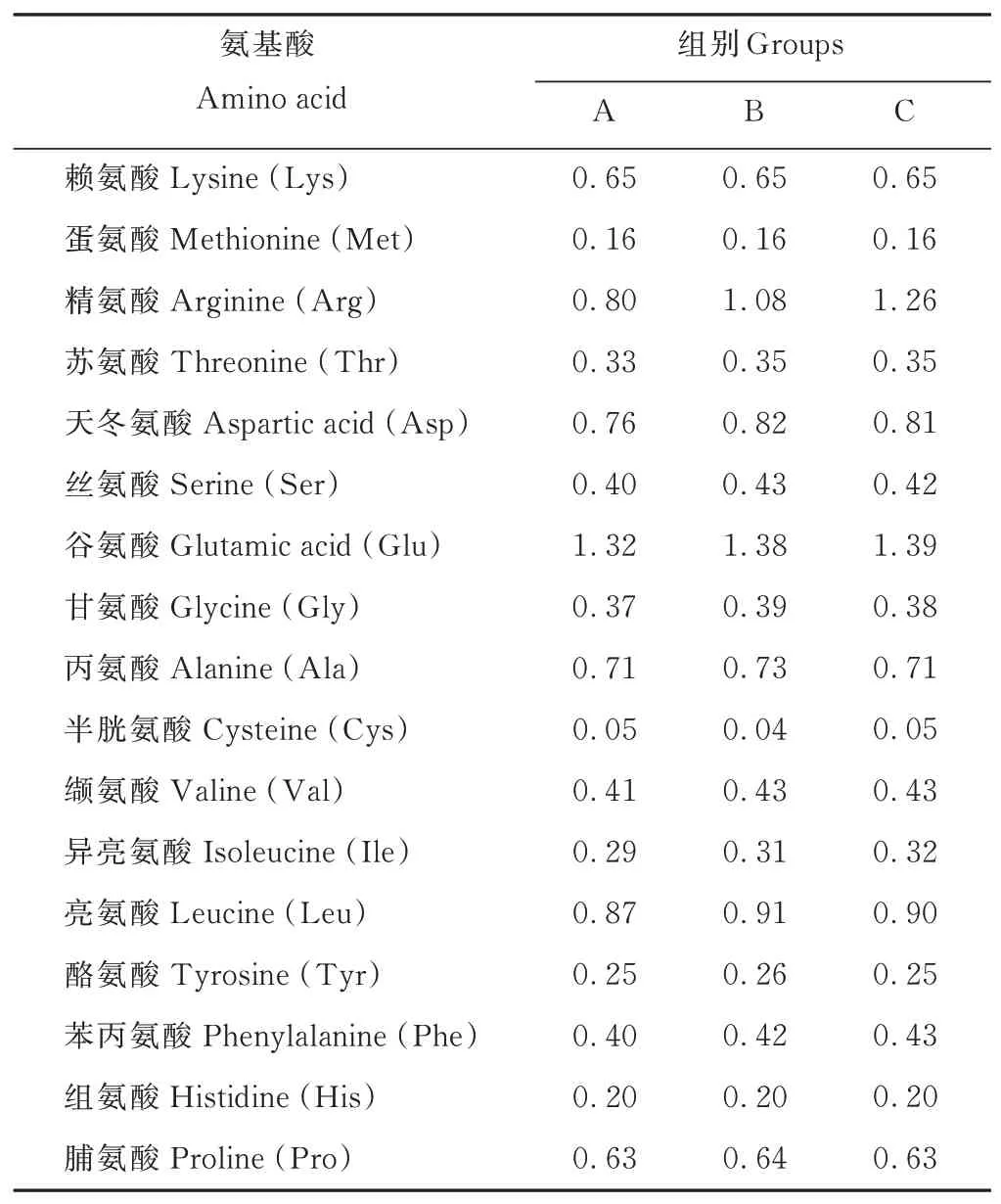
表2 试验饲粮氨基酸含量(风干基础)Table 2 Amino acid contents of experiment diets(air-dry basis,%)
1.2 样品采集
试验第50天,晨饲前麻醉仔鹿,使用瘤胃管通过口腔抽取瘤胃液20 mL,分装在冻存管中,立即投入液氮,带回实验室将瘤胃液保存于-80℃,一部分用于测定瘤胃发酵参数,另一部分用于提取DNA,测定瘤胃细菌的多样性。
1.3 指标测定及方法
1.3.1瘤胃发酵参数的测定 瘤胃液pH值采用PHS-3C型pH计(江苏)进行测定;挥发性脂肪酸(volatile fatty acid,VFA)浓度的测定参考Li等[8]的方法,采用安捷伦6890气相色谱仪(美国)进行测定,主要测定瘤胃液中乙酸(acetic acid,ACE)、丙酸(propionic acid,PRO)、丁酸(butyric acid,BUTY)、异丁酸(isobutyric acid,ISOB)、异戊酸(isovaleric acid,ISOV)和戊酸(valeric acid,VAL)浓度,并计算乙酸/丙酸(乙丙比)和总挥发性脂肪酸(total volatile fatty acid,TVFA)浓度;氨态氮(NH3-N)浓度的测定参考冯宗慈等[9]改进的比色法。
1.3.2瘤胃细菌多样性分析 将采集到的瘤胃液送至天津诺禾致源生物信息科技有限公司进行16S rDNA测序。方法如下:采用CTAB或SDS方法对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng·μL-1。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物,对应区域为16S V4区引物(515F和806R),选择New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测并进行PCR产物等浓度混样,充分混匀后使用1×TAE的琼脂糖凝胶电泳进行纯化,选择并回收主带大小在400~450 bp的序列作为目标条带,使用胶回收试剂盒(qiagen公司)进行回 收。使 用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq 6000进行上机测序。
测序得到的原始数据(raw data)进行拼接、过滤,得到有效数据(clean data)。利用Uparse软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部有效数据进行聚类,默认以97%的一致性(identity)将 序 列 聚 类 成 为OTUs(operational taxonomic units分类单元),筛选出OTUs的代表序列,进行物种注释分析(设定阈值为0.8~1.0)。对OTUs进行Alpha和Beta多样性指数组间差异分析,使 用Qiime软 件(Version 1.9.1)计 算ACE,Chao1,Shannon,Simpson,Goods-coverage指 数;计 算Weighted Unifrac距离、构建非加权组平均聚类分析(unweighted pair-group method with arithmetic means,UPGMA)样本聚类树。使用R软件(Version 2.15.3)绘制主坐标分析图(principal co-ordinates analysis,PCoA),通过Amova分析来检验不同组间差异显著性。
1.4 数据统计与分析
运用Excel 2019进行试验数据初步整理后,采用SAS 9.4软件的ANOVA进行单因素方差分析,采用Duncan氏法进行多重比较分析组间差异显著性,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 精氨酸水平对梅花鹿仔鹿瘤胃发酵参数的影响
由表3可知,瘤胃pH随着精氨酸水平的升高而逐渐降低,B组瘤胃液pH与A、C组之间无显著差异(P>0.05),A组显著高于C组(P<0.05);C组氨态氮含量极显著低于B组(P<0.01),显著低于A组(P<0.05),A、B组之间无显著差异(P>0.05);精氨酸水平对总挥发性脂肪酸、乙酸、异丁酸、丁酸、戊酸含量和乙丙比产生了极显著或显著影响(P<0.01或P<0.05),对丙酸、异戊酸无显著影响(P>0.05)。其中,A组乙酸、丁酸含量极显著高于B、C组(P<0.01),总挥发性脂肪酸含量显著高于B、C组(P<0.05),B、C组之间无显著差异(P>0.05);B组异丁酸含量极显著低于A组(P<0.01),显著低于C组(P<0.05),A、C组之间无显著差异(P>0.05);A、B组戊酸含量显著高于C组(P<0.05);B组的乙丙比极显著低于A、C组(P<0.01),而A组显著高于C组(P<0.05)。
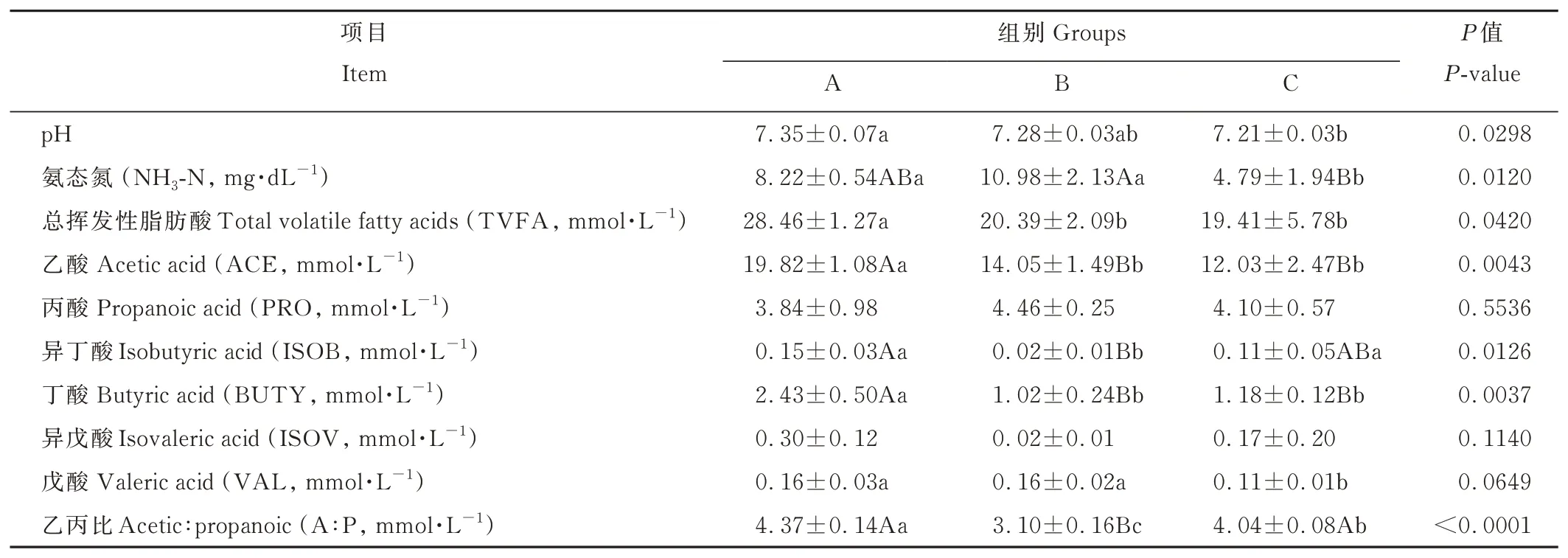
表3 不同精氨酸水平对离乳期梅花鹿瘤胃发酵参数的影响Table 3 Effects of arginine levels on rumen fermentation parameters of weaning sika deer
2.2 精氨酸水平对细菌丰富度和多样性的影响
基于Illumina NovaSeq测序平台进行16S rDNA测序,共获得418397个有效序列,默认以97%的一致性将有效序列进行聚类,如图1显示,共产生2098个OTU,其中1021个是3组共有,占总OTU数量的48.67%,A组特有的OTU数量为245个,B组特有的OTU数量为207个,C组特有 的OTU数量为202个。
基于OTU聚类分析结果,进行Alpha多样性分析。由表4可知,3组ACE和Chao1指数变化趋势一致,Simpson指数和Shannon指数变化趋势相反。其中,B组ACE指数显著高于C组(P<0.05),而A组的ACE指数与B、C组之间均无显著差异(P>0.05);B组的Chao1指数显著高于A、C组(P<0.05),A、C组之间无显著差异(P>0.05)。B组Simpson指数极显著高于A、C组(P<0.01),Shannon指数极显著低于A、C组(P<0.01),而A、C组之间无显著差异(P>0.05)。3组 的 覆 盖 率(Goods_coverage)均 为99%(P>0.05)。

表4 精氨酸水平对离乳期梅花鹿瘤胃微生物α多样性的影响Table 4 Effects of different arginine levels on rumen microbial alpha diversity of weaning sika deer
Beta多样性分析是对不同样本的微生物群落构成进行比较分析,基于Weighted Unifrac距离进行非加权组平均聚类分析(UPGMA)(图2)和主坐标分析(PCoA)(图3),并通过Amova分析(表5)检验各组间细菌群落结构差异显著性,结果显示,B、C组仔鹿瘤胃内细菌群落结构较为相似(P>0.05),而二者与A组群落结构差异显著(P<0.05)。
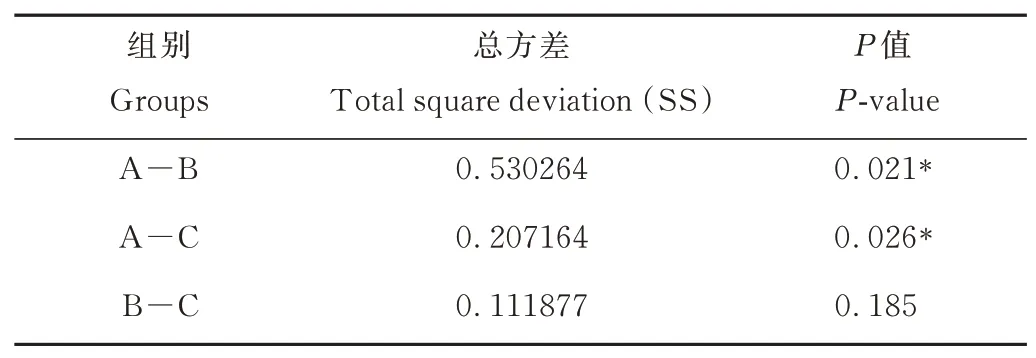
表5 Amova组间差异分析Table 5 Analysis by Amova group differences analysis
2.3 精氨酸水平对瘤胃细菌组成的影响
如图4所示,根据物种注释结果,本研究选取了各组仔鹿瘤胃液细菌在门(phylum)水平上丰度排名前10的物种,生成物种相对丰度柱形累加图,以便直观的了解各组仔鹿瘤胃细菌在门分类水平上相对丰度较高的细菌种类及其比例;由表6可知,3组的优势菌门均为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)。其中,B组拟杆菌门(Bacteroidetes)相对丰度极显著低于A组(P<0.01),且略低于C组(P>0.05);而B组厚壁菌门(Firmicutes)相对丰度显著高于A组(P<0.05);B组变形菌门(Proteobacteria)相对丰度极显著高于A组(P<0.01),显著高于C组(P<0.05);B组广古菌门(Euryarchaeota)相对丰度极显著低于A组(P<0.01);B组放线菌门(Actinobacteria)相对丰度极 显 著 高 于A、C组(P<0.01);A组 螺 旋 菌 门(Spirochaetes)、纤维杆菌门(Fibrobacteres)相对丰度极显著高于B、C组,其中纤维杆菌门(Fibrobacteres)相对丰度在B、C组之间也有显著差异(P<0.05);C组软壁菌门(Tenericutes)相对丰度极显著高于A组(P<0.01),显 著 高 于B组(P<0.05);互 养 菌 门(Synergistetes)相对丰度在3组之间无显著差异(P>0.05)。
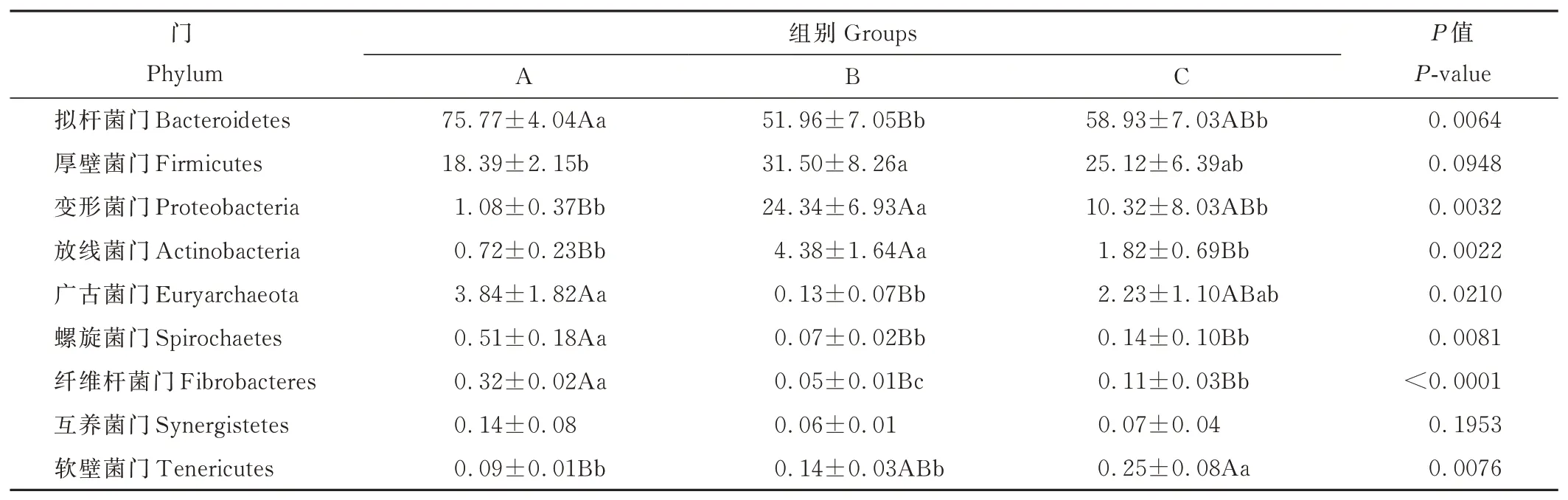
表6 各组仔鹿瘤胃液细菌门水平群落组成Table 6 Rumen bacteria composition on phylum level in three groups of weaning sika deer(%)
如图5所示,根据物种注释结果,选取了在属(genus)水平上相对丰度排名前20的物种,生成物种相对丰度柱形累加图,也能直观的了解各组仔鹿瘤胃细菌在属分类水平上相对丰度较高的细菌种类及其比例;由表7可知,未分类普雷沃氏菌科(unidentified_Prevotellaceae)为3组共有的优势菌,且相对丰度在3组之间无显著差异(P>0.05)。另外,A组的优势菌还包括甲烷短杆菌属(Methanobrevibacter)和未分类疣微菌科(unidentified_Ruminococcaceae),B组的优势菌属还包括琥珀酸弧菌属(Succinivibrio)和戴阿利斯特杆菌属(Dialister),C组的优势菌属还包括琥珀酸弧菌属(Succinivibrio)和解琥珀酸菌属(Succiniclasticum)。A组甲烷短杆菌属(Methanobrevibacter)、奎因氏菌属(Quinella)、纤维杆菌属(Fibrobacter)相对丰度极显著高于B、C组(P<0.01);A组未分类螺旋体科(unidentified_Spirochaetaceae)相对丰度极显著高于B组(P<0.01),显著高于C组(P<0.05);A组Agathobacter、互营球菌属(Syntrophococcus)相对丰度极显著低于B组(P<0.01),显著低于C组(P<0.05);B组琥珀酸弧菌属(Succinivibrio)相对丰度极显著高于A组(P<0.01),显著高于C组(P<0.05);B组戴阿利斯特杆菌属(Dialister)相对丰度显著高于A组(P<0.05);C组解琥珀酸菌属(Succiniclasticum)、未分类毛螺 菌 科(unidentified_Lachnospiraceae)、聚乙酸菌属(Acetitomaculum)相对丰度极显著高于A、B组(P<0.01);C组未分类理研菌科(unidentified_Rikenellaceae)相对丰度显著高于A、B组(P<0.05);未分类韦荣氏球菌科(unidentified_Veillonellaceae)、欧陆森氏菌属(Olsenella)、未分类疣微菌科(unidentified_Ruminococcaceae)、双歧杆菌属(Bifidobacterium)、Kandleria、未分类拟杆菌目(unidentified_Bacteroidales)、厌氧弧菌属(Anaerovibrio)相对丰度在3组之间无显著差异(P>0.05)。
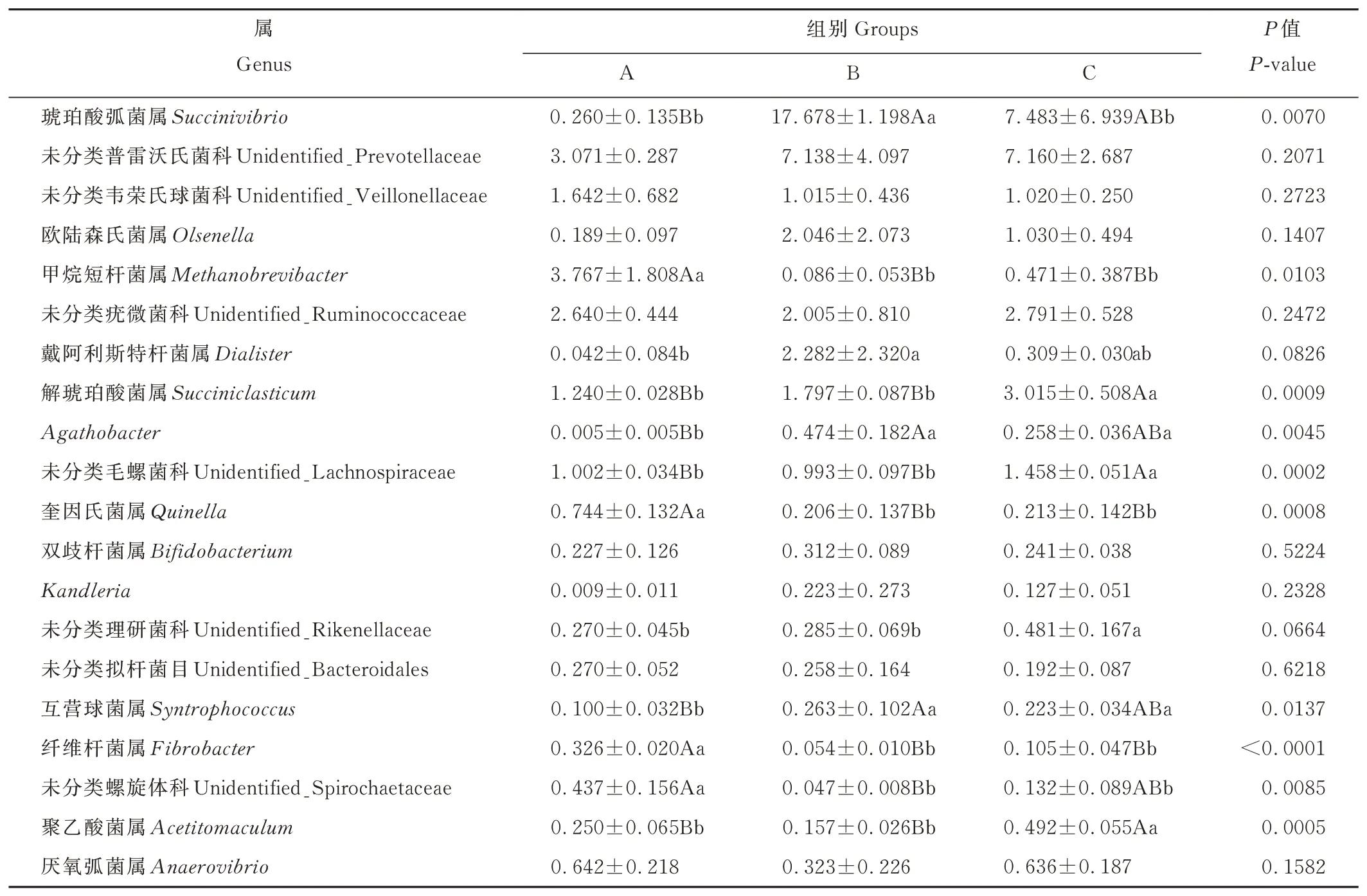
表7 各组仔鹿瘤胃液细菌属水平群落组成Table 7 Rumen bacteria composition on genus level in three groups of weaning sika deer(%)
3 讨论
3.1 精氨酸水平对梅花鹿仔鹿瘤胃发酵参数的影响
瘤胃pH、氨态氮(NH3-N)浓度和挥发性脂肪酸(volatile fatty acid,VFA)比例等参数是研究瘤胃发酵状况的重要指标,能够反映饲料在瘤胃内的发酵程度和模式。瘤胃pH会受到饲粮结构、采食速度、唾液分泌量以及瘤胃内VFA含量的影响,VFA含量以及其在瘤胃中的吸收状况也会因瘤胃pH的波动而受到影响[10-11]。一般情况下,VFA含量增加,瘤胃pH会降低[12-13]。本研究中,随着精氨酸水平的提高,瘤胃pH、乙酸、丁酸以及TVFA含量的变化趋势为逐渐降低。3组试验饲粮结构保持一致,精粗比相同,推测可能与瘤胃微生物种类及数量有关,此外,国内外已有文献报道[14-16],瘤胃中VFA含量增加会解离出更多的H+,致使pH降低,瘤胃内低pH更有利于VFA在瘤胃上皮被吸收(瘤胃pH在正常范围时)。因此,瘤胃pH低,可促进VFA的吸收进而导致其在瘤胃中含量降低,本研究结果与上述研究结论一致。由此可间接推测,饲粮精粗比一致的情况下,精氨酸水平为1.08%和1.26%的饲粮增强了仔鹿瘤胃上皮对VFA的吸收能力,进而提高仔鹿对饲料的消化率[17-18]。此外,本研究发现,3组之间丙酸含量无显著差异,但精氨酸水平为1.08%时仔鹿瘤胃中丙酸含量略高于其他组,而乙丙比极显著或显著低于其他组;表明精氨酸水平为1.08%时,仔鹿瘤胃发酵模式以丙酸型发酵为主,精氨酸水平为0.80%组的仔鹿则以乙酸型发酵为主,精氨酸水平为1.26%时介于两者之间。Ryle等[19]研究表明,瘤胃中发酵产生的乙酸、丙酸和丁酸分别为机体提供的能量为总能量(2805 kJ·mol-1)的62%,109%和78%,因此瘤胃进行丙酸型发酵时能为机体提供更多的能量。Shabat等[20]、李宗军[21]和董春晓等[22]的研究也证实,当瘤胃发酵模式由乙酸型发酵向产生更多丙酸的模式转变时,可以有效提高机体能量代谢和饲料转化效率,促使幼龄反刍动物在早期获得更大的体重。由此可知,仔鹿饲粮中精氨酸水平为1.08%时,可以改变仔鹿瘤胃发酵模式,提高瘤胃供能效率,促进仔鹿生长发育。瘤胃NH3-N主要由饲粮中的氨基酸、蛋白质和非蛋白氮化合物降解产生,是瘤胃微生物合成菌体蛋白的主要氮源[23-24]。精氨酸是机体合成蛋白质和DNA的重要氮源[25-26]。因此,精氨酸水平可能会影响瘤胃NH3-N浓度,进而影响瘤胃中蛋白降解与菌体蛋白合成间的动态平衡。瘤胃NH3-N浓度正常范围是5.0~30.0 mg·dL-1[27]。吕小康[28]的研究结果表明,因山羊羔羊的瘤胃NH3-N浓度降低,导致其微生物蛋白的合成受到抑制。本研究中,随着饲粮精氨酸水平的提高,瘤胃NH3-N浓度呈先上升后下降的趋势,精氨酸水平为1.26%时仔鹿瘤胃氨态氮浓度显著或极显著低于其他两组,且浓度略低于正常范围,说明在特定饲粮组成下,精氨酸水平过高,会使仔鹿瘤胃NH3-N浓度降低,从而造成蛋白降解与菌体蛋白合成之间失衡,而合理提高精氨酸水平能够有效促进瘤胃对饲料的消化吸收,进而提高仔鹿瘤胃微生物活性,促进仔鹿生长。
3.2 精氨酸水平对细菌丰富度和多样性的影响
新生断奶仔鹿在特定饲粮结构的影响下,最终构成特定的瘤胃微生物群落,同时造成仔鹿的采食偏好,影响各细菌群落的生长效率及数量[29-31]。通过比较Chao1,ACE指数,可以反映一个群落或生境中物种数目的多少,即群落丰富度;比较Shannon,Simpson指数,可以反映该样品中的分类总数和每个分类所占的比例,即群落多样性。群落多样性越高,物种分布越均匀,Shannon指数值越大,Simpson与之相反。群落覆盖率(goods_coverage)能够反映是否取样充分。本研究中,由表4可知,3组的覆盖率均为99%,说明本研究取样充分,能较好地反映出瘤胃液中微生物菌群的多样性;精氨酸水平为1.08%组的Chao1指数值显著高于其他组,Simpson指数值极显著高于其他组,Shannon指数值与其相反,说明精氨酸水平为1.08%时,仔鹿瘤胃细菌较其他组丰富,但各物种分布不均,推测其优势菌群占总细菌群落比例较高,需要结合瘤胃细菌丰度分析的结果来验证;另外,本研究通过UPGMA聚类树和PCoA分析,结合Amova组间差异分析,结果发现,精氨酸水平为1.08%和1.26%时,仔鹿瘤胃细菌具有较相似的群落结构,但与精氨酸水平为0.80%组的仔鹿瘤胃细菌存在明显差异。这些结果说明,瘤胃液中的细菌群落因精氨酸水平的差异而发生了变化。Dias等[32]、Jami等[33]和Koringa等[34]对犊牛的研究显示,微生物群落在犊牛生命早期变化很大,随着固体饲料的摄入,大量微生物逐渐引入并以一种特定的、渐进的顺序定殖于瘤胃形成菌群对饲料进行消化利用,随后逐渐建立稳定的瘤胃微生物区系。早期特定的饲粮结构也会影响定殖的微生物群落丰富度和多样性。由此可知,本研究饲粮中精氨酸水平能够影响仔鹿瘤胃细菌的多样性以及改变细菌群落结构,适当提高精氨酸水平能够提高细菌丰富度,改变瘤胃中优势菌群所占的比例。
3.3 精氨酸水平对瘤胃细菌组成的影响
饲料中的碳水化合物被瘤胃内各种细菌发酵,并被转化成各种挥发性脂肪酸。因此,瘤胃内产生的乙酸、丙酸和丁酸的比例除了受到饲料结构和类型的影响外,还与瘤胃细菌的种类和数量有关[35-36]。本研究对瘤胃菌群门水平下的丰度分析中发现,拟杆菌门、厚壁菌门和变形菌门在所有仔鹿的瘤胃细菌中占主导地位。这与前人对幼龄反刍动物的研究结果一致[37-38],说明仔鹿瘤胃菌群中优势菌门不会因精氨酸水平的变化而发生改变,与其他幼龄反刍动物一致;但随着饲粮的变化其相对丰度会发生适应性改变[39]。本研究中,精氨酸水平为1.08%时,与另外两组相比,仔鹿瘤胃中拟杆菌门丰度有所降低,厚壁菌门丰度则显著提高;与拟杆菌门主要分解非结构多糖不同,厚壁菌门与结构多糖的降解有关[40]。在饲粮精粗比一致的条件下,结合本研究未发表有关NDF营养消化率数据显示,精氨酸水平为1.08%时,NDF营养消化率显著高于其他组,表明适当提高精氨酸水平,可以改变拟杆菌门和厚壁菌门的比例,增加的厚壁菌门促进了饲料中纤维素的消化率;Turnbaugh等[41]指出,厚壁菌门更易摄取饲料中可发酵碳水化合物,从而加快机体对营养物质的吸收利用和能量代谢。本研究还发现,精氨酸水平为0.80%和1.26%时,拟杆菌门与厚壁菌门之和均高于精氨酸水平为1.08%组,造成此结果的原因可能是拟杆菌门与厚壁菌门降解饲粮的速率较慢,需要更多细菌参与。来自拟杆菌门的普雷沃氏菌属已被证明是反刍动物瘤胃内丰度最高的菌属[42-43],而本研究中,并未检测到该菌属,但检测到与其相关的未分类普雷沃氏菌科可作为仔鹿的优势菌属,在瘤胃内降解饲料中的碳水化合物、蛋白质、氨基酸等营养物质并通过发酵产生乙酸、丙酸等为机体供能[44]。这与Si等[45]的研究结果类似。另外,精氨酸水平为1.08%时,变形菌门丰度显著高于其他组,该门类下的琥珀酸弧菌属也是该组仔鹿的绝对优势菌属,有研究报道[46-48],琥珀酸弧菌属通过与产甲烷菌争夺H作为底物产生琥珀酸进而通过苹果酸-琥珀酸途径产生丙酸,从而限制甲烷的生成;精氨酸水平为0.80%组的甲烷短杆菌属丰度极显著高于其他两组,是该组仔鹿的优势菌属,该菌属在其他反刍动物瘤胃微生物的研究中也有报道[49-51]。以上结果可知,适宜水平的精氨酸能够增加琥珀酸弧菌属丰度,从而促进瘤胃发酵向丙酸发酵模式转变,还可以降低甲烷的产生;而精氨酸水平过低,会促使甲烷短杆菌属丰度增加,导致甲烷排放量增加,从而对环境造成负面影响。值得注意的是,在精氨酸水平为1.08%组的仔鹿瘤胃内检测到Dialister,为该组菌属丰度排名第3的菌属;据报道[52],Dialister是一种专性厌氧的革兰氏阴性细菌,能够利用琥珀酸脱羧基生成丙酸;Cui等[53]在牦牛犊瘤胃中也检测到Dialister且证实该菌种与牦牛犊的生长性能呈正相关。精氨酸水平为1.26%组检测到的未分类普雷沃氏菌科和琥珀酸弧菌属的丰度相比于其他两组并不占优势,但解琥珀酸菌属的丰度有所增加,该菌属主要功能是将琥珀酸转化为丙酸,为宿主提供能量,但不能发酵饲料中的碳水化合物和氨基酸[54]。因此,精氨酸水平过高可为宿主提供少量丙酸,但并不能促进饲料的消化吸收。
4 结论
在本试验条件下,饲粮精氨酸水平为1.08%时,能够显著提高梅花鹿仔鹿瘤胃菌群丰富度并改变细菌群落结构和优势菌比例;提高厚壁菌门和变形菌门丰度,降低拟杆菌门丰度;提高未分类普雷沃氏菌科、琥珀酸弧菌属和Dialister丰度,能够促使仔鹿的瘤胃发酵方式转变为丙酸型发酵,增强机体供能。

